修回日期: 2006-12-20
接受日期: 2006-12-27
在线出版日期: 2007-03-28
目的: 探讨中药消痰散结方对实验性裸鼠人胃癌血管生成的影响.
方法: 建立裸鼠人胃癌原位种植模型, 将动物随机分为空白对照组、中药组和联合组(n = 10), 中药组予消痰散结方0.2 mL灌胃, 联合组同时予5-FU溶液0.2 mL腹腔注射. 第11周结束实验, 动物行超声探查, 利用TOMTEC imaging system对超声图像进行三维重建, 计算肿瘤组织的三维超声血管容积指数(Ⅵ), 处死动物, 取瘤组织, Envision法免疫组化染色CD34, 计数微血管密度(MVD).
结果: 与空白对照组(2.14±0.43 g)相比, 中药组(1.12±0.38 g, P<0.05)和联合组(0.77±0.26 g,)瘤质量明显减低(P<0.05); 联合组比中药组瘤质量明显减低(P<0.05). 中药组和联合组的血流较空白对照组明显减少. 中药组和联合组Ⅵ和MVD与空白对照组相比, 明显减低(Ⅵ: 18.87%±3.74%, 14.97%±3.61% vs 31.00%±4.06%, P<0.05; MVD: 27.3±8.8, 25.8±8.6 vs 49.3±15.3, P<0.05).
结论: 消痰散结方可以明显抑制裸鼠人胃癌原位种植瘤的血管生成.
引文著录: 郑国静, 于有德, 石健. 消痰散结方对裸鼠人胃癌血管生成的影响. 世界华人消化杂志 2007; 15(9): 936-940
Revised: December 20, 2006
Accepted: December 27, 2006
Published online: March 28, 2007
AIM: To investigate the effect of Xiaotan Sanjie recipe (XSR) on the angiogenesis of nude mice with human gastric carcinoma.
METHODS: The model of nude mice with human gastric carcinoma was made, and then all the mice were randomly divided into group A, B and C, treated with normal saline, XSR (0.2 mL once a day, ig) and XSR (0.2 mL once a day, ig) plus 5-fluorouracil (0.2 mL, once a week), respectively, for 6 wk. The experiment was terminated in the 11th week. All the mice were detected by the color Doppler, and the images were three-dimentionally rebuilt by TOMTEC imaging system to evaluate the vascularity volume index (Ⅵ). All the mice were sacrificed and the tumor tissues were collected for the observation of CD34 using Envision immunohistochemical staining. Finally, the microvessel density (MVD) was calculated.
RESULTS: In comparison with that in group A (2.14 ± 0.43 g), the tumor weight in group B (1.12 ± 0.38 g) and C (0.77 ± 0.26 g) was significantly lighter (both P < 0.05). Meanwhile, the tumor weight was also markedly different between group B and C (P < 0.05). The blood flow was obviously decreased in group B and C as compared with that in group A. In comparison with those in group A, the values of Ⅵ and MVD in group B and C were significantly decreased (Ⅵ: 18.87% ± 3.74%, 14.97% ± 3.61% vs 31.00% ± 4.06%, P < 0.05; MVD: 27.3 ± 8.8, 25.8 ± 8.6 vs 49.3 ± 15.3, P < 0.05).
CONCLUSION: XSR can significantly suppress the angiogenesis of nude mice with human gastric carcinoma.
- Citation: Zheng GJ, Yu YD, Shi J. Effect of Xiaotan Sanjie recipe on the angiogenesis of nude mice with human gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(9): 936-940
- URL: https://www.wjgnet.com/1009-3079/full/v15/i9/936.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i9.936
消痰散结方主要由生南星、生半夏等组成, 是魏品康教授治疗胃癌的经验方, 在临床应用中取得了满意的效果, 对104例中晚期胃癌患者进行的临床疗效观察表明, 消痰散结方能明显提高患者生存质量, 延长生存期[1]. 前期关于消痰散结方抗胃癌的实验研究表明, 消痰散结方可以通过多途径、多靶点抗肿瘤[2-15], 其中可以通过下调VEGF的表达而明显抑制鸡胚绒毛尿囊膜血管生成模型的血管生成[12,14], 本研究旨在通过对肿瘤血管生成定量指标的研究, 进一步探讨消痰散结方抑制动物实验性胃癌血管生成的作用.
BALB/c nu/nu裸鼠, 购于中科院上海斯莱克实验动物有限责任公司, 30只, ♂, 6周龄, 体质量18-20 g, SPF级条件下饲养于上海第二医科大学实验动物科学部. 消痰散结方主要由生南星、生半夏等中药组成, 所用药材均购自上海雷允上药业有限公司, 产地明确, 经第二军医大学药学院生药教研室鉴定. 药物采用传统煎煮方法, 水浴浓缩至生药含量为1 kg/L, 分装备用, 4 ℃冰箱保存. 海普牌生理盐水注射液, 上海旭东海普药业有限公司产品; 海普牌5-FU注射液, 25 g/L, 上海旭东海普药业有限公司产品, 生理盐水稀释至6 g/L; 中西牌氯胺酮注射液, 50 g/L, 上海化学试剂公司产品; 田霞牌OB生物胶, 广州白云医用胶公司产品; 兔抗人CD34一抗, 美国Neomarkers公司产品, 稀释度为1:50; 即用型Envision试剂, 丹麦Dako生物制品有限公司产品; 100 g/L多聚赖氨酸, Sigma生物制品有限公司产品; HDI-5000型彩色多普勒, 德国SIMENS公司产品; TOMTEC imaging systems, 德国汤姆麦克公司产品.
选取传代后14 d的荷瘤鼠备用, 常规消毒, 从右腋部皮下完整剥取瘤块, 剔除纤维包膜, 切开, 选取生长良好、呈乳白色、鱼肉状的瘤组织, 剪成约1 mm×1 mm×1 mm小块, 浸泡于生理盐水中备用. 荷瘤鼠所用细胞株为SGC-7901, 瘤源为第6代. 造模方法参考文献[16]并有所改进: 所有实验动物术前禁食不禁水6 h, 氯胺酮75 mg/kg腹腔麻醉满意后, 常规手术皮肤消毒, 选择左侧正中旁切口进腹, 暴露胃壁, 在胃小弯近胃窦处选择黏膜表面血管丰富的地方用医用缝合针划破胃壁肌浆层, 在破损处放一瘤块, 在瘤块表面滴一滴OB生物胶, 使其覆盖瘤组织表面, 约5 s凝固后将胃壁回纳入腹腔, 3/0丝线关腹. 以上操作均在超净台内进行, 严格遵循无菌操作. 所有动物无麻醉意外, SPF级条件下饲养, 禁食不禁水6 h后正常饲养.
造模后第2周, 采用完全随机设计法, 利用随机数字表将动物随机分为空白对照组、中药组和联合组, 每组10只动物, 空白对照组给予生理盐水0.2 mL灌胃, 每日1次; 中药组给予消痰散结方0.2 mL灌胃, 每日1次; 联合组给予消痰散结方0.2 mL灌胃, 每日1次, 同时给予5-FU溶液0.2 mL腹腔注射(60 mg/kg), 每周1次. 给药时间为6 wk, 第8周停止给药, SPF条件下正常饲养, 每周定期观察各组动物一般情况及成瘤情况, 至第11周结束实验. 活体动物行超声探查, HDI-5000彩色多普勒, 线阵式超宽频探头, 频率为5-12 MHz, 彩色增益为81%, 探测深度为2 cm. 运用TOMTEC imaging systems对影像进行三维重建, 计算肿瘤三维超声血管容积指数(VI), 脱颈椎处死动物, 取瘤, 称取瘤重, 计算抑瘤率, Envision法染色CD34, 计数微血管密度(MVD).
统计学处理 结果以均数±标准差(mean±SD)的形式表达, 多样本均数的两两比较采用q检验, SPSS10.0统计软件进行处理.
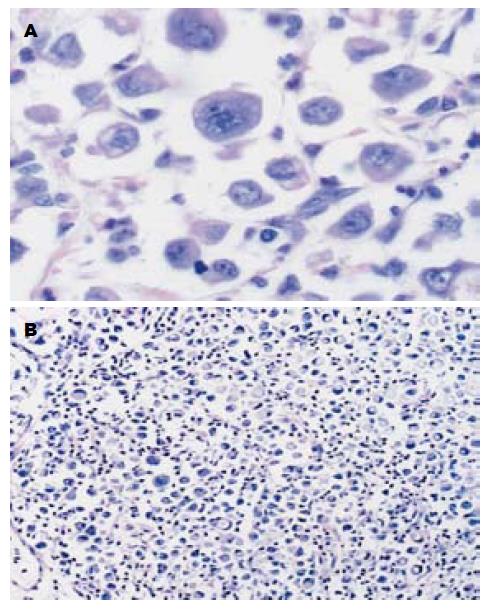
造模后第7周, 空白对照组部分裸鼠可在胃部触及较硬肿块, 后肿块明显增大, 第9周, 其余各组也出现相同情况, 中药组及联合组动物一般情况明显好于空白对照组. 处死动物打开腹腔可以看到, 原位种植瘤呈实质性, 突向腹腔生长, 乳白色, 有包膜, 有分叶, 呈菜花样, 胃被包绕在瘤块中, 瘤块与周围脏器, 如肝脏、肠、肺脏、肾脏等有不同程度的黏连. 部分肿瘤切开后, 中间可见有灰白色液化、坏死的组织. 原位瘤体组织切片HE染色证实为低分化腺癌, 细胞为圆形、椭圆形, 胞质丰富, 核大畸形, 核仁深染, 核分裂相多见, 癌细胞排列成索状、巢状, 细胞间有结缔组织(图1).
抑瘤率 = (空白对照组瘤重-治疗组瘤重)/空白对照组瘤重×100%(表1). 中药组和联合组瘤重与空白对照组相比, 明显减小, 差异有统计学意义(q分别为4.62和6.38, P<0.05), 联合组瘤重与中药组相比, 明显减小, 差异有统计学意义(q = 3.77, P<0.05).
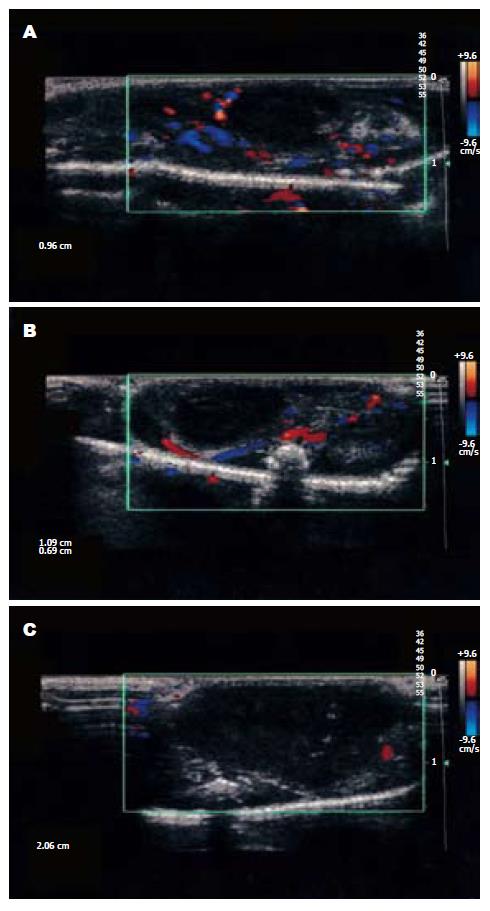
多于瘤内或瘤内、瘤周同时探及混合性血流, 走行不规则, 形成如折转血流、分叉血流、网状血流等, 而且随着肿瘤体积增大, 血供增多, 肿瘤周边血流量较中心丰富, 血流速度也较快, 中药组和联合组的血流较空白对照组明显减少(图2).
通过手动描记肿瘤的边界, 软件自动计算出肿瘤的容积、肿瘤内彩色血管的容积及肿瘤内血管容积指数Ⅵ, Ⅵ(%) = 肿瘤内彩色血管的容积/肿瘤的容积×100%. 中药组和联合组Ⅵ与空白对照组VI相比均明显减少, 差异有统计学意义(q分别为4.47和7.63, P<0.05); 联合组Ⅵ和中药组Ⅵ相比无明显减少, 差异无统计学意义(q = 2.78, P>0.05)(表1).
1970年代初, Folkman[18]提出了"肿瘤生长依赖血管性"的假说. 肿瘤发生时, 首先要经历一个无血管生长期, 其后进入能使肿瘤生长的血管期[19], 肿瘤的生长与转移有赖于肿瘤的血管生成[20-28]. 许多实验证实了肿瘤的生长依赖于血管生成[29-30]: 在鸡胚绒毛尿囊膜(CAM)上生长的肿瘤, 体积大于1 mm3后, 如果3 d内无血管长入, 肿瘤将发生坏死和自溶, 如有血管长入, 肿瘤体积快速生长; 裸鼠皮下移植瘤在无血管期呈线性生长, 而血管长入后呈指数生长; 血管抑制剂对体外生长的肿瘤(无血管供应)无抑制作用, 而对体内生长的肿瘤有抑制作用, 说明抑制血管生成能抑制肿瘤生长.
在本实验中, 运用体视学的方法, 采用超声手段, 对肿瘤血管及血流情况进行彩色多普勒探测, 结果显示, 肿瘤的血流多位于肿瘤周边或肿瘤内部、周边同时出现混合性血流, 血管走行不规则、粗细不均、紊乱, 形成如折转血流、分叉血流、网状血流等, 肿瘤周边血流量较中心丰富, 血流速度也较快, 进一步对肿瘤组织三维重建显示血管树的结果表明, 肿瘤周边血管结构较内部明显丰富, 以小的毛细血管为主, 走行蜿蜒, 在较粗大迂曲的血管间形成交通支, 构成网状, 形成密布的毛细血管网, 而且随着肿瘤体积增大, 内部血管结构减少, 这与肿瘤以微循环改变为特征的病理表现相符. 肿瘤周边血流量较中心丰富, 其机制可能为肿瘤外缘由于靠近正常组织延伸出的毛细血管, 肿瘤细胞尚可被氧合, 而肿瘤组织的毛细血管, 由于存在血管功能不全, 同时还由于肿瘤细胞的增殖, 使肿瘤血管周围压力增高, 压迫肿瘤血管, 出现血流减少甚至中断. 本实验的结果表明, 消痰散结方可以明显减少肿瘤组织的血供, 这可能是中药组和联合组的肿瘤较空白对照组明显减小的机制之一.
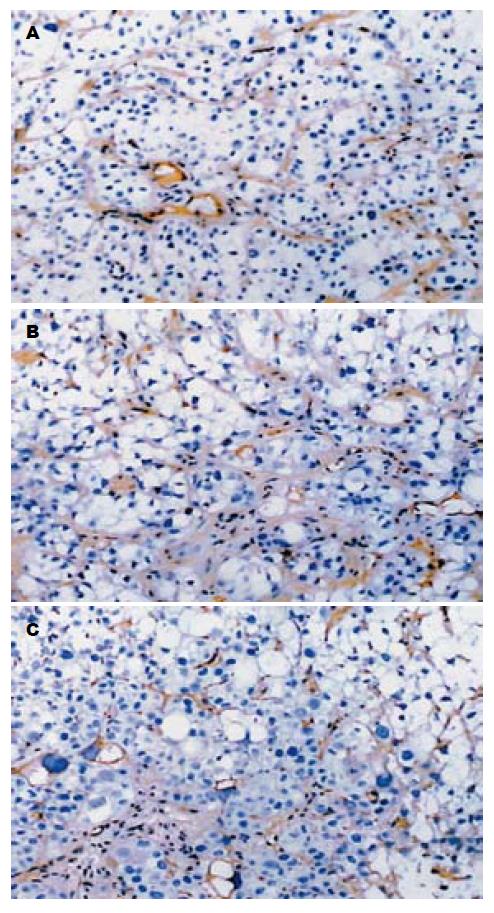
研究表明, MVD可作为衡量肿瘤血管生成的金标准之一[31], 在MVD技术标准方面, 目前多数学者采用Weidner的技术[17], 然而测定的关键在于抗体的选择. 针对MVD检测的抗体, 现应用较广泛的有FⅧ-RA, CD34, CD31等, Martin et al[32]应用上述3种mAb分别标记浸润性乳腺癌组织血管内皮细胞, 进行MVD的检测, 认为CD34抗体在微血管中表达最强, 为最敏感的内皮细胞标记物, 并且CD34标记的MVD对预后的价值也最大.
本实验采用CD34对肿瘤新生血管进行染色, 光镜下可以观察到, 染色部位在血管内皮细胞和小血管壁, 显示在肿瘤细胞间质中清晰可见微血管, 管腔不规则, 管壁不完整, 癌组织内微血管不仅形态异常, 差异显著, 而且密度分布不均, 血管管腔的大小可由裂隙样的细胞簇到能容纳大量血细胞的海绵样结构, 癌组织边缘的微血管多呈簇状和发芽状生长, 部分区域甚至形成血管球样或花蕾状, 血管数量远高于中央区域, 最高微血管染色区域(hotspots)几乎总是在肿瘤与周围组织交界的浸润缘, 这与能量多普勒探查到的肿瘤周边血流量较中心丰富结果一致. 癌组织中微血管不仅在数量上有改变, 其形态结构上也存在明显缺陷, 有的新生微血管基底膜不完整, 管壁仅为一层有较大裂隙的内皮细胞. 本实验的结果表明, 消痰散结方可以明显减少肿瘤组织的MVD.
总之, 消痰散结方可以通过减少肿瘤组织的血供而抑制肿瘤的生长, 其中抑制肿瘤血管生成是其途径之一, 这与我们前期的研究结果一致.
本课题实验过程中, 得到上海长征医院超声诊断科张建全副主任医师和临淄区人民医院病理科全体医师的大力支持, 在此表示衷心的感谢.
血管生成是目前肿瘤研究中的热点问题, 抑制肿瘤的血管生成从理论上可以抑制肿瘤的生长及转移, 但其确切机制及作用通路尚不明确, 就目前的研究来看, 其是多途径、多靶点共同作用的结果. 消痰散结方是魏品康教授的经验方, 前期的实验研究主要是从影响相关基因的表达探讨其抑制胃癌血管生成的机制
自1970年代Folk-man教授提出"血管生成"的概念以来, 这一理论得到了相关实验的证实, 为抗肿瘤治疗提供了新的思路与方法.
作者运用超声探测血流, 可以很直观的观察到血流的变化, 同时运用相关软件的计算功能, 使直观的结果具体化、客观化.
本文主要是研究中药的作用机制, 综合前期的研究结果, 表明中药是多靶点、多途径发挥作用, 同时为消痰散结方进一步的开发提供实验基础.
本文研究了消痰散结方对裸鼠人胃癌血管生成的影响, 文章设计合理, 层次清楚, 观点鲜明, 结果可靠.
编辑: 张焕兰 电编:李琪
| 13. | 许 玲, 魏 品康, 陈 亚琳, 苏 晓妹, 秦 志丰, 施 俊, 李 峻, 何 金. 中药消痰散结方抑制裸鼠原位移植人胃癌SGC-7901的生长转移. 世界华人消化杂志. 2004;12:1015-1020. [DOI] |
| 17. | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred EN, Moore DH, Meli S, Gasparini G. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma. J Natl Cancer Inst. 1992;84:1875-1887. [PubMed] [DOI] |
| 18. | Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182-1186. [PubMed] [DOI] |
| 19. | Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. 1995;1:27-31. [PubMed] [DOI] |
| 20. | Compagni A, Christofori G. Recent advances in research on multistage tumorigenesis. Br J Cancer. 2000;83:1-5. [PubMed] |
| 21. | Detmar M. Tumor angiogenesis. J Investig Dermatol Symp Proc. 2000;5:20-23. [PubMed] [DOI] |
| 22. | Maehara Y, Kabashima A, Koga T, Tokunaga E, Takeuchi H, Kakeji Y, Sugimachi K. Vascular invasion and potential for tumor angiogenesis and metastasis in gastric carcinoma. Surgery. 2000;128:408-416. [PubMed] [DOI] |
| 23. | Sabo E, Boltenko A, Sova Y, Stein A, Kleinhaus S, Resnick MB. Microscopic analysis and significance of vascular architectural complexity in renal cell carcinoma. Clin Cancer Res. 2001;7:533-537. [PubMed] |
| 24. | Zhao HC, Qin R, Chen XX, Sheng X, Wu JF, Wang DB, Chen GH. Microvessel density is a prognostic marker of human gastric cancer. World J Gastroenterol. 2006;12:7598-7603. [PubMed] [DOI] |
| 25. | Lazăr D, Raica M, Sporea I, Tăban S, Goldiş A, Cornianu M. Tumor angiogenesis in gastric cancer. Rom J Morphol Embryol. 2006;47:5-13. [PubMed] |
| 26. | Jiang XT, Tao HQ, Zou SC. Effect of angiogenesis inhibitor SU6668 on the growth and metastasis of gastric cancer in SCID mice. Zhonghua Weichang Waike Zazhi. 2006;9:335-337. [PubMed] |
| 27. | Han HS, Hwang TS. Angiogenesis in gastric cancer: importance of the thymidine phosphorylase expression of cancer cells as an angiogenic factor. Oncol Rep. 2007;17:61-65. [PubMed] [DOI] |
| 28. | Song ZJ, Gong P, Wu YE. Relationship between the expression of iNOS,VEGF,tumor angiogenesis and gastric cancer. World J Gastroenterol. 2002;8:591-595. [PubMed] [DOI] |
| 29. | Carron CP, Meyer DM, Pegg JA, Engleman VW, Nickols MA, Settle SL, Westlin WF, Ruminski PG, Nickols GA. A peptidomimetic antagonist of the integrin alpha(v)beta3 inhibits Leydig cell tumor growth and the development of hypercalcemia of malignancy. Cancer Res. 1998;58:1930-1935. [PubMed] |
| 30. | Thaloor D, Singh AK, Sidhu GS, Prasad PV, Kleinman HK, Maheshwari RK. Inhibition of angiogenic differentiation of human umbilical vein endothelial cells by curcumin. Cell Growth Differ. 1998;9:305-312. [PubMed] |
| 31. | Aceñero MJ, González JF, Gallego MG, Ballesteros PA. Vascular enumeration as a significant prognosticator for invasive breast carcinoma. J Clin Oncol. 1998;16:1684-1688. [PubMed] |
| 32. | Martin L, Green B, Renshaw C, Lowe D, Rudland P, Leinster SJ, Winstanley J. Examining the technique of angiogenesis assessment in invasive breast cancer. Br J Cancer. 1997;76:1046-1054. [PubMed] [DOI] |