修回日期: 2007-01-04
接受日期: 2007-01-31
在线出版日期: 2007-03-28
目的: 分析胃癌细胞株MKN-28中是否包含肿瘤干细胞相关的SP(side population)细胞亚群.
方法: 采用免疫荧光方法检测干细胞标记ABCG2在胃癌细胞株MKN-28的表达; 制备MKN-28细胞悬液, 经Hoechst33342染色, 流式细胞仪分析SP亚群.
结果: ABCG2在胃癌细胞系MKN-28中有少量表达, ABCG2阳性细胞约占1.7%. SP亚群占MKN-28细胞的0.25%, 维拉帕米阻断后减少为0.05%.
结论: 人胃癌细胞株MKN-28中存在SP细胞亚群, 提示胃癌干细胞的存在.
引文著录: 王宁, 陈凛, 卫勃, 赵向阳, 鲁文静, 沈丽. 胃癌MKN-28肿瘤细胞系SP细胞亚群初步分析. 世界华人消化杂志 2007; 15(9): 1000-1003
Revised: January 4, 2007
Accepted: January 31, 2007
Published online: March 28, 2007
AIM: To identify the side population (SP) of cancer stem-like cells in gastric cancer cell line MKN-28.
METHODS: Immunofluorescence assay was used to determine the expression of ABCG2, an indicator of stem cells, in gastric cancer cell line MKN-28. MKN-28 tumor cells suspension was stained with Hoechst33342 and propidiumiodide (PI) with the absence or presence of verapamil. Then the SP was analyzed by fluorescence-activated cell sorter.
RESULTS: A little amount of ABCG2 expression was found in MKN-28 cells, and the ABCG2-positive cells covered a percentage of 1.7%. SP cells accounted for 0.25% of the MKN-28 cells, which was decreased to 0.05% after the treatment of verapamil.
CONCLUSION: SP cancer stem-like cells exist in gastric cancer cell line MKN-28, and they can be decreased by verapamil.
- Citation: Wang N, Chen L, Wei B, Zhao XY, Lu WJ, Shen L. Primary analysis of side population in human a gastric cancer cell line MKN-28. Shijie Huaren Xiaohua Zazhi 2007; 15(9): 1000-1003
- URL: https://www.wjgnet.com/1009-3079/full/v15/i9/1000.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i9.1000
肿瘤干细胞学说认为肿瘤组织中存在极少量肿瘤细胞, 具有自我更新能力和分化潜能, 是肿瘤增殖生长、转移和复发的根源, 肿瘤干细胞已成为肿瘤研究的热点[1]. 但是由于缺乏特异的表面标记, 肿瘤干细胞的分离纯化一直是长久以来各国科学家亟待解决的难题之一. 2001年, 美国德州St.Jude儿童研究医院Brian Sorrentino博士领导的研究人员认为ABCG2是一个"通用的"干细胞标记[2]. ABCG2高表达的细胞可高效外排DNA荧光染料Hoechst33342, 从而能通过流式分选分析系统分选出SP(side population)细胞. 在某些恶性肿瘤中, SP细胞具有肿瘤干细胞的特性, 如人脑瘤、乳腺癌、消化道恶性肿瘤以及肝癌等肿瘤干细胞的研究就是采用了这种方法[3-8]. 目前, 关于胃癌干细胞的研究尚处于探索阶段, 国内外尚无胃癌干细胞分离、鉴定成功的报道. 本研究探讨ABCG2在胃癌细胞系MKN-28中的表达, 对胃癌SP细胞的分选进行了初步尝试, 并成功分析了胃癌细胞系MKN-28的SP亚群, 为我国胃癌干细胞的研究奠定了基础.
人胃癌细胞株MKN-28(上海第二军医大学长海医院消化科实验室馈赠), 低糖DMEM培养液(Gibco), 胎牛血清、胰蛋白酶(武汉博士德公司), Hochest33342、PI、维拉帕米(Sigma), ABCG2-BXP21鼠抗人mAb, FITC标记山羊抗小鼠(Chemicon吉泰生物公司北京分公司).
人胃癌细胞株MKN-28, 用含100 mL/L胎牛血清、100 kU/L青霉素和100 kU/L链霉素的低糖DMEM培养液, 在37 ℃、饱和湿度、含50 mL/L CO2条件下培养. 2.5 g/L的胰蛋白酶消化、传代. 实验选用对数生长期细胞.
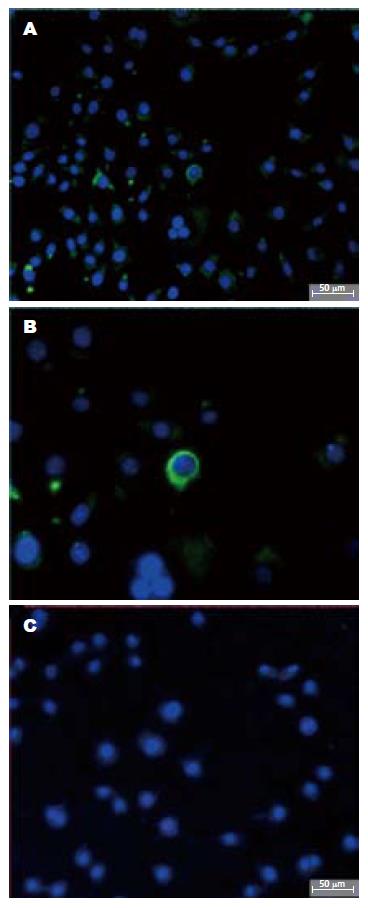
1.2.1 免疫荧光染色: 将MKN-28细胞悬液接种到放有载玻片的六孔板上铺片, 加入适量L-DMEM培养液, 放于37 ℃培养箱中静置培养过夜. 次日拿出细胞至室温, 吸弃培养液, PBS洗3次. 多聚甲醛溶液固定, 封闭, 加入ABCG2 mAb(1:50), 阴性对照组加入小鼠正常IgG(1:50), 4 ℃过夜. 加FITC标记的山羊抗鼠二抗(1:50), 37 ℃ 30 min, 用DAPI复染细胞核, 防淬灭封片剂封片. 将切片置于荧光显微镜下, 以488 nm为激发波长进行观察, CCD成像, 利用IMAGE-PRO软件进行图像分析. ABCG2染色阳性细胞为膜染色. 随机取5个100×视野, 分别计数100个细胞, 计算ABCG2染色阳性细胞百分比.
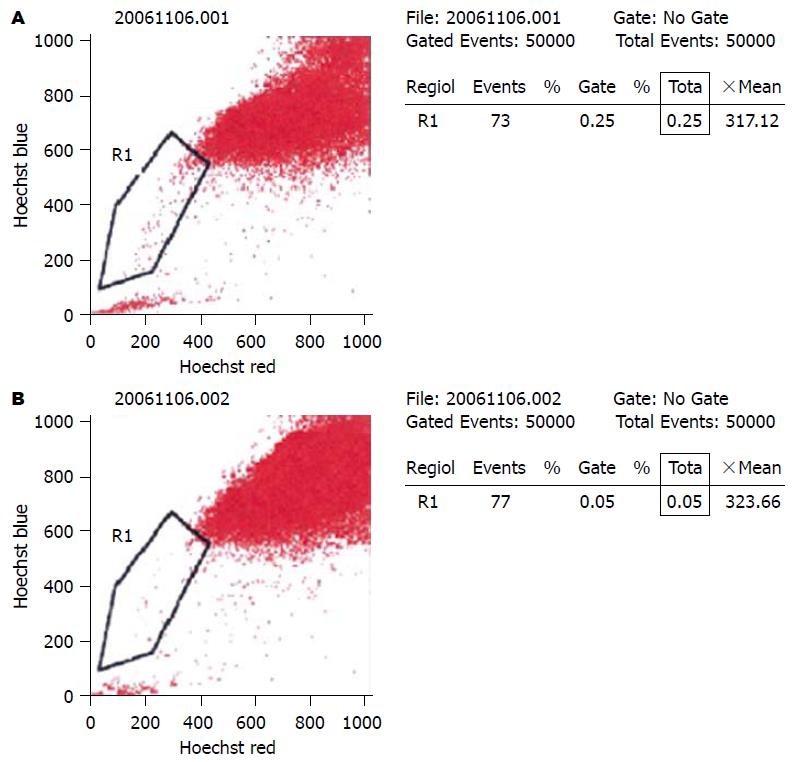
1.2.2 细胞染色和SP分析: 培养皿细胞换液, 将Hoechst33342加入培养液, 终浓度为5 mg/L. 同时一瓶培养液中加入50 µmol/L的维拉帕米(verapamil)作阴性对照. 37 ℃恒温箱90 min孵育后, 倒掉培养液, 加入2.5 g/L的胰蛋白酶1 mL消化, 制备成1×106单细胞悬液, 低温离心. 收集沉淀, PBS重悬, 用4 ℃ PI 2 µg共染, 标记死细胞. PBS(含20 mL/L胎牛血清)冲洗2次, 上流式分析.
实验证实ABCG2在胃癌MKN-28细胞系中有表达. 荧光显微镜下观察, 阴性对照组无特异性染色. 与阴性对照片比较, ABCG2表达阳性的绿光主要分布在细胞膜表面. 大部分细胞没有被染色, 只有少数细胞胞膜呈现绿色荧光, 说明染色特异. ABCG2阳性细胞与阴性细胞在形态学上无明显差异. 计数ABCG2阳性细胞, 约占1.7%(图1).
决定所分选的胃癌细胞株MKN-28中是否含有SP细胞, 看维拉帕米能否阻断Hoechest33342染色. 通过Hochest33342蓝光和红光双参数图, SP细胞亚群位于左下角两种荧光均阴性或很弱的区域, 胃癌细胞株MKN-28中SP细胞比例约为0.25%, 经维拉帕米阻断后SP细胞比例减少至0.05%. 加入维拉帕米后SP细胞亚群数量明显减少, 证实胃癌细胞株MKN-28中确实存在SP细胞(图2).
荧光染料Hoechest33342是一种脂溶性DNA结合染料, 可以穿过细胞膜而与DNA结合. 其激发光为350 nm, 在424-444 nm之间可以检测到发射光值, 一直以来在细胞周期研究方面得到广泛的应用. 某些癌细胞和干细胞可以将Hoechest33342排出细胞, 表现为细胞核不着色或者很低程度的着色, 利用流式细胞仪可以将这些不着色细胞加以分离, 人们将这种可以排出Hoechest33342的特性称为SP表型, 将利用该特性分离的这部分细胞称为SP细胞[9]. SP细胞能向不同类型和不同胚层的组织细胞分化, 很可能代表了一群更原始的干细胞, 且与干细胞的可塑性相关. 在骨髓、骨骼肌及神经组织均发现了SP细胞[10].
ABC转运蛋白ABCG2基因在不同来源SP细胞均呈高表达, 且该基因表达与SP细胞表型密切相关. ABCG2在造血及神经等组织来源的SP干细胞中的特异表达, 使得该转运蛋白成为从不同组织中分选多潜能干细胞的一种新的表型标记[11].
在肿瘤细胞系中, 肿瘤细胞并不是均一的, 是由不同状态的细胞群体组成, 只有少量细胞具有肿瘤起始的功能, 肿瘤细胞系中的SP细胞亚群具有肿瘤干细胞样的特性. Setoguchi et al[12]发现很多肿瘤细胞系中都存在一小群SP细胞, SP细胞富含肿瘤干细胞. Kondo et al[3]证实大鼠胶质瘤细胞系C6中分离的SP细胞亚群在体内可分化为神经元细胞和胶质细胞, 提示C6中SP细胞是典型的干细胞样细胞, 也就是肿瘤干细胞. Chiba et al[6]在肝癌细胞系Huh7和PLC/PRE/5中分选出SP细胞, 分别占了0.80%和0.25%, 并证实SP细胞具有肿瘤干细胞样的特性.
现有文献所报道的肿瘤细胞系中, 分选SP细胞的方法均利用了细胞对核DNA荧光染料Hoechest33342的排斥特性, 分选出的肿瘤SP细胞具有干细胞的某些特性, ABCG2的表达与SP表型呈强相关[9,13-14]. 本研究首先探讨了ABCG2在胃癌MKN-28中的表达, 发现ABCG2在胃癌MKN-28细胞系中有一定程度的表达. 荧光显微镜下观察, ABCG2表达阳性的绿光主要分布在细胞膜表面, 这与Diestra et al[15]所描述的一致. 大部分细胞没有被染色, 只有少数细胞胞膜呈现绿色荧光. ABCG2阳性细胞与阴性细胞在形态学上无明显差异, ABCG2阳性细胞约占1.7%. 这样就提示胃癌MKN-28细胞系中可能含有SP细胞亚群.
ABCG2高表达的细胞可高效外排DNA荧光染料Hoechst33342, 从而能通过流式分选分析系统分选出SP细胞, 这种方法是目前利用最多的肿瘤干细胞分选方法. 相对于其他方法, 如球形培养、特异性分子标记等, SP分离结果更为简便、确实, 是肿瘤干细胞研究中很有应用价值的一种方法. SP分离的最优化条件是用355 nm左右的紫外光激发, 但是紫外光需要特殊的氪气或氩气激光光源, 因功率高, 需水冷却系统及相应的滤片, 这些设备昂贵、庞大, 一般的流式细胞仪都不配备, 而且样本染色的过程和仪器的操作都会影响SP的分离结果, 这也正是这一方法在我国没有推广开展的原因.
本研究分选胃癌细胞株MKN-28中SP细胞比例约为0.25%, 低于Haraguchi et al[5]的0.8%, 这可能与细胞样本染色过程以及仪器的操作误差有关. ABCG2能够被钙离子拮抗剂维拉帕米非特异性阻断, 抑制染料外排, 减少SP细胞. 本实验分析胃癌细胞株MKN-28的SP亚群, 加入维拉帕米后SP细胞降至0.05%, 数量明显减少, 证实胃癌细胞株MKN-28中确实存在SP细胞, 这也提示胃癌干细胞的存在.
总之, 国内外尚无胃癌干细胞分离、鉴定成功的报道. 本实验所分选出的胃癌SP细胞数量稀少, 并且不知道胃癌SP细胞的培养条件, 所以难于培养、鉴定, 这也是我们下一步研究的重点和难点.
肿瘤干细胞已成为肿瘤研究的热点之一, 其首要问题就是肿瘤干细胞的分离和鉴定. SP分离是研究肿瘤干细胞的重要方法.
利用流式细胞仪分选SP细胞, 是近年来国际上研究肿瘤干细胞的热点之一. 这种方法具有普遍适用性, 是肿瘤干细胞研究中很有应用价值的一种方法.
2006年Haraguchietal在《干细》杂志上首次发表关于胃肠道肿瘤细胞系SP细分选的文章, 证实胃肠道肿瘤细胞系中包含SP细胞, 并且证明肝癌细胞株SP细胞具有干细胞特性, 同时发现胃癌MKN1, MKN7, MKN28等细胞系中存在SP细胞.
国内外尚无关于胃癌干细胞分离、鉴定成功的报道. 本文利用流式细胞仪对胃癌SP细胞的分选进行了初步尝试, 并成功分析了胃癌细胞系MKN-28的SP亚群, 为我国胃癌干细胞的研究奠定了基础.
SP细胞: 某些癌细胞和干细胞可以将荧光染料Hoechest33342排出细胞, 表现为细胞核不着色或者很低程度的着色, 利用流式细胞仪可以将这些不着色细胞加以分离, 人们将这种可以排出Hoechest33342的特性称为SP表型, 将利用该特性分离的这部分细胞称为SP细胞.
本研究探讨ABCG2在胃癌细胞系MKN-28中的表达, 对胃癌SP细胞的分选进行了初步尝试, 实验设计合理, 有较高的理论价值.
编辑: 张焕兰 电编:张敏
| 1. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 2. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 3. | Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc Natl Acad Sci U S A. 2004;101:781-786. [PubMed] [DOI] |
| 4. | Patrawala L, Calhoun T, Schneider-Broussard R, Zhou J, Claypool K, Tang DG. Side population is enriched in tumorigenic, stem-like cancer cells, whereas ABCG2+ and ABCG2- cancer cells are similarly tumorigenic. Cancer Res. 2005;65:6207-6219. [PubMed] [DOI] |
| 5. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 6. | Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology. 2006;44:240-251. [PubMed] [DOI] |
| 7. | Seigel GM, Campbell LM, Narayan M, Gonzalez-Fernandez F. Cancer stem cell characteristics in retinoblastoma. Mol Vis. 2005;11:729-737. [PubMed] |
| 8. | Hirschmann-Jax C, Foster AE, Wulf GG, Nuchtern JG, Jax TW, Gobel U, Goodell MA, Brenner MK. A distinct "side population" of cells with high drug efflux capacity in human tumor cells. Proc Natl Acad Sci U S A. 2004;101:14228-14233. [PubMed] [DOI] |
| 9. | Zhou S, Morris JJ, Barnes Y, Lan L, Schuetz JD, Sorrentino BP. Bcrp1 gene expression is required for normal numbers of side population stem cells in mice, and confers relative protection to mitoxantrone in hematopoietic cells in vivo. Proc Natl Acad Sci U S A. 2002;99:12339-12344. [PubMed] [DOI] |
| 10. | Gussoni E, Soneoka Y, Strickland CD, Buzney EA, Khan MK, Flint AF, Kunkel LM, Mulligan RC. Dystrophin expression in the mdx mouse restored by stem cell transplantation. Nature. 1999;401:390-394. [PubMed] [DOI] |
| 11. | Bunting KD. ABC transporters as phenotypic markers and functional regulators of stem cells. Stem Cells. 2002;20:11-20. [PubMed] [DOI] |
| 12. | Setoguchi T, Taga T, Kondo T. Cancer stem cells persist in many cancer cell lines. Cell Cycle. 2004;3:414-415. [PubMed] [DOI] |
| 13. | Scharenberg CW, Harkey MA, Torok-Storb B. The ABCG2 transporter is an efficient Hoechst 33342 efflux pump and is preferentially expressed by immature human hematopoietic progenitors. Blood. 2002;99:507-512. [PubMed] [DOI] |
| 14. | Kim M, Turnquist H, Jackson J, Sgagias M, Yan Y, Gong M, Dean M, Sharp JG, Cowan K. The multidrug resistance transporter ABCG2 (breast cancer resistance protein 1) effluxes Hoechst 33342 and is overexpressed in hematopoietic stem cells. Clin Cancer Res. 2002;8:22-28. [PubMed] |
| 15. | Diestra JE, Scheffer GL, Català I, Maliepaard M, Schellens JH, Scheper RJ, Germà-Lluch JR, Izquierdo MA. Frequent expression of the multi-drug resistance-associated protein BCRP/MXR/ABCP/ABCG2 in human tumours detected by the BXP-21 monoclonal antibody in paraffin-embedded material. J Pathol. 2002;198:213-219. [PubMed] [DOI] |