修回日期: 2006-12-21
接受日期: 2006-12-28
在线出版日期: 2007-03-18
目的: 研究小檗碱对胰岛素抵抗大鼠肝脏葡萄糖激酶(GK)活性及肝脏GK与葡萄糖激酶调节蛋白(GKRP)表达的影响.
方法: 选用♂Wistar大鼠, 以高脂高热量饲料喂养8 wk, 复制胰岛素抵抗大鼠模型, 成模后随机分成模型组、小檗碱组、二甲双胍组, 各药干预4 wk后, 比较各组大鼠胰岛素敏感性、肝糖原、肝脏GK活性、肝脏GK与GKRP蛋白(Western blot法)表达的差异.
结果: 比模型组比较, 小檗碱组胰岛素敏感性提高(-4.93±0.30 vs -5.35±0.40, P<0.05), 肝糖原含量明显升高(136.58±52.57 µg/g vs 65.88±27.80 µg/g, P<0.05), 肝脏GK活性升高(226.55±10.62 µkat/g vs 92.69±6.43 µkat/g, P<0.05), 肝脏GK蛋白表达增强(1.71±0.49 vs 1.24±0.22, P<0.05), 而GKRP表达减弱(1.19±0.20 vs 1.94±0.56, P<0.01); 与二甲双胍组比较, 小檗碱组肝糖原含量高(136.584±52.574 µg/g vs 89.427±31.971 µg/g, P<0.05), 余指标无显著性差异 (P>0.05).
结论: 小檗碱改善胰岛素抵抗的作用机制可能与提高肝脏GK活性有关.
引文著录: 欧阳礼枝, 陆付耳, 刘文军, 高志强, 徐丽君. 小檗碱对胰岛素抵抗大鼠肝脏葡萄糖激酶及其调节蛋白的影响. 世界华人消化杂志 2007; 15(8): 885-889
Revised: December 21, 2006
Accepted: December 28, 2006
Published online: March 18, 2007
AIM: To investigate the effects of berberine on hepatic glucokinase (GK) activity, protein expression and GK's regulatory protein (GKRP) in insulin-resistant rats.
METHODS: Male Wistar rats were fed with high-fat diet for 8 wk to induce the model of insulin resistance. Then the insulin-resistant rats were randomly divided into 3 groups: model, berberine, and metformin groups which were treated with the corresponding preparations. Meanwhile, a normal control group was designed. The differences in insulin sensitivity, hepatic glycogen, hepatic GK activity, and protein expression (using Western blot) of hepatic GK and GKRP were compared among the groups.
RESULTS: As compared with those in model group, the insulin sensitivity (-4.93 ± 0.30 vs -5.35 ± 0.40, P < 0.05), hepatic glycogen level (136.58 ± 52.57 µg/g vs 65.88 ± 27.80 µg/g, P < 0.05), GK activity (226.55 ± 10.62 µkat/g vs 92.69 ± 6.43 µkat/g, P < 0.05), and hepatic GK protein expression (1.71±0.49 vs 1.24±0.22, P < 0.05) were significantly elevated in berberine group, while the expression of GKRP protein weaker (1.19 ± 0.20 vs 1.94 ± 0.56, P < 0.01). Meanwhile, the hepatic glycogen level in berberine group was markedly higher than that in metformin group (136.584 ± 52.574 µg/g vs 89.427 ± 31.971 µg/g, P < 0.05), but the other indexes were not significantly different between them (all P > 0.05).
CONCLUSION: Berberine may decrease insulin resistance by increasing of the hepatic GK activity.
- Citation: Ouyang LZ, Lu FE, Liu WJ, Gao ZQ, Xu LJ. Effect of berberine on hepatic glucokinase and its regulatory protein in insulin-resistant rats. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 885-889
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/885.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.885
小檗碱又名黄连素, 长期以来在临床上用来治疗消化性溃疡及腹泻[1-4], 近年来, 国内外均有文献报道小檗碱可增加胰岛素抵抗大鼠模型胰岛素敏感性, 并有明显降血糖作用[5-7], 其具体作用机制尚未完全研究清楚. 我们用小檗碱干预胰岛素抵抗大鼠, 观察其对肝脏葡萄糖激酶(glucokinase, GK)活性、GK及葡萄糖激酶调节蛋白(glucokinase regulatory protein, GKRP)蛋白表达的影响, 探讨小檗碱改善胰岛素抵抗的分子机制.
♂清洁级Wistar大鼠60只, 约2月龄, 体质量170-200 g, 购自湖北省实验动物研究中心. 盐酸小檗碱片由黑龙1/2百泰药业有限公司生产, 用含5 g/L羧甲基纤维素的PBS溶液(pH7.4)配成浓度为28.125 g/L的混悬液. 盐酸二甲双胍片由上海施贵宝药业生产, 同法配成浓度为36.7 g/L的混悬液. 血糖试剂盒为北京北化康泰试剂有限公司产品. 胰岛素放免盒为北京原子能生物研究所产品. GK山羊抗大鼠多克隆IgG, GKRP兔抗大鼠IgG及β-actin抗体为Santa Cruz公司产品, 辣根酶标记的二抗为北京中杉公司产品.
1.2.1 胰岛素抵抗大鼠模型的复制及药物干预: 大鼠喂养于动物饲养室(室温22 ℃, 明暗交替周期为12 h, 通风良好), 除做糖耐量试验(GTT)及处死前12 h禁食外, 自由进食、饮水. 动物适应性喂养2 wk后, 随机取50只喂养高脂饲料, 为造模组; 其余10只大鼠不做任何处理, 进食普通饲料, 为正常对照组(NOR组). 高脂饲料依文献资料[8,9]稍作修改后自行配制, 其中热量构成比为脂肪: 蛋白质: 碳水化合物 = 59:21:20. 喂养8 wk后, 检测各大鼠空腹血糖(FBG)和空腹胰岛素(FIns), 采用李光伟et al[10]提出的方法计算各大鼠胰岛素敏感性指数(ISI, ISI = FIns与FBG乘积倒数的自然对数), 其中ISI较NOR组降低者(小于NOR组ISI均值减1.96倍标准差)视为胰岛素抵抗大鼠模型造模成功[11], 共38只, 然后随机分成模型组(MOD组)13只, 按7 mL/(kg·d)体质量灌服5 g/L羧甲基纤维素PBS溶液; 小檗碱组(BER组)13只, 按187.5 mg/(kg·d)灌服上述小檗碱混悬液; 二甲双胍组(MET组)12只, 按184 mg/(kg.d)灌服上述二甲双胍组混悬液. 大鼠干预4 wk后, 按45 mg/kg体质量剂量腹腔注射30 g/L戊巴比妥钠进行麻醉, 腹主动脉取血, 分离血清, 用于检测各项生化指标, 另取肝脏迅速冻存于液氮中, 24 h后置于-80 ℃冰箱保存以待测其他指标.
1.2.2 血糖、胰岛素检测: 血糖用葡萄糖氧化酶法测定, 胰岛素用放免法测定, 具体操作步骤严格按试剂盒说明书进行.
1.2.3 胰岛素敏感性: 末次大鼠给药后禁食12 h, 取空腹尾静脉血, 按剂量2.2 g/kg体质量予400 g/L葡萄糖水灌胃, 剪尾法取灌糖后0.5、1、2、3 h尾静脉血, 检测各时间段血糖值及胰岛素水平. 参照文献[12]方法计算出各组糖耐量曲线下面积 (SBG)及胰岛素释放曲线下面积(SIns). 胰岛素敏感性用ISI, SBG, SIns评估.
1.2.4 肝糖原含量及肝脏GK活性检测: 肝糖原含量检测采用蒽酮法[13]稍做修改, 以梯度浓度的葡萄糖标准液分别加入蒽酮试剂制作7个标准管, 测得A值, 绘制标准曲线, 依曲线回归方程折算出各样本的糖原含量. GK活性检测参照Davidson法[14]稍做修改补充, 另用考马斯亮兰法测量肝脏匀浆上清液的蛋白浓度, 以(△A/min高糖管-△A/min低糖管)/蛋白浓度间接反映肝脏GK活性, GK活性(mkat/g)= (△A/min高糖管-△A/min低糖管)×106/6220×16.67×V总/V反/蛋白浓度, V总表示总反应体积, V反表示参与反应的匀浆上清液体积, 6220表示NADPH的吸光系数.
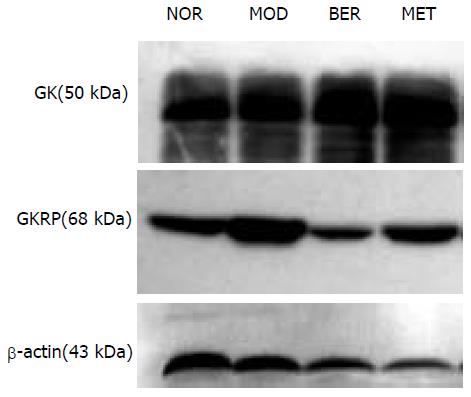
1.2.5 肝脏GK与GKRP表达水平的检测: 采用Western blot方法. 取肝脏100 mg, 三去污裂解液匀浆后, 取上清, 考马斯亮兰法测其蛋白浓度. 取各样本总蛋白100 mg, 以100 g/L分离胶, 50 g/L积层胶, SDS-PAGE胶分离蛋白, 湿电转移法将蛋白质转到PVDF膜上. GK蛋白以含50 g/L脱脂奶粉和10 g/L BSA的TBST溶液(含1 mL/L Tween 20)室温轻摇封闭3 h后, 以1:2000稀释度加入抗GK抗体, 4 ℃孵育10 h, GKRP蛋白以含50 g/L BSA的TBST溶液于4 ℃封闭8 h, 以1:2000稀释度加入抗GKRP抗体, 4 ℃孵育10 h, 均洗膜后加入HRP标记的二抗, 室温轻摇2 h, 洗涤后用增强化学发光法(ECL)显像曝光, 洗片后用激光扫描仪测各条带光密度.
统计学处理 数据均以mean±SD表示, 两组间均数比较采用组间t检验, 多组间均数比较用方差分析, 肝糖原用直线回归.
MOD组ISI明显较NOR组低, BER组ISI较MOD组提高, MOD组SBG较NOR增加, BER组SBG较MOD组减小, MOD组SIns明显较NOR组大, BER组及MET组SIns较MOD组有所减小, 但无统计学差异(表1).
| 分组 | n | ISI | SBG[mmol/(L·h)] | SIns[mU/(L·h)] | 肝糖原(μg/g) | GK活性(μkat/g) |
| NOR | 10 | -4.42±0.39 | 13.50±1.05 | 41.91±12.86 | 53.70±22.31 | 324.73±12.76 |
| MOD | 12 | -5.35±0.40b | 15.05±1.65a | 66.06±15.09b | 65.88±27.80 | 92.69±6.43a |
| BER | 12 | -4.93±0.30c | 13.15±1.61c | 59.73±16.04 | 136.58±52.57ac | 226.55±10.62c |
| MET | 11 | -4.99±0.49c | 13.55±2.13 | 65.84±24.09 | 89.43±31.97ae | 215.71±11.56c |
BER组肝糖原水平较MOD组提高(P<0.05), 且较MET组高(P<0.05); MOD组GK活性较NOR组下降(P<0.05), BER组肝脏GK活性较MOD组增强(P<0.05), 与MET组比较, 无显著性差异(P>0.05) (表1).
胰岛素抵抗是指机体组织或靶细胞对胰岛素的作用缺乏正常反应, 即其敏感性和(或)反应性降低的一种病理生理状态. IR可导致一系列代谢紊乱, 如导致葡萄糖摄取和利用的能力下降、脂质紊乱、纤溶系统功能紊乱等, 因此IR在高血压、冠心病及脂肪肝等多种危险因素中居关键地位[15-17]. 本实验予高脂饲料喂养大鼠8 wk后, 大鼠的胰岛素敏感性下降并呈糖耐量减低状态, 这与临床上膳食结构不科学的肥胖患者呈现胰岛素抵抗有一定的模型相似性[18].
小檗碱是从黄连根茎中提取出的一种苯并异à林类季铵型碱, 最早作为抗菌药用于临床. 本课题组前期研究表明, 小檗碱能降血糖, 调血脂, 促进胰岛素分泌[19], 高从容et al[20]亦认为小檗碱能提高胰岛素抵抗大鼠的胰岛素敏感性.
GK是一种已糖激酶, 催化葡萄糖转变为6-磷酸葡萄糖. 肝细胞中, GK控制肝细胞对葡萄糖的摄取与利用, 其活性受GKRP的调节, 有"葡萄糖感受器"之称[21]. GK活性增强, 促进肝脏葡萄糖磷酸化, 使肝糖原合成能力增加[22]. Coope et al[23]认为: 肝脏GK活性降低可能参与胰岛素抵抗机制. 本实验中胰岛素抵抗大鼠3/4小檗碱干预4 wk后糖原合成增加, 肝脏GK活性增强, 推测小檗碱通过增强GK活性而促进肝糖原合成, 这支持了我们提出的的小檗碱为GK激活剂的假说. 小檗碱组的糖原含量甚至高于正常组, 其可能机制在于进食高糖高脂饲料的大鼠有高糖的刺激, 糖原合成的底物增多. 为研究小檗碱降糖、改善胰岛素抵抗作用途径, 我们用胰岛素抵抗模型即在血糖水平稳定的情况下研究胰岛素释放, 小檗碱组胰岛素敏感指数提高, 糖耐量下曲线面积减小, 而胰岛素释放曲线下面积并不明显减小, 结合前期研究可提示小檗碱具有改善胰岛素抵抗与促进胰岛素分泌的双重作用. 肝糖原检测显示小檗碱组与二甲双胍组肝糖原的合成增加, 这提示小檗碱是通过促进葡萄糖代谢途径降低血糖. 本研究从增强GK活性角度, 揭示了小檗碱提高胰岛素敏感性的可能机制.
Veiga-da-Cunha et al[24]认为, GKRP能调节GK的活性, 且与GK在正常血糖时结合于核内, 抑制GK的活性. Slosberg et al[25]研究揭示GKRP的过度表达可能参与2型糖尿病的发病机制. 本研究中Western印迹结果显示小檗碱组GKRP蛋白表达较模型明显减弱, 从而减少对GK活性的抑制, 揭示了小檗碱提高GK活性, 改善胰岛素抵抗的可能机制. 本研究为小檗碱在临床上用于预防胰岛素抵抗向2型糖尿病发展提供了理论依据, 开拓了其临床用药前景. 但小檗碱通过何种机制抑制GKRP的蛋白表达, 尚有待进一步研究.
胰岛素抵抗是糖尿病及心血管等多种疾病共同的危险因素, 是滋生多种代谢相关疾病的"共同土壤". 注重改善胰岛素抵抗, 在多种疾病治疗中均能受益.
葡萄糖激酶及葡萄糖激酶调节蛋白与糖尿病及胰岛素抵抗的关系近年来多有国外学者在进行研究. 葡萄糖激酶激活剂在一定程度上改善了胰岛素抵抗, 但其分子机制尚待深入研究.
临床上习惯用小檗碱治疗腹泻, 但其多方面的药理作用已受越来越多学者重视. 本课题首次从提高葡萄糖激酶活性角度探索了其改善胰岛素敏感性及治疗糖尿病的作用机制, 开创了老药新用的临床用药新思维.
本研究观察了小檗碱对胰岛素抵抗的改善作用及其作用机制. 文章科学性较强, 实验设计合理, 检测指标较先进, 对小檗碱防治胰岛素抵抗领域研究较深入.
编辑: 张焕兰 电编:李琪
| 4. | Pan LR, Tang Q, Fu Q, Hu BR, Xiang JZ, Qian JQ. Roles of nitric oxide in protective effect of berberine in ethanol-induced gastric ulcer mice. Acta Pharmacol Sin. 2005;26:1334-1338. [PubMed] [DOI] |
| 5. | Lee YS, Kim WS, Kim KH, Yoon MJ, Cho HJ, Shen Y, Ye JM, Lee CH, Oh WK, Kim CT. Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states. Diabetes. 2006;55:2256-2264. [PubMed] [DOI] |
| 7. | Tang LQ, Wei W, Chen LM, Liu S. Effects of berberine on diabetes induced by alloxan and a high-fat/high-cholesterol diet in rats. J Ethnopharmacol. 2006;108:109-115. [PubMed] [DOI] |
| 8. | Storlien LH, James DE, Burleigh KM, Chisholm DJ, Kraegen EW. Fat feeding causes widespread in vivo insulin resistance, decreased energy expenditure, and obesity in rats. Am J Physiol. 1986;251:E576-E583. [PubMed] |
| 9. | Petrik J, Srinivasan M, Aalinkeel R, Coukell S, Arany E, Patel MS, Hill DJ. A long-term high-carbohydrate diet causes an altered ontogeny of pancreatic islets of Langerhans in the neonatal rat. Pediatr Res. 2001;49:84-92. [PubMed] [DOI] |
| 11. | 陈 世伟, 张 立宪, 张 红敏, 冯 晓凡, 彭 晓莉. 大豆异黄酮对胰岛素抵抗大鼠胰岛素敏感性及瘦素基因表达的影响. 北京大学学报 (医学版). 2006;38:197-200. |
| 14. | Davidson AL, Arion WJ. Factors underlying significant underestimations of glucokinase activity in crude liver extracts: physiological implications of higher cellular activity. Arch Biochem Biophys. 1987;253:156-167. [PubMed] [DOI] |
| 15. | Méndez-Sánchez N, Chavez-Tapia NC, Motola-Kuba D, Sanchez-Lara K, Ponciano-Rodríguez G, Baptista H, Ramos MH, Uribe M. Metabolic syndrome as a risk factor for gallstone disease. World J Gastroenterol. 2005;11:1653-1657. [PubMed] [DOI] |
| 18. | Méndez-Sánchez N, Bermejo-Martínez LB, Viñals Y, Chavez-Tapia NC, Vander Graff I, Ponciano-Rodríguez G, Ramos MH, Uribe M. Serum leptin levels and insulin resistance are associated with gallstone disease in overweight subjects. World J Gastroenterol. 2005;11:6182-6187. [PubMed] [DOI] |
| 19. | Leng SH, Lu FE, Xu LJ. Therapeutic effects of berberine in impaired glucose tolerance rats and its influence on insulin secretion. Acta Pharmacol Sin. 2004;25:496-502. [PubMed] |
| 21. | de la Iglesia N, Mukhtar M, Seoane J, Guinovart JJ, Agius L. The role of the regulatory protein of glucokinase in the glucose sensory mechanism of the hepatocyte. J Biol Chem. 2000;275:10597-10603. [PubMed] [DOI] |
| 23. | Coope GJ, Atkinson AM, Allott C, McKerrecher D, Johnstone C, Pike KG, Holme PC, Vertigan H, Gill D, Coghlan MP. Predictive blood glucose lowering efficacy by Glucokinase activators in high fat fed female Zucker rats. Br J Pharmacol. 2006;149:328-335. [PubMed] [DOI] |
| 24. | Veiga-da-Cunha M, Van Schaftingen E. Identification of fructose 6-phosphate- and fructose 1-phosphate-binding residues in the regulatory protein of glucokinase. J Biol Chem. 2002;277:8466-8473. [PubMed] [DOI] |