修回日期: 2007-01-18
接受日期: 2007-01-25
在线出版日期: 2007-03-18
目的: 探讨感染后肠易激综合征(PI-IBS)与溃疡性结肠炎(UC)缓解期患者结肠黏膜细胞因子表达的相关性.
方法: PI-IBS组26例, UC组45例及对照组30例, 结肠镜下活检降结肠和直肠黏膜标本, 采用免疫组化SABC法检测其肠黏膜P物质(SP)与IL-2, IFN-γ的表达情况.
结果: PI-IBS组降结肠和直肠黏膜IFN-γ和IL-2阳性率表达、SP强度均值和面积高于对照组(IFN-γ: χ2 = 13.781, 14.012, P<0.01; IL-2: χ2 = 13.890, 13.931, P<0.01; SP强度: t = 3.623, 3.722, P<0.01; SP面积: t = 3.454, 3.561, P< 0.01), 但与UC组患者无显著差异. 降结肠、直肠黏膜IFN-γ, IL-2阳性表达的PI-IBS患者, SP强度均值(t = 2.202, 2.220, P<0.05)、面积高于对照组(t = 2.301, 2.252, P<0.05), 与UC组患者也无显著差异.
结论: PI-IBS和UC缓解期患者细胞因子表达无显著差异. 从神经-免疫机制上分析认为IBS与炎症性肠病(IBD)之间存在某种相关性, IBS可能是轻微的IBD.
引文著录: 鞠辉, 刘希双, 王光兰, 尹晓燕, 刘华, 戴素美. 感染后肠易激综合征与溃疡性结肠炎缓解期患者肠黏膜细胞因子表达的相关性. 世界华人消化杂志 2007; 15(8): 844-848
Revised: January 18, 2007
Accepted: January 25, 2007
Published online: March 18, 2007
AIM: To investigate whether the mucosal cytokines is differently expressed between post-infective irritable bowel syndrome (PI-IBS) and ulcerative colitis (UC) in remission.
METHODS: SABC immunohistochemistry was used to detect the mucosal expression of substance P (SP), interleukin-2 (IL-2), and interferon-γ (IFN-γ) in 26 PI-IBS patients, 45 UC patients, and 30 controls.
RESULTS: The positive rates of mucosal IFN-γ, IL-2 and SP were significantly higher in the descending colon and rectum of PI-IBS patients than those in the controls (IFN-γ: χ2 = 13.781, 14.012, P < 0.01; IL-2: χ2 = 13.890, 13.931, P < 0.01; SP intensity: t = 3.623, 3.722, P < 0.01; SP area: t = 3.454, 3.561, P < 0.01), but not markedly different from those in UC patients. The SP intensity and area were also significantly higher in the IFN-γ- and IL-2-positive descending colon and rectum of PI-IBS patients than those in the controls (intensity: t = 2.202, 2.220, P < 0.05; area: t = 2.301, 2.252, P < 0.05), but not notably different from those in UC patients.
CONCLUSION: The cytokine expression has no marked difference between PI-IBS and UC. There may be some correlation between PI-IBS and inflammatory bowel disease (IBD), and IBS is probably a low-grade IBD according to neuroimmune mechanism.
- Citation: Ju H, Liu XS, Wang GL, Yin XY, Liu H, Dai SM. Correlation between post-infective irritable bowel syndrome and cytokine expression in intestinal mucosa of patients with ulcerative colitis in remission. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 844-848
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/844.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.844
临床研究发现约1/3肠易激综合征(irritable bowel syndrome, IBS)患者在其患病前曾有急性胃肠道感染史; 部分被肠道病毒、细菌或寄生虫感染的患者, 在病原体已清除及黏膜炎症消退后, 可发生IBS样的症状, 称之为感染后肠易激综合征(post-infective irritable bowel syndrome, PI-IBS)[1-2]. 炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克隆病(CD), 其缓解期与IBS之间存在许多相似的临床表现, 研究表明IBS与IBD之间可能存在某种联系. UC缓解期常表现为肠易激样综合征(Irritable bowel like syndrome, IBLS), 其特点是在UC缓解期内, 具有类似IBS的腹痛、腹泻症状而缺乏胃肠道结构或生化异常, 单独给予5-氨基水杨酸治疗效果欠佳[3]. 在初始诊断为IBS患者随访中发现, 患IBD的危险度显著升高, 相对危险度为16.3, 提示IBS与IBD之间的确存在某种相关性[4]. IBD的发生机制之一是免疫介导对黏膜损伤造成的, 近年来, 神经免疫机制成为IBS发生机制中研究热点之一. 我们研究了PI-IBS与UC缓解期患者(以下简称UC患者)结肠黏膜P物质(SP)、IL-2与IFN-γ的表达, 从神经免疫机制分析二者之间的关系.
2004-09/2005-07青岛大学医学院附属医院内科门诊PI-IBS患者 26例, 男9例, 女17例, 平均年龄39.9±10.6岁; PI-IBS纳入标准: (1)罗马Ⅱ诊断标准; (2)出现IBS症状前至少1 d有胃肠道急性感染病史, 且治疗未超过5 d而治愈, 没有复发者. 排除标准: (1)有肠道器质性疾病及手术史者; (2)有全身其他系统器质性疾病者; (3)孕妇和哺乳期妇女. UC患者45例, 男25例, 女20例, 平均年龄40.7±13.5岁. UC缓解期纳入标准: 既往经肠镜诊断为UC; 具有类似IBS的腹痛、腹泻症状而缺乏胃肠道结构或生化异常, 肠镜下观察肠黏膜未见明显充血、水肿、渗出等, 单独给予5-氨基水杨酸治疗效果欠佳. 设对照组30例, 男12例, 女18例, 平均年龄38.45±10.90岁. 纳入标准: 为结肠息肉电切除术后复查无异常发现者(术后至少半年)或因大便带少量鲜血行结肠镜检查诊断为痔疮者, 无其他消化道症状与体征, 无免疫疾病、感染病史, 无近期服药史. 兔抗人IL-2抗体、兔抗人IFN-γ抗体及SABC试剂盒均购自武汉博士德生物工程公司, 抗人P物质多克隆抗体(ZA-0235北京中杉金桥生物技术有限公司提供).
分别取降结肠、直肠黏膜各2块, 40 g/L甲醛固定, 石蜡包埋, 所有蜡块均行4 mm连续切片, 每例每部位各取一张切片HE染色, 进行常规病理组织学诊断. 切片常规脱蜡, 梯度乙醇水洗, 双氧水室温孵育10 min, 放入枸橼酸钾缓冲液(pH7)中5 min, 后进行微波修复10 min, PBS缓冲液冲洗15 min, 水洗去PBS, 滴加兔抗人P物质多克隆抗体(兔抗人IL-2抗体、兔抗人IFN-γ抗体), PBS缓冲液冲洗15 min, 滴加通用型IgG抗体(Fab段)-HRP多聚体, 37 ℃孵育20 min, PBS缓冲液冲洗5 min×3次, 水洗去PBS, 滴加新鲜配置的DAB显色剂. 采用双盲法判断结果, 每张切片选择有代表性的区域, 并避开切片周边区域. 对IFN-γ, IL-2染色的判断, 根据阳性细胞百分数和染色强度进行分级[5], 阳性细胞0%-5%, 计0分; 6%-25%, 计1分; 26%-50%, 计2分; 51%-75%, 计3分; >75%, 计4分. 同时根据胞质着色程度计分: 未染色0分; 淡黄色1分; 棕黄色2分; 棕褐色3分. 两组计分相加, 0-1分为阴性; 2-3分为弱阳性; 4-5分为阳性; 6-7分为强阳性. 对SP行定量分析用VIDAS图像分析系统, 检测其吸光度A值.
统计学处理 采用SPSS10.0统计软件包进行处理, 应用方差分析和t检验.
PI-IBS患者降结肠、直肠黏膜均经HE染色, 显微镜下观察见黏膜上皮完整, 黏膜下及固有腺之间可见少量淋巴细胞及浆细胞浸润, 个别可见少量中性粒细胞浸润, 与对照组相比, 差异无显著性. UC患者降结肠、直肠黏膜经HE染色, 显微镜下观察无中性粒细胞, 伴有少量慢性炎症细胞, 伴或不伴腺上皮与黏膜肌层间隙增大, 隐窝排列紊乱.
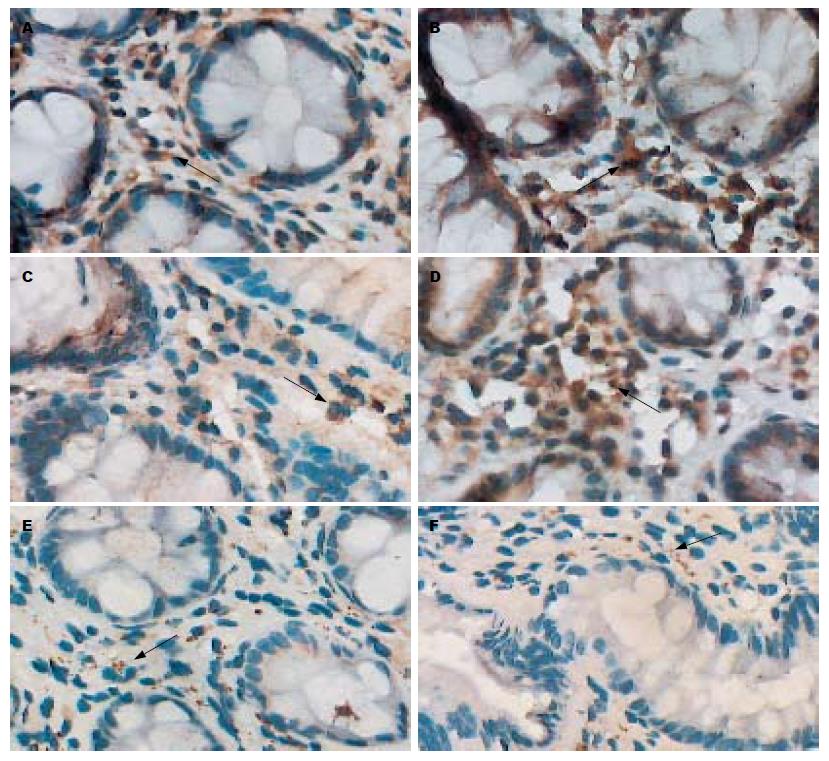
IFN-γ, IL-2的表达在降结肠、直肠黏膜固有膜, 呈现棕黄色, 分布于腺体周围(图1A-D). PI-IBS患者降结肠IFN-γ, IL-2阳性表达高于对照组(χ2 = 13.781, 13.890, P<0.01), 直肠IFN-γ, IL-2阳性表达高于对照组(χ2 = 14.012, 13.931, P<0.01); UC患者降结肠IFN-γ, IL-2阳性表达高于对照组(χ2=15.021, 14.992, P<0.01), 直肠IFN-γ, IL-2阳性表达高于对照组(χ2 = 14.389, 14.152, P<0.01); PI-IBS患者降结肠IFN-γ, IL-2阳性表达与UC患者比较, 差异无统计学意义(χ2 = 2.220, 2.302, P>0.05); 直肠IFN-γ, IL-2阳性表达与UC患者比较, 差异无统计学意义(χ2 = 2.290, 2.323, P>0.05)(表1).
SP分布于腺体周围的固有层中, 呈散在点状或簇状分布(图1E-F). PI-IBS患者降结肠、直肠黏膜SP强度均值高于对照组(t = 3.623, 3.722, P<0.01), 面积高于对照组(t = 3.454, 3.561, P<0.01); UC患者降结肠、直肠黏膜SP强度均值高于对照组 (t = 3.992, 3.892, P<0.01), 面积高于对照组(t = 4.214, 4.120, P<0.01); PI-IBS患者降结肠、直肠的SP强度均值与UC患者比较(t = 1.528, 1.643, P>0.05), 面积与UC患者比较(t = 1.732, 1.875, P>0.05), 差异无统计学意义(表1). 降结肠、直肠黏膜IFN-γ, IL-2阳性表达的PI-IBS患者, SP强度均值高于对照组(t = 2.202, 2.220, P<0.05), 面积高于对照组(t = 2.301, 2.252, P<0.05). 降结肠、直肠黏膜IFN-γ, IL-2阳性表达的UC患者, SP强度均值高于对照组(t = 2.425, 2.528, P<0.05), 面积高于对照组(t = 2.435, 2.503, P<0.05). 降结肠、直肠黏膜IFN-γ, IL-2阳性表达的PI-IBS患者SP强度均值与UC患者比较, 差异无统计学意义(t = 1.584,1.676, P>0.05); 面积与UC患者比较, 差异无统计学意义(t = 1.702, 1.785, P>0.05)(表2).
IBS的病因和发病机制迄今还不完全清楚. 神经免疫学说是新近提出的观点之一. IBD患者尤其是其缓解期患者与IBS患者, 有很多症状交错, 如腹痛和腹泻等. Bercik et al[6]提出IBS可能是轻微的IBD.
SP是一种主要的促炎症性感觉性神经肽, 腹泻型IBS患者血浆中SP水平升高, SP可能以循环激素的方式作用于乙状结肠平滑肌, 使运动增强而致腹泻; SP可以通过与非胆碱能的传递促进肠道的蠕动; 通过特异性受体活化内皮细胞钙离子依赖性NO合酶, 促进NO合成, 增加血管通透性; 刺激黏膜下分泌运动神经以增加黏膜离子的转运[7], 从而发生腹泻. SP表达的增加还可以通过刺激胆碱能神经和依赖NO的抑制性神经系统, 引起肠道压力的升高, 诱发痛觉过敏的发生. 肠道发生感染后, 炎症可致使SP表达增加[8]. 我们的实验表明, PI-IBS与IBLS患者肠黏膜SP表达高于对照组, 且PI-IBS组与UC组之间表达无明显差异. IBS患者尤其是腹泻型IBS肠黏膜SP含量升高, 可能与其结肠高动力, 黏液分泌增多而致腹泻有关[9]. 实验发现UC患者的ENS由胆碱能神经节变为SP神经节[10], 可能导致腹泻. PI-IBS与UC患者的肠黏膜结构变化有相似之处, 都存在SP阳性神经纤维的表达增加[11], 我们的结果与之相似.
IL-2与IFN-γ是主要的Th1细胞因子, 二者可以促进血管通透性增加, 促使组织胺、花生四烯酸代谢产物(PGD2, LTC4, LTD4, TXE4)、血小板活化因子(PAF)表达增多, 使平滑肌收缩增强, 肠道蠕动增加, 导致腹泻[12]. 肠道感染对肠黏膜屏障、传入神经及免疫功能的影响, 最终导致肠道分泌功能、运动功能及内脏感知的改变. 我们发现, PI-IBS患者降结肠、直肠黏膜的IL-2和IFN-γ表达均高于对照组增加, 与李延青et al[5]的研究结果相似. UC组肠黏膜IL-2, IFN-γ表达分别高于PI-IBS组, 不过差异无显著性. PI-IBS和UC患者肠黏膜存在的低度炎症可破坏肠黏膜上皮屏障功能, 增加其通透性, 引起水钠吸收障°而产生腹泻[13]; 同时也引起抗原的过度暴露以及刷状缘的缺失, 从而激活肠黏膜免疫系统, 引起包括肥大细胞、淋巴细胞、内分泌细胞在内的各种炎症及免疫细胞增加, 释放多种细胞因子[14]. 在IBD中Th1/Th2平衡受细胞因子的调节(IL-12, IFN-γ, IL-4及IL-10是参与调节的重要因子), 细胞因子失调可引起Th1/Th2失衡[15]; IBS患者肠黏膜存在Th1/Th2细胞因子的漂移[5]. 在细胞免疫方面, 二者也存在相似性, IBD肠黏膜病变部位的T细胞出现凋亡抵抗[16]; IBS患者存在T淋巴细胞功能减弱和调节紊乱[17].
PI-IBS和UC患者降结肠、直肠黏膜IFN-γ和IL-2阳性表达的SP的表达高于对照组, 差异有统计学意义. 我们推测PI-IBS和UC患者肠黏膜IFN-γ, IL-2的表达与SP表达有关, 这可能是黏膜免疫系统和传入神经末梢之间交互作用. 感染可能促使SP表达增加, SP与炎症细胞表面的SP受体结合, (主要是neurokinin-1, NK-1)结合, 促使Th1细胞释放IFN-γ, IL-2和IL-12等因子, 诱发Th1型反应, 破坏肠黏膜上皮屏障功能[18], 出现IBS样症状.
IBS和IBD都存在免疫系统的异常. IBS患者易产生少量的抗炎因子, 与IBD相似[19]. 在肠道感染3 mo后患感染后IBS的患者, 肠道黏膜淋巴细胞轻微的增加[20]. 在IBD缓解期内炎症反应减轻, 炎症细胞、固有层淋巴细胞表达少量增加, 而且改变的结肠运动模式得到改善, 表明结肠的功能障°依赖于炎症的程度. 研究认为IBLS主要与肠道免疫异常有关, 神经内分泌-免疫轴体系被激活, 从而导致IBLS的发生[21]. 在IBS中存在异常的免疫细胞活化及炎症介质的异常分泌[22-23]. 通过电镜及免疫组化的方法还发现在神经细胞及免疫活性细胞之间具有更多的膜-膜接触及活性介质异常分泌[24].
通过检测PI-IBS和UC缓解期患者降结肠、直肠黏膜SP、IFN-γ和IL-2的表达, 我们发现二者肠黏膜的细胞因子表达差异无统计学意义, 从神经免疫机制上分析认为IBS与IBD之间存在某种相关性, 支持IBS可能是轻微的IBD, 对今后IBS的治疗可能会产生一定的影响. 不过进行IBS与IBD的前瞻性研究, 会更有利于分析二者之间的相关关系.
研究表明, IBS与IBD之间可能存在某种联系, 本文研究了PI-IBS与UC缓解期患者结肠黏膜P物质、IL-2与IFN-γ的表达, 从神经-免疫机制分析二者之间的关系.
本文提出, 从神经-免疫机制上分析, IBS与IBD之间存在某种相关性, IBS可能是轻微的IBD.
该研究对今后IBS的治疗可能会产生一定的影响, 并且为今后从神经-免疫-内分泌网络机制分析二者的相关关系提供一定的实验基础.
肠易激样综合征(IBLS): 其特点是在UC缓解期内, 具有类似IBS的腹痛、腹泻症状而缺乏胃肠道结构或生化异常, 单独给予5-氨基水杨酸治疗效果欠佳.
本文通过检测PI-IBS和UC缓解期患者降结肠、直肠黏膜SP、IFN-γ和IL-2的表达, 发现二者肠黏膜的细胞因子表达差异无统计学意义, 从神经-免疫机制上分析认为IBS与IBD之间存在某种相关性, 支持IBS可能是轻微的IBD观点, 研究方法合理, 结论依据充分.
编辑: 张焕兰 电编:李琪
| 2. | Neal KR, Barker L, Spiller RC. Prognosis in post-infective irritable bowel syndrome: a six year follow up study. Gut. 2002;51:410-413. [PubMed] [DOI] |
| 3. | Isgar B, Harman M, Kaye MD, Whorwell PJ. Symptoms of irritable bowel syndrome in ulcerative colitis in remission. Gut. 1983;24:190-192. [PubMed] [DOI] |
| 4. | García Rodríguez LA, Ruigómez A, Wallander MA, Johansson S, Olbe L. Detection of colorectal tumor and inflammatory bowel disease during follow-up of patients with initial diagnosis of irritable bowel syndrome. Scand J Gastroenterol. 2000;35:306-311. [PubMed] [DOI] |
| 6. | Bercik P, Verdu EF, Collins SM. Is irritable bowel syndrome a low-grade inflammatory bowel disease? Gastroenterol Clin North Am. 2005;34:235-245, vi-vii. [PubMed] [DOI] |
| 8. | Koon HW, Zhao D, Zhan Y, Simeonidis S, Moyer MP, Pothoulakis C. Substance P-stimulated interleukin-8 expression in human colonic epithelial cells involves protein kinase Cdelta activation. J Pharmacol Exp Ther. 2005;314:1393-1400. [PubMed] [DOI] |
| 9. | Porcher C, Baldo M, Henry M, Orsoni P, Julé Y, Ward SM. Deficiency of interstitial cells of Cajal in the small intestine of patients with Crohn's disease. Am J Gastroenterol. 2002;97:118-125. [PubMed] [DOI] |
| 10. | Törnblom H, Lindberg G, Nyberg B, Veress B. Full-thickness biopsy of the jejunum reveals inflammation and enteric neuropathy in irritable bowel syndrome. Gastroenterology. 2002;123:1972-1979. [PubMed] [DOI] |
| 11. | Tough IR, Lewis CA, Fozard J, Cox HM. Dual and selective antagonism of neurokinin NK(1) and NK(2) receptor-mediated responses in human colon mucosa. Naunyn Schmiedebergs Arch Pharmacol. 2003;367:104-108. [PubMed] [DOI] |
| 12. | Qian BF, El-Salhy M, Melgar S, Hammarström ML, Danielsson A. Neuroendocrine changes in colon of mice with a disrupted IL-2 gene. Clin Exp Immunol. 2000;120:424-433. [PubMed] [DOI] |
| 13. | Collins SM, Piche T, Rampal P. The putative role of inflammation in the irritable bowel syndrome. Gut. 2001;49:743-745. [PubMed] [DOI] |
| 14. | Spiller RC, Jenkins D, Thornley JP, Hebden JM, Wright T, Skinner M, Neal KR. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000;47:804-811. [PubMed] [DOI] |
| 15. | Kanai T, Kawamura T, Dohi T, Makita S, Nemoto Y, Totsuka T, Watanabe M. TH1/TH2-mediated colitis induced by adoptive transfer of CD4+CD45RBhigh T lymphocytes into nude mice. Inflamm Bowel Dis. 2006;12:89-99. [PubMed] [DOI] |
| 16. | Neurath MF, Finotto S, Fuss I, Boirivant M, Galle PR, Strober W. Regulation of T-cell apoptosis in inflammatory bowel disease: to die or not to die, that is the mucosal question. Trends Immunol. 2001;22:21-26. [PubMed] [DOI] |
| 19. | Gonsalkorale WM, Perrey C, Pravica V, Whorwell PJ, Hutchinson IV. Interleukin 10 genotypes in irritable bowel syndrome: evidence for an inflammatory component? Gut. 2003;52:91-93. [PubMed] [DOI] |
| 20. | Dunlop SP, Jenkins D, Neal KR, Spiller RC. Relative importance of enterochromaffin cell hyperplasia, anxiety, and depression in postinfectious IBS. Gastroenterology. 2003;125:1651-1659. [PubMed] [DOI] |
| 21. | Pace F, Molteni P, Bollani S, Sarzi-Puttini P, Stockbrügger R, Bianchi Porro G, Drossman DA. Inflammatory bowel disease versus irritable bowel syndrome: a hospital-based, case-control study of disease impact on quality of life. Scand J Gastroenterol. 2003;38:1031-1038. [PubMed] [DOI] |
| 22. | Neunlist M, Aubert P, Toquet C, Oreshkova T, Barouk J, Lehur PA, Schemann M, Galmiche JP. Changes in chemical coding of myenteric neurones in ulcerative colitis. Gut. 2003;52:84-90. [PubMed] [DOI] |
| 23. | Magro F, Vieira-Coelho MA, Fraga S, Serrão MP, Veloso FT, Ribeiro T, Soares-da-Silva P. Impaired synthesis or cellular storage of norepinephrine, dopamine, and 5-hydroxytryptamine in human inflammatory bowel disease. Dig Dis Sci. 2002;47:216-224. [PubMed] [DOI] |
| 24. | Stoyanova II, Gulubova MV. Mast cells and inflammatory mediators in chronic ulcerative colitis. Acta Histochem. 2002;104:185-192. [PubMed] [DOI] |