修回日期: 2007-01-03
接受日期: 2007-01-10
在线出版日期: 2007-03-18
目的: 研究白花丹参根制剂对体外培养的人胃癌细胞BGC823增殖和凋亡的影响.
方法: 用不同浓度白花丹参根制剂处理胃癌细胞BGC823后, 噻唑蓝(MTT)检测细胞的相对存活率, 流式细胞仪Annexin V/PI双染法检测BGC823细胞凋亡, 激光扫描共聚焦显微镜检测细胞形态. 对结果进行统计分析, 均数比较用t检验.
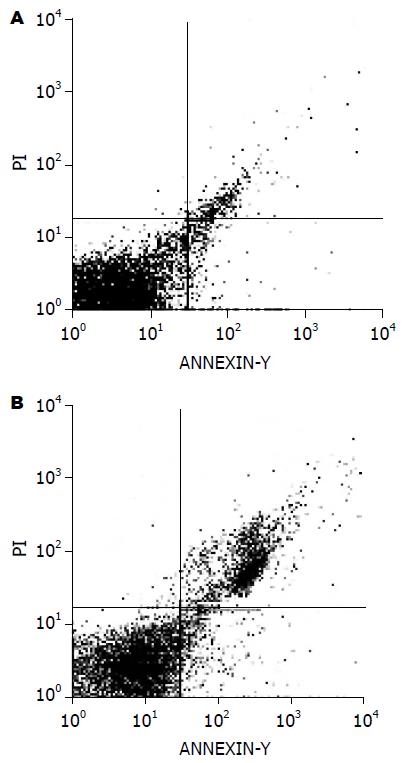
结果: 不同浓度白花丹参根制剂作用于BGC823细胞后, 细胞的存活率明显下降且呈剂量依赖性(0.4 g/L: 91.7%±10.6%; 0.8 g/L: 66.8%±5.1%; 1 g/L: 57.5%±9.6%; 1.5 g/L: 32.6%±7.3%; 2 g/L: 29.4%±9.4%). 镜下可见凋亡细胞典型形态, 流式细胞术分析表明经过白花丹参根制剂处理后早期凋亡细胞数和晚期凋亡细胞数与对照组相比均显著增加(2.950%±1.575% vs 4.105%±2.393%, P<0.05; 3.848%±2.264% vs 21.465%±6.474%, P<0.05).
结论: 白花丹参根制剂能有效地抑制胃癌细胞增生和诱导细胞凋亡.
引文著录: 焦鹏, 常起, 杨明峰, 张凤, 赵晓民, 夏作理. 白花丹参根制剂对胃癌细胞增殖和凋亡的影响. 世界华人消化杂志 2007; 15(8): 820-823
Revised: January 3, 2007
Accepted: January 10, 2007
Published online: March 18, 2007
AIM: To investigate the effects of Salvia miltiorrhiza Bge.f.alba root preparation (SMRP) on the proliferation and apoptosis of human gastric cancer cell line BGC823 cultured in vitro.
METHODS: Human gastric cancer cells BGC823 cultured in vitro were treated with different concentrations of SMRP, and then the relative survival rate of the cells in each group was examined by MTT method. Flow cytometry was used to detect the apoptosis of BGC823 cells and laser scanning confocal microscopy (LSCM) was used to demonstrate cell morphology. Statistical analysis was performed and t test was used to compare the mean value between the different groups.
RESULTS: After treatment with different concentrations of SMRP, as measured by MTT assay, cell viability decreased in a dose-dependent manner (0.4 g/L: 91.7% ± 10.6%; 0.8 g/L: 66.8% ± 5.1%; 1 g/L: 57.5% ± 9.6%; 1.5 g/L: 32.6% ± 7.3%; 2 g/L: 29.4% ± 9.4%). BGC823 cells cultured with SMRP showed the typical morphologic characteristics of apoptosis. Flow cytometry showed that the apoptotic rates in the early and late stage after SMRP treatment were significantly higher than those in the controls (4.105% ± 2.393% vs 2.950% ± 1.575%, P < 0.05; 21.465% ± 6.474% vs 3.848% ± 2.264%, P < 0.05).
CONCLUSION: SMRP can inhibit the proliferation and induce the apoptosis of human gastric cancer cells.
- Citation: Jiao P, Chang Q, Yang MF, Zhang F, Zhao XM, Xia ZL. Effects of Salvia miltiorrhiza Bge.f.alba root preparation on the proliferation and apoptosis of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 820-823
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/820.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.820
泰山白花丹参属唇型科植物, 是唇型科植物丹参的变型, 为丹参族中一极品, 是山东特有珍奇物种. 多年来, 人们将丹参广泛应用于临床, 是具有活血化瘀活性的常用中药, 临床主要用于治疗冠心病、心绞痛、缺血性中风、栓塞、肝脾肿大、化脓性感染等疾病[1-2]. 目前, 已有些研究认为丹参有抑癌作用[3-6], 但其对胃癌细胞的作用报道不多, 在我国, 胃癌的死亡率高居恶性肿瘤的首位, 发病率在恶性肿瘤中位居第二, 因此进行胃癌治疗的研究有重大的现实价值[7]. 我们研究白花丹参根制剂对胃癌细胞BGC823细胞增殖和凋亡的影响, 为进一步开发白花丹参这一珍奇的植物物种资源的应用价值提供基础资料.
白花丹参(产自泰山); 胃癌细胞BGC823; 1640培养基(Gibco); 新生牛血清(杭州四季清公司); 二甲基亚砜(DMSO), 噻唑蓝(MTT), 碘化丙啶(PI)均购自Sigma公司; Annexin-V-Flous染色试剂(Roche公司). 取100 g自然干燥的白花丹参根, 剪切成碎块, 加1 L双蒸水, 以温水浸泡4 h. 文火第1次煎2 h, 收集煮剂, 再加双蒸水1 L, 第2, 3次各煎1.5 h, 合并煎液, 200目滤网过滤, 5000 r/min离心10 min, 收集上清液. 旋转蒸发仪蒸馏煮剂至100 mL, -20 ℃至-60 ℃冰冻煮剂后, 冷冻干燥机干燥约19 h后大约得到50 g样品, 每次用时称取适当样品, 用无血清培养液溶解制成各种不同浓度的白花丹参根制剂, 0.22 mm滤膜过滤后, 4 ℃冰箱避光储存备用.
选用人胃癌细胞系BGC823细胞, 于含新生牛血清浓度为100 mL/L的1640培养基中培养, 其中在恒温培养箱中以50 mL/L CO2, 37 ℃及饱和湿度条件下培养, 每2 d换液一次, 当细胞80%融合时传代.
1.2.1 细胞存活率的影响: 单细胞悬液以每孔5×103个细胞100 mL接种于96孔培养板中, 贴壁24 h后分别接入不同浓度的无菌的白花丹参根制剂溶液100 mL, 使最终浓度分别为2、1.5、1、0.8、0.4 g/L, 各组设8个重复孔, 对照组加100 mL无血清培养液, 在37 ℃, 50 mL/L CO2条件下继续培养24 h, 实验终止前加入新配制的5 g/L的MTT溶液20 mL, 混匀, 再继续培养4 h, 弃去上清, 每孔加DMSO 200 mL, 充分振荡30 min, 溶解MTT沉淀物, 490 nm测定每孔的吸光度A值[8-13]. 计算胃癌细胞相对存活率: 相对存活率 = 实验孔A值/对照孔A值×100%[14].
1.2.2 流式细胞仪Annexin: V/PI双染法检测细胞凋亡, 将5×107/L细胞接种于50 mL培养瓶中, 24 h后加入无菌的白花丹参根制剂溶液, 使其终浓度为1 g/L, 对照组加等量的无血清培养液, 继续培养24 h, 漂浮细胞和用胰酶消化下的细胞5×105, PBS洗涤2次, 1000 r/min离心5 min后去上清, 将细胞重悬于100 mL Annexin-V-FLUOS和碘化丙锭(PI)染色液中, 室温下避光孵育15 min, 立即进行流式细胞仪检测, 实验重复1次.
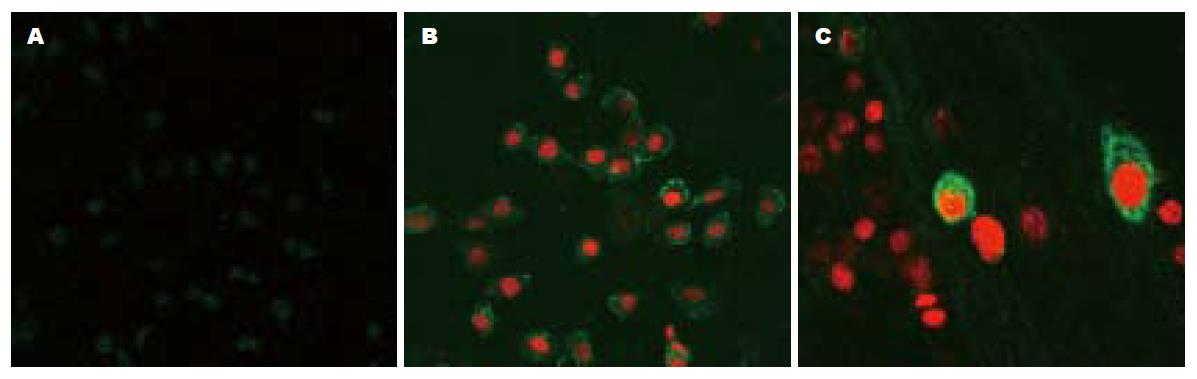
1.2.3 激光扫描共聚焦显微镜检测: 将密度5×107/L的BGC823细胞加入放有盖玻片的6孔培养板, 细胞在盖玻片上贴壁生长, 2 d更换培养液, 同时加入不同浓度的药物: (1)对照组(未做处理); (2)1 g/L白花丹参根制剂; (3)1.5 g/L白花丹参根制剂, 作用24 h后, 弃培养液, PBS冲洗, 每块盖片加100 mL Annexin-V-FLUOS和碘化丙啶(PI)染色液, 室温染色15 min, 封片, 在488 nm波长下用激光扫描共聚焦显微镜扫描细胞形态.
统计学处理 采用SPSS11.5进行统计分析, 均数比较用t检验. 所有数据均用mean±SD表示.
白花丹参根制剂处理BGC823细胞后, 能使细胞存活率明显下降, 并呈明显的剂量依赖效应(表1).
| 白花丹参根制剂(g/L) | 吸光度(A) | 存活率(%) |
| 0 | 1.109±0.053 | - |
| 0.4 | 1.017±0.117a | 91.7±10.6 |
| 0.8 | 0.741±0.057a | 66.8±5.1 |
| 1.0 | 0.638±0.107b | 57.5±9.6 |
| 1.5 | 0.361±0.081b | 32.6±7.3 |
| 2.0 | 0.326±0.104b | 29.4±9.4 |
在倒置相差显微镜下观察, 可见随着白花丹参根制剂浓度和孵育时间的增加, 贴壁细胞逐渐变圆, 折光性和贴壁能力均减弱, 而对照组细胞均无明显改变. 实验组悬浮的细胞数量多于对照组. 细胞爬片后, AnnexinV/PI荧光染色, 激光扫描共聚焦显微镜扫描显示, 正常对照组细胞发出微弱的绿色荧光, 在各实验组均发现有细胞核浓缩聚集, 并发出较强的绿色和红色荧光(图1).
在中效浓度附近选择1 g/L白花丹参根制剂作用24 h后BGC823细胞早期凋亡细胞数与晚期凋亡细胞数均明显增加, 与对照组相比差异具有显著性(2.950%±1.575% vs 4.105%±2.393%, 3.848%±2.264% vs 21.465%±6.474%, P<0.05)(图2).
白花丹参系多年生草本植物, 是丹参族中的极品. 现代医学检测证实其中的丹参酮ⅡA含量远远超过一般的丹参, 水溶性成份明显高于丹参, 约为丹参的2倍. 丹参的主要化学成分为水溶性酚酸类和脂溶性二萜醌类化合物. 丹参的脂溶性有效成分主要为丹参酮, 其中以丹参酮ⅡA含量较高; 水溶性酚酸类成分包括丹参素、原儿茶醛、丹参酚酸A、丹参酚酸B等, 其中丹参素即b-3, 4-二羟基苯乳酸含量较高, 是最主要的水溶性成分[15-16]. 据报道, 丹参的活性成分丹参素、丹参酮ⅡA有一定的抗肿瘤、诱导癌细胞凋亡作用[5,17-21]. 众所周知, 丹参的传统应用方式为水煎液, 因此其有效成分应以水溶性物质为主, 本文中制备的白花丹参根制剂为澄清透明、棕色的水溶液, 主要是丹参素等多种水溶性成分的混合液, 推测丹参酮含量极低.
通过MTT法观察白花丹参根制剂对人胃癌细胞增殖的影响表明, 白花丹参根制剂体外直接作用于胃癌细胞有明显抑制生长和杀伤作用, 且有浓度依赖性, 我们在中效浓度附近选择了1 g/L进一步用流式细胞仪分析其对胃癌细胞BGC823的作用, 结果表明处理的胃癌细胞BGC823晚期凋亡细胞数、早期凋亡细胞数均明显增加, 激光扫描共聚焦显微镜扫描显示了凋亡细胞典型形态, 这些说明白花丹参根制剂能够诱导胃癌细胞凋亡. 现代医学研究表明, 诱导肿瘤细胞凋亡是一条有效的肿瘤治疗途径, 比杀伤肿瘤细胞的治疗有明显的优越性, 故寻求高效低毒的肿瘤细胞凋亡诱导剂已成为目前肿瘤治疗的研究热点[18]. 我们使用的白花丹参根制剂主要是丹参水溶性成分, 丹参酮含量极低, 推测不是丹参酮引起的, 究竟是哪一种丹参的单体成分发挥主要作用, 是否为水溶性代表成分--丹参素的作用以及白花丹参根制剂具体是通过哪一机制诱导胃癌细胞凋亡, 还有待进一步的探索和研究.
临床上, 丹参是具有活血化瘀活性的常用中药, 其药物有效成分远高于《中国药典》中的紫花丹参, 尤其对血栓闭塞性脉管炎有特效. 因此, 白花丹参具有重要的医药和经济价值, 医家一直将其视为珍品. 目前, 已有些研究认为丹参有抑癌作用, 但对胃癌细胞的作用报道不多.
现代医学研究表明, 诱导肿瘤细胞凋亡是一条有效的肿瘤治疗途径, 比杀伤肿瘤细胞的治疗有明显的优越性, 故寻求高效低毒的肿瘤细胞凋亡诱导剂已成为目前肿瘤治疗的研究热点.
本文研究白花丹参根制剂对胃癌细胞BGC823细胞增殖和凋亡的影响, 不但为进一步开发白花丹参这一珍奇的植物物种资源的应用价值提供基础资料, 而且对临床治疗胃癌具有重要的参考价值.
本文研究了中药白花丹参根制剂对体外培养的人胃癌细胞BGC823的增殖和凋亡的影响, 文章研究方法较先进, 研究内容较新颖, 结果准确, 在临床治疗胃癌方面可能具有潜在的应用价值.
编辑: 张焕兰 电编:张敏
| 3. | 谭 宇蕙, 杜 标炎, 吴 映雅, 李 杰芬, 刘 晓东, 钟 富有. 丹参注射液和三七总皂甙对大鼠肝癌细胞及自杀基因旁观者效应的影响. 世界华人消化杂志. 2005;13:2540-2544. |
| 8. | 黄 光琦, 宋 毅, 张 洁, 陆 燕蓉, 肖 林, 杨 元, 郭 元彪. 丹参酮ⅡA增强HSV-tk/GCV旁观者效应及其与Cx43 mRNA表达的关系. 中华肿瘤杂志. 2004;26:146-149. |
| 10. | Wu K, Yuan LH, Xia W. Inhibitory effects of apigenin on the growth of gastric carcinoma SGC-7901 cells. World J Gastroenterol. 2005;11:4461-4464. [PubMed] [DOI] |
| 11. | Huang C, Liu LY, Song TS, Ni L, Yang L, Hu XY, Hu JS, Song LP, Luo Y, Si LS. Apoptosis of pancreatic cancer BXPC-3 cells induced by indole-3-acetic acid in combination with horseradish peroxidase. World J Gastroenterol. 2005;11:4519-4523. [PubMed] [DOI] |
| 12. | Wang D, Xiang DB, He YJ, Li ZP, Wu XH, Mou JH, XiaoHL , Zhang QH. Effect of caffeic acid phenethyl ester on proliferation and apoptosis of colorectal cancer cells in vitro. World J Gastroenterol. 2005;11:4008-4012. [PubMed] [DOI] |
| 13. | Zhang R, Gong J, Wang H, Wang L. Bile salts inhibit growth and induce apoptosis of human esophageal cancer cell line. World J Gastroenterol. 2005;11:5109-5116. [PubMed] |