修回日期: 2007-01-01
接受日期: 2007-01-07
在线出版日期: 2007-03-08
目的: 探讨趋化性细胞因子受体CXCR4在大肠癌中的表达及其与预后的关系.
方法: 收集67例大肠癌患者手术标本, 采用免疫组织化学方法检测肿瘤组织中CXCR4蛋白的表达和微血管密度, 分析CXCR4的表达水平与临床病理特征和生存的关系.
结果: 大肠癌组织中CXCR4蛋白表达阳性率为56.7%(38/67), 与患者的性别、年龄、肿瘤部位、T分期和病理类型无相关性(P>0.05), 与淋巴结转移、临床分期、微血管密及生存相关. N0, N1和N2期CXCR4的阳性率分别为40.6%, 68.2%, 76.9%(P<0.05);Ⅰ+Ⅱ期和Ⅲ期CXCR4的阳性率分别为39.4%, 73.5% (P<0.05). 低MVD组CXCR4的阳性率显著低于高MVD组(36.4% vs 74.3%, P<0.01); CXCR4阳性组较CXCR4阴性组有较高的复发/转移率(47.4% vs 24.1%, P<0.05)和较低的3年无病生存率(32.6% vs 71.3%, P<0.05).
结论: CXCR4可能促进大肠癌的侵袭和转移以及血管生成并影响其预后.
引文著录: 张孟贤, KashifIqbal, 于世英. 趋化性细胞因子受体CXCR4在大肠癌的表达及其临床意义. 世界华人消化杂志 2007; 15(7): 772-776
Revised: January 1, 2007
Accepted: January 7, 2007
Published online: March 8, 2007
AIM: To investigate the expression of chemokine receptor CXCR4 in colorectal carcinoma and its correlation with the clinicopathologic characteristics and prognosis.
METHODS: Immunohistochemistry was used to detect the expression of CXCR4 and tumor microvessel density (MVD) in 67 tissue specimens of colorectal carcinoma, and the correlation between the CXCR4 expression and clinicopathologic factors was evaluated.
RESULTS: The positive rate of CXCR4 expression was 56.7% in colorectal carcinoma, which was correlated with lymph node metastasis, clinical staging and MVD as well as the survival of patients, but not with the sex and age of patients, tumor location, T staging, and pathological types. The expression of CXCR4 was 40.6%, 68.2% and 76.9% in cases of N0, N1 and N2 stage, 39.4% and 73.5% in cases of Ⅰ+Ⅱ and Ⅲ stage, respectively. The positive rate of CXCR4 expression was significantly lower in the case with low MVD than that with high MVD (36.4% vs 74.3%, P < 0.01), and the CXCR4-positive case had a higher recurrent or metastatic rate (47.4% vs 24.1%, P < 0.05) and a lower 3-year survival rate (32.6% vs 71.3%, P < 0.05) than the CXCR4-negative one.
CONCLUSION: Positive CXCR4 expression and high tumor MVD are associated with the poor prognosis of patients, and they can be used as potential predictive factors for the recurrence or metastasis of colorectal cancer.
- Citation: Zhang MX, Kashif I, Yu SY. Expression of CXC chemokine receptor CXCR4 in colorectal carcinoma and its correlation with prognosis Meng-Xian Zhang, Iqbal Kashif, Shi-Ying Yu. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 772-776
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/772.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.772
大肠癌是世界范围内最常见的恶性肿瘤之一, 占所有癌症相关死亡原因的第3位. 在临床上主要采取以手术治疗为主的综合治疗, 但效果并不理想, 仍有相当部分患者会失败. 复发和转移是大肠癌患者死亡的主要原因. 因此, 大肠癌复发和转移相关机制的研究具有重要意义. 最近研究表明, 趋化性细胞因子及其受体的相互作用可能在癌症的定向转移过程中起着关键作用. 其中最令人瞩目的是趋化因子受体CXCR4与其配体CXCL12的相互作用(CXCR4/CXCL12轴)与多种癌症发展及转移密切相关. 本研究采用免疫组织化学方法检测大肠癌中的CXCR4表达和微血管密度(micro vessel density, MVD), 探讨CXCR4在大肠癌中的表达情况及其与预后的关系.
2003-01/2004-12在华中科技大学附属同济医院行根治性手术切除的大肠癌组织标本67例. 要求纳入本研究的患者均未接受术前放化疗, 并且有完整临床病理资料(包括患者年龄、性别、诊断、病理类型、TNM分期等)和随访资料(包括复发、死亡或无瘤生存). 67例患者中男48例, 女19例; 中位年龄52岁(25-71岁); 结肠癌40例, 直肠癌27例; 根据AJCC(美国癌症联合会)第6版分期标准, Ⅰ期14例, Ⅱ期19例, Ⅲ期34例. 末次随访时间到2006-05-31, 中位随访时间23(3-40) mo. 兔抗人CXCR4 mAb购自晶美生物公司, 兔抗人CD34 mAb和SP试剂盒购自北京中山生物公司.
术后标本经40 g/L甲醛固定, 石蜡包埋, 切片厚4 μm, 常规脱蜡至水. 采用SP三步法, 具体操作步骤按试剂说明书进行. CXCR4蛋白检测采用的一抗为兔抗人CXCR4 mAb(工作浓度为1:100); 微血管密度检测一抗为兔抗人CD34 mAb (工作浓度为1:50). 阴性对照用PBS代替一抗.
CXCR4结果判断: 光学显微镜下观察, 阳性细胞胞膜、胞质或者胞核出现棕黄色颗粒. 在低倍镜(40×)下观察CXCR4表达较强的区域, 高倍镜(200×)观察3个视野, 计数阳性细胞所占的百分比. 参考相关文献[1], 阳性细胞超过肿瘤细胞数的10%定义为CXCR4阳性, 否则为阴性.
MVD计数: 凡染成棕黄色, 与临近血管、癌细胞分开的单个内皮细胞或内皮细胞簇, 均作为一个血管计数, 不考虑是否有管腔形成. 凡管腔大于8个红细胞大小, 或有较厚的血管肌层均不计数. 先在低倍镜(40×)下选取5个血管数量较多的视野, 再转到高倍镜(200×)下计数每个视野的微血管数量. 按照每个200倍视野面积为0.785 mm2, 计算MVD, 以5个视野的均值作为每个标本的MVD值.
统计学处理 CXCR4的表达及MVD与临床病理参数的关系采用χ2分析, 生存情况使用Kaplan-Meier法绘制生存曲线, 并用log-rank检验. 所有统计计算使用SPSS10.0版统计分析软件包完成, P<0.05具有统计学意义.
大肠癌组织中CXCR4阳性表达在光学显微镜下表现为棕黄色颗粒, 为胞膜、胞质或胞核的阳性着色. 本研究67例中有38例(56.7%)CXCR4表达阳性. CXCR4蛋白表达与大肠癌淋巴结转移状况(N分期)关系密切, 随着淋巴结分期的升高, CXCR4的表达显著增加(P<0.05); 在大肠癌的临床分期(AJCC分期系统)中, CXCR4蛋白表达与临床分期相关, Ⅰ+Ⅱ期和Ⅲ期CXCR4的阳性率分别为39.4%和73.5%(P<0.05); CXCR4蛋白的阳性率随分化程度的降低有升高趋势, 但差异无统计学意义(P>0.05). CXCR4的表达与患者的性别、年龄、肿瘤部位、T分期和病理类型无明显关系(P>0.05)(表1).
| 参数 | n(%) | CXCR4表达 | P值 | MVD | P值 | ||
| 阴性 | 阳性 | 低 | 高 | ||||
| 性别 | |||||||
| 男 | 48(71.6) | 20 | 28 | 0.67 | 22 | 26 | 0.425 |
| 女 | 19(28.4) | 9 | 10 | 11 | 8 | ||
| 年龄(y) | |||||||
| <50 | 29(43.3) | 11 | 18 | 0.44 | 12 | 17 | 0.327 |
| ≥50 | 38(56.7) | 18 | 20 | 21 | 17 | ||
| 部位 | |||||||
| 结肠 | 40(59.7) | 19 | 21 | 0.39 | 18 | 22 | 0.460 |
| 直肠 | 27(40.3) | 10 | 17 | 15 | 12 | ||
| T分期 | |||||||
| T1 | 7(10.4) | 4 | 3 | 0.68 | 5 | 2 | 0.154 |
| T2 | 27(40.3) | 11 | 16 | 15 | 12 | ||
| T3 | 23(34.3) | 11 | 12 | 11 | 12 | ||
| T4 | 10(14.9) | 3 | 7 | 2 | 8 | ||
| N分期 | |||||||
| N0 | 32(47.8) | 19 | 13 | 0.04 | 20 | 12 | 0.098 |
| N1 | 22(32.8) | 7 | 15 | 9 | 13 | ||
| N2 | 13(19.4) | 3 | 10 | 4 | 9 | ||
| 临床分期 | |||||||
| Ⅰ | 14(20.9) | 8 | 6 | 0.02 | 10 | 4 | 0.106 |
| Ⅱ | 19(28.4) | 12 | 7 | 10 | 9 | ||
| Ⅲ | 34(50.7) | 9 | 25 | 13 | 21 | ||
| 病例类型 | |||||||
| 管状腺和 | |||||||
| 乳头状腺 | 51(76.1) | 25 | 26 | 0.21 | 31 | 20 | 0.003 |
| 黏液腺 | 10(14.9) | 3 | 7 | 2 | 8 | ||
| 其他 | 6(9.0) | 1 | 5 | 0 | 6 | ||
| 分化程度 | |||||||
| 高分化 | 18(26.9) | 8 | 10 | 0.08 | 9 | 9 | 0.757 |
| 中分化 | 28(41.8) | 13 | 15 | 15 | 13 | ||
| 低分化 | 21(31.3) | 8 | 13 | 9 | 12 | ||
全组67例大肠癌患者MVD值为18.50±7.48, 以小于均值归入低MVD组, 大于或等于均值则归入高MVD组, 其中高MVD组占50.7% (34/67). MVD的高低与大肠癌的病理类型密切相关(P<0.05); 随着N分期和临床分期的升高, MVD有升高趋势, 但差异无统计学意义(P>0.05); MVD与患者年龄、性别、肿瘤部位、T分期和分化程度无明显关系(P>0.05)(表1).
本研究结果显示, 33例低MVD大肠癌中CXCR4的阳性表达率为36.4%(12/33), 明显低于高MVD组的74.3%(P<0.01), 提示大肠癌组织微血管密度与CXCR4的表达有关.
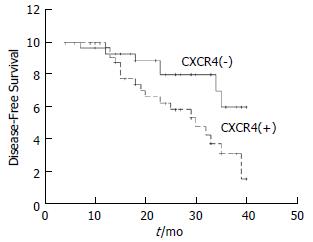
在随访过程中, 全组大肠癌患者中有25例在治疗后不同的时间出现复发/转移, 复发/转移率为37.3% (25/67). CXCR4阴性组复发率为24.1%, 明显低于CXCR4阳性组的47.4%(P<0.05). 比较两组的生存曲线(图1), CXCR4阴性组3年无病生存率为71.3%, CXCR4阳性组为32.6%, 经log-rank检验, 差异有显著性(P<0.05).
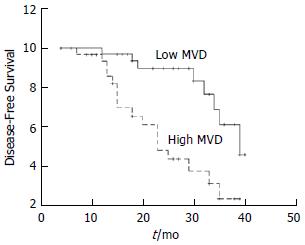
根据肿瘤组织中微血管密度的高低, 比较患者的生存曲线(图2), 低MVD组3年无病生存率为68.4%, 高MVD组为24.7%, 经log-rank检验, 差异有显著性(P<0.05).
大肠癌包括结肠癌和直肠癌两部分, 最重要的生物学特征之一就是容易发生转移. 约35%的结直肠患者在确诊时已发生转移, 其中最常见的转移部位为肝脏. 因此, 研究结直肠癌的转移机制, 寻找预防和治疗结直肠癌转移的方法, 对于提高结直肠患者的预后具有重要意义.
人类的趋化性细胞因子家族包含着约45-50种蛋白质, 具有广泛的生物学功能[2-3]. CXCL12是属于CXC类趋化性细胞因子, CXCR4是其唯一的专属受体[4]. 起初对于CXCR4/CXCL12信号系统的研究主要集中在免疫系统, 研究表明他在造血干细胞归巢、淋巴细胞迁移和HIV感染等方面发挥着重要作用[5-6]. 自Muller et al[7]报道了在大鼠模型中CXCR4与其配体CXCL12共同作用导致乳腺癌转移后, 趋化因子及其受体对肿瘤细胞的转移作用受到广泛重视. 他们在研究中发现CXCR4在人类乳腺癌中高表达, 而CXCR4的特异性配体CXCL12在乳腺癌容易发生转移的器官中高表达, 如骨髓、肺和脑. 此外, 有人发现如果用抗体体内中和CXCR4或采用基因沉默技术, 可以导致乳腺癌侵袭能力和器官特异性转移潜能明显下降[8-9]. 最近一些研究报道, 人类的卵巢癌[10]、肺癌[11]、食道癌[12]等也存在着CXCR4的选择性表达. 基于以上研究, 我们推断一些不同的癌细胞亦可能通过CXCR4/CXCL12途径介导他们的侵袭和转移, 就此我们检测分析了CXCR4在人大肠癌组织中的表达情况及其与临床病理特征和预后的关系.
在本实验中, 我们通过对67例大肠癌手术标本进行免疫组织化学染色, 发现38例CXCR4阳性表达, 阳性表达率为56.7%. 通过进一步分析, 我们发现CXCR4的表达与大肠癌淋巴结转移状况(N分期)和AJCC临床分期密切相关. 随着N分期和临床分期的增高, CXCR4表达的阳性率增高(P<0.05). CXCR4阳性表达率与患者年龄、性别、病理类型、肿瘤大小(T分期)无明显关系. 结果与文献报道基本一致. Ottaiano et al[13]对72例Ⅱ期和Ⅲ期大肠癌手术标本进行研究, 结果发现CXCR4表达阳性率为77.8%, 且与淋巴结受累和早期发生远处转移密切相关. 马向涛 et al[14]研究发现结直肠癌组织中CXCR4/CXCL12表达水平比正常组织明显增高; 大肠癌肝转移组织中CXCR4/CXCL12表达比原发肿瘤增高. Rubie et al[15]实验也发现大肠癌肝转移灶CXCR4表达明显上调. 这些结果提示CXCR4极有可能参与大肠癌的侵袭和转移.
研究表明, 一些趋化性细胞因子可能通过促进血管生成而在肿瘤生长方面发挥间接作用[16]. Salcedo et al[17]研究发现, CXCR4是内皮细胞表达的一种主要的趋化性细胞因子受体. VEGF和bFGF可以明显上调CXCR4在内皮细胞上的表达, 使内皮细胞对CXCL12的反应性增加. 反过来, CXCL12/CXCR4也可以增加内皮细胞合成和释放VEGF, 从而形成一个正反馈过程, 促进血管的生成. 为了探讨趋化性细胞因子受体CXCR4与大肠癌血管生成的关系, 我们对67例大肠癌标本MVD进行检测(MVD与临床病理特征的关系见表1). 结果发现低MVD组CXCR4阳性表达率较高MVD组低, 提示大肠癌组织血管生成与CXCR4的表达有关. CXCR4是否通过促进血管生成从而促进大肠癌的侵袭和转移需要进一步深入研究.
为了进一步研究CXCR4的表达与大肠癌患者预后的关系, 我们对患者进行了随访. 通过分析发现CXCR4阴性组复发/转移率为24.1%, 明显低于CXCR4阳性组的47.4%(P<0.05). CXCR4阴性组3年无病生存率为71.3%, CXCR4阳性组为32.6%, 差异有显著性(P<0.05). 同时也分析了MVD对大肠癌预后的影响, 结果发现低MVD组3年无病生存率为68.4%, 高MVD组为24.7%, 差异有显著性(P<0.05). 提示CXCR4的表达与大肠癌的复发/转移以及生存有关. 因此通过检测大肠癌患者CXCR4的表达和MVD, 有可能帮助我们预测和识别复发和转移的高危患者, 以进行强化治疗.
总之, 本研究结果表明CXCR4在大肠癌组织中的表达与淋巴结受累、临床分期、无病生存率及肿瘤的MVD密切相关. 提示CXCR4可能在大肠癌发生、发展、侵袭转移和肿瘤血管生成中发挥着重要作用. 这些结果不仅为大肠癌患者预后的判断提供了参考, 而且为预防和治疗大肠癌复发和转移提供新的靶点和策略, 值得进一步深入研究.
恶性肿瘤侵袭和转移是一个多阶段多步骤的复杂过程, 是肿瘤致死的主要原因, 也是当前研究的热点, 但其具体机制尚不清楚. 最新研究表明, 趋化性细胞因子及其受体的相互作用可能在癌症的定向转移过程中起着关键作用. 其中最令人瞩目的是趋化因子受体CXCR4与其配体CXCL12的相互作用与多种癌症侵袭和转移密切相关.
本文在检测CXCR4表达的同时进行微血管密度检测, 初步探讨了CXCR4与肿瘤血管生成的关系. 另外对入选的研究对象进行较长时间的随访, 分析CXCR4表达与患者生存和复发/转移的关系.
探讨CXCR4在大肠癌中的表达及其与复发和转移的关系, 有助于分析大肠癌转移的发生机制, 为大肠患者预后的判断提供了参考, 为预防和治疗大肠复发和转移提供新的靶点和策略.
1 趋化性细胞因子: 趋化性细胞因子是不同类型细胞分泌的低分子量(8-10 kDa)的细胞因子, 他们对各种白细胞亚类, 如中性粒细胞、单核细胞、淋巴细具有趋化和预激活作用. 2 趋化性细胞因子受体: 是一类表达于不同类型细胞上的含有7个跨膜区的 G蛋白偶联受体. 趋化性细因子通过作用于趋化性细胞因子受体参与多种生理和病理过程, 如细胞的生长、发育、分化、凋亡等, 通过趋化吸引白细胞及调节其效应功能等参与免疫应答过程.
肿瘤的复发与转移是决定预后的关键因素, 因此是分子肿瘤学研究的热点. 本文研究趋化性细胞因子受体CXCR4在大肠癌中的表达及与临床特征的关系, 以明确CXCR4在结肠癌中的作用. 研究发现CXCR4在人大肠癌组织中的表达率较高, 并且与淋巴结受累、临床分期、无病生存时间及肿瘤的MVD密切相关, 表明CXCR4是一结肠癌复发、转移的预警因子, 研究具有一定的价值.
电编: 张敏 编辑:张焕兰
| 1. | Takanami I. Overexpression of CCR7 mRNA in nonsmall cell lung cancer: correlation with lymph node metastasis. Int J Cancer. 2003;105:186-189. [PubMed] |
| 2. | Rossi D, Zlotnik A. The biology of chemokines and their receptors. Annu Rev Immunol. 2000;18:217-242. [PubMed] |
| 3. | Zlotnik A, Yoshie O. Chemokines: a new classifi-cation system and their role in immunity. Immunity. 2000;12:121-127. [PubMed] |
| 4. | Kucia M, Jankowski K, Reca R, Wysoczynski M, Bandura L, Allendorf DJ, Zhang J, Ratajczak J, Ratajczak MZ. CXCR4-SDF-1 signalling, locomotion, chemotaxis and adhesion. J Mol Histol. 2004;35:233-245. [PubMed] |
| 5. | Kim CH, Broxmeyer HE. SLC/exodus2/6Ckine/TCA4 induces chemotaxis of hematopoietic progenitor cells: differential activity of ligands of CCR7, CXCR3, or CXCR4 in chemotaxis vs. suppression of progenitor proliferation. J Leukoc Biol. 1999;66:455-461. [PubMed] |
| 6. | Bleul CC, Farzan M, Choe H, Parolin C, Clark-Lewis I, Sodroski J, Springer TA. The lymphocyte chemoattractant SDF-1 is a ligand for LESTR/fusin and blocks HIV-1 entry. Nature. 1996;382:829-833. [PubMed] |
| 7. | Muller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME, McClanahan T, Murphy E, Yuan W, Wagner SN. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2001;410:50-56. [PubMed] |
| 8. | Lapteva N, Yang AG, Sanders DE, Strube RW, Chen SY. CXCR4 knockdown by small interfering RNA abrogates breast tumor growth in vivo. Cancer Gene Ther. 2005;12:84-89. [PubMed] |
| 9. | Liang Z, Yoon Y, Votaw J, Goodman MM, Williams L, Shim H. Silencing of CXCR4 blocks breast cancer metastasis. Cancer Res. 2005;65:967-971. [PubMed] |
| 10. | Jiang YP, Wu XH, Shi B, Wu WX, Yin GR. Expression of chemokine CXCL12 and its receptor CXCR4 in human epithelial ovarian cancer: an independent prognostic factor for tumor progression. Gynecol Oncol. 2006;103:226-233. [PubMed] |
| 11. | Su L, Zhang J, Xu H, Wang Y, Chu Y, Liu R, Xiong S. Differential expression of CXCR4 is associated with the metastatic potential of human non-small cell lung cancer cells. Clin Cancer Res. 2005;11:8273-8280. [PubMed] |
| 12. | Koishi K, Yoshikawa R, Tsujimura T, Hashimoto-Tamaoki T, Kojima S, Yanagi H, Yamamura T, Fujiwara Y. Persistent CXCR4 expression after preoperative chemoradiotherapy predicts early recurrence and poor prognosis in esophageal cancer. World J Gastroenterol. 2006;12:7585-7590. [PubMed] |
| 13. | Ottaiano A, Franco R, Aiello Talamanca A, Liguori G, Tatangelo F, Delrio P, Nasti G, Barletta E, Facchini G, Daniele B. Overexpression of both CXC chemokine receptor 4 and vascular endothelial growth factor proteins predicts early distant relapse in stage II-III colorectal cancer patients. Clin Cancer Res. 2006;12:2795-2803. [PubMed] |
| 14. | 马 向涛, 余 力伟, 张 在兴, 王 杉, 杜 如昱, 崔 志荣. 趋化因子受体CXCR4/CXCL12信号转导通路在结直肠癌肝转移中的作用. 世界华人消化杂志. 2006;14:1566-1570. [DOI] |
| 15. | Rubie C, Frick VO, Wagner M, Weber C, Kruse B, Kempf K, Konig J, Rau B, Schilling M. Chemokine expression in hepatocellular carcinoma versus colorectal liver metastases. World J Gastroenterol. 2006;12:6627-6633. [PubMed] |
| 16. | Strieter RM, Burdick MD, Mestas J, Gomperts B, Keane MP, Belperio JA. Cancer CXC chemokine networks and tumour angiogenesis. Eur J Cancer. 2006;42:768-778. [PubMed] |
| 17. | Salcedo R, Wasserman K, Young HA, Grimm MC, Howard OM, Anver MR, Kleinman HK, Murphy WJ, Oppenheim JJ. Vascular endothelial growth factor and basic fibroblast growth factor induce expression of CXCR4 on human endothelial cells: In vivo neovascularization induced by stromal-derived factor-1alpha. Am J Pathol. 1999;154:1125-1135. [PubMed] |