修回日期: 2006-11-30
接受日期: 2006-12-27
在线出版日期: 2007-03-08
目的: 探讨热休克蛋白70(HSP70)表达是否随应激性胃溃疡病程的进展而变化.
方法: 收集30例应激性胃溃疡出血患者及10例术前患者的胃液及外周血, 采用TRIzol一步法提取胃液脱落细胞及外周血白细胞总RNA, 采用半定量RT-PCR检测HSP70的表达; 同时, 采用免疫组化技术检测外周血白细胞HSP70的表达.
结果: RT-PCR检测结果提示应激性溃疡各期的HSP70表达明显高于对照组的表达(血标本: 1期0.6289±0.1839, 2期1.1322±0.3683, 3期0.6855±0.1923, 对照组0.3868±0.2071; 胃液标本: 1期0.7741±0.2442, 2期1.2385±0.4558, 3期0.8790±0.2722, 对照组0.4626±0.2416; 均P<0.05), 应激性溃疡2期HSP70表达显著高于1期和3期(P<0.05), 而1期和3期之间无统计学差异(P>0.05). 免疫组化结果为应激性溃疡患者外周血白细胞HSP70的表达水平在不同病期有所不同(1期40%, 2期80%, 3期30%, 对照组10%, χ2 = 10.8383, P<0.05), 以2期表达水平最高, 对照组表达最低.
结论: 应激性溃疡时患者外周血细胞和胃液脱落细胞均可检测到HSP70的表达, 应激状态可诱导HSP70的表达, HSP70对胃黏膜具有保护作用, 并可能促进应激性溃疡的愈合.
引文著录: 王鹤, 曲彦, 胡丹. 热休克蛋白70对应激性胃溃疡黏膜的保护作用. 世界华人消化杂志 2007; 15(7): 712-716
Revised: November 30, 2006
Accepted: December 27, 2006
Published online: March 8, 2007
AIM: To investigate whether the expressive intensity of heat shock protein 70 (HSP70) is changed with the progression of stress ulcer.
METHODS: Thirty stress ulcer patients with bleeding and ten patients without bleeding before operation from intensive care unit were included as study subjects. Gastric fluid and blood specimen were collected from these patients. After total RNA was extracted from the shed cells in gastric juice and peripheral white blood cells (PWBC) by TRIzol method, semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) was used to investigate the intensity of HSP70 expression. Meanwhile, immunohistochemistry was used to evaluate the expression of HSP70 in PWBC.
RESULTS: RT-PCR result showed that the expressive intensity of HSP70 in each stage of stress ulcer was remarkably higher than that in the control group (blood specimen: 0.6289 ± 0.1839, 1.1322 ± 0.3683, 0.6855 ± 0.1923 vs 0.3868 ± 0.2071; gastric fluid specimen: 0.7741 ± 0.2442, 1.2385 ± 0.4558, 0.8790 ± 0.2722 vs 0.4626 ± 0.2416; for stage 1, 2, 3 and control group, respectively; all P < 0.05). The expression of HSP70 in stage-2 ulcer was higher than that in stage-1 and -3 one (P < 0.05), but there was no significant difference in the expressive intensity of HSP70 between stage-1 and -3 ulcer (P > 0.05). Immunohistochemistry showed that the level of HSP70 expressive was significantly different among stress ulcer of different stages and the control group (40%, 80%, 30%, 10%, for stage 1, 2, 3 and control group, respectively, χ2 = 10.8383, P < 0.05), and the highest expression level occurred in stage-2 ulcer and the lowest in the control group.
CONCLUSION: HSP70 expression can be detected both in the shed cells in gastric fluid and PWBC from patients with stress ulcer. HSP70 may protect gastric mucosa from stress-induced damage and promote the healing of ulcer.
- Citation: Wang H, Qu Y, Hu D. Protective role of heat shock protein 70 for gastric mucosa with stress ulcer. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 712-716
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/712.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.712
热休克蛋白是一组高度保守、与应激相关的蛋白, 在细胞正常发育和多种应激状态下对维持细胞的稳定性具有重要作用. 机体经常处于各种应激状态下, 应激可造成胃黏膜损伤并降低胃黏膜的屏障保护作用, 导致应激性溃疡的产生[1-3]. 同时应激也可诱导热休克蛋白的合成, 而热休克蛋白又可以预防应激性溃疡, 抑制胃黏膜细胞凋亡, 促进胃溃疡的愈合. HSP70在正常情况下表达很低或是不表达, 而在应激状态下表达明显增强[4-5], 以往关于应激性溃疡与HSP70相互关系的研究多为检测血细胞中或干预后的动物胃黏膜上皮细胞中HSP70的表达, 本研究同时检测应激性溃疡患者外周血细胞以及胃液中脱落细胞(胃黏膜上皮细胞和炎性细胞等)HSP70的表达, 进一步探讨HSP70表达与应激性溃疡的关系.
2005-11/2006-06收集30例在重症监护病房(ICU)进行治疗的应激性溃疡患者的胃液和外周抗凝血, 其中男18例, 女12例, 平均年龄61.4±16.1岁. 患者入选条件为: (1)收住时无应激性溃疡, 住院期间出现; (2)此次入院非消化道因素, 住院期间因其他疾病导致应激溃疡出血; (3)年龄18-80岁. 收集3个时间点的胃液, 即刚出现溃疡出血颜色较浅时; 颜色最深呈深咖啡色且量较多时; 颜色变淡呈浅咖啡色或转为正常时(分别定义为1, 2及3期). 同时选择无消化道应激性溃疡出血的10例(其中男6例, 女4例, 平均年龄68.3±7.2岁)术前患者, 收集其外周抗凝血和胃液作为对照. HSP70 mAb为美国NEO公司产品; SP通用型染色试剂盒、DAB显色试剂均购自北京中杉金桥生物技术有限公司; 血细胞分离试剂Percoll和反转录试剂盒购自美国Promega公司; PCR反应体系购自上海生工生物工程技术服务有限公司; DNA marker DL-2000购自大连宝生物工程有限公司.
每位患者收集胃液约20 mL, 3000 r/min离心取沉淀, 分离上皮细胞, 移入1.5 mL EP管中, 加TRIzol液1 mL提取细胞总RNA. 同时采集外周抗凝血10 mL, 3000 r/min离心取沉淀后, 用Percoll试剂分离上层血浆样部分的中性粒细胞, 一部分制备细胞涂片用于免疫组化检测, 一部分细胞加TRIzol液1 mL提取细胞总RNA.
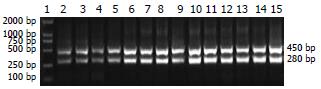
1.2.1 半定量RT-PCR: 参照文献[6]设计扩增HSP70基因和内参照GAPDH基因的特异性引物, 由上海生工生物工程技术服务工程有限公司合成. 引物序列为: 上游引物5'-CAACGGGCGCGACCTGAACA-3',下游引物5'- CCTCTCGCCCTCGTACACCTGGAT-3', 扩增产物为280 bp. 内参引物序列为: 上游引物5'-CTCAGACACCATGGGGAAGGTGA-3', 下游引物5'-ATGATCTTGAGGCTGTTGTCATA-3', 扩增产物为450 bp. 参照逆转录试剂盒要求的标准条件合成cDNA作为PCR反应模板. PCR反应体系为25 μL, 包括10×Buffer 2.5 μL, MgCl2 1.5 mmol/L, 4×dNTP 0.2 mmol/L, 上下游引物各0.5 mmol/L, TaqE 1 U, cDNA 3 μL, 无菌去离子水加至25 μL. 反应条件为: 94℃预变性5 min; 然后94℃ 60 s, 55℃ 45 s, 72℃ 1 min, 共35个循环; 最后72℃延伸10 min. 取10 μL PCR扩增产物于含EtBr(0.5 mg/L)的20 g/L琼脂糖凝胶中电泳, 80 V, 1 h, 紫外透射仪下观察电泳结果, 并用天能GIL凝胶图像处理系统进行分析.
1.2.2 免疫组化检测HSP70蛋白的表达: 制备外周血白细胞涂片, 干燥后冷丙醇固定, 依次滴加1:150稀释的鼠抗人HSP70 mAb、生物素标记的通用型二抗工作液、辣根过氧化物酶标记的链霉卵白素工作液于细胞涂片上, 37℃分别孵育2.5 h, 15 min, 15 min. 加现配制的DAB显色液覆盖标本, 显色约15-20 min, 自来水充分冲洗后进行苏木素复染涂片, 进而依次脱水、透明和中性树胶封片, 光学显微镜下观察结果.
由三位有经验的读片专家分别读片. 根据染色有无及深浅可分为阳性和阴性结果. 如果细胞核和细胞质出现棕黄色着色(可同时伴有胞质的棕黄色颗粒)视为阳性信号, 若同一涂片阳性细胞数>30%细胞数则视为阳性病例[7].
统计学处理 HSP70 cDNA扩增的半定量PCR检测结果采用计量资料的方差分析, 免疫组化结果采用χ2检验进行统计学分析, P<0.05表示有显著性差异.
以GAPDH为内参照, 应用半定量RT-PCR检测30例应激性溃疡患者和10例对照者外周血白细胞HSP70 mRNA水平, 部分标本检测结果见图1. 每份标本均可观察到280 bp和450 bp两条电泳条带, 分别为HSP70和GAPDH扩增条带, 以HSP70基因与GAPDH基因扩增条带光密度值的比值表示目的基因的表达水平, 计算应激性溃疡患者组和对照组HSP70平均表达水平. 统计分析结果表明2期患者HSP70表达水平(1.1322±0.3683)明显高于1期(0.6289±0.1839)、3期(0.6855±0.1923)和对照组(0.3868±0.2071), 差别有统计学意义(P<0.05); 1期和3期患者HSP70表达水平也明显高于对照组, 差别有统计学意义(P<0.05); 而1期和3期患者HSP70表达水平无显著性差异(P>0.05). 结果表明对照组HSP70表达低于其他各实验组, 而实验组2期HSP70表达明显强于其他实验组和对照组(表1).
| 分期 | 血标本光密度值比值 | HSP70蛋白表达 | 胃液标本光密度值比值 | |
| 阴性(n) | 阳性(n) | |||
| 1期 | 0.6289±0.1839 | 6 | 4 | 0.7741±0.2442 |
| 2期 | 1.1322±0.3683 | 2 | 8 | 1.2385±0.4558 |
| 3期 | 0.6855±0.1923 | 7 | 3 | 0.8790±0.2722 |
| 对照 | 0.3868±0.2071 | 9 | 1 | 0.4626±0.2416 |
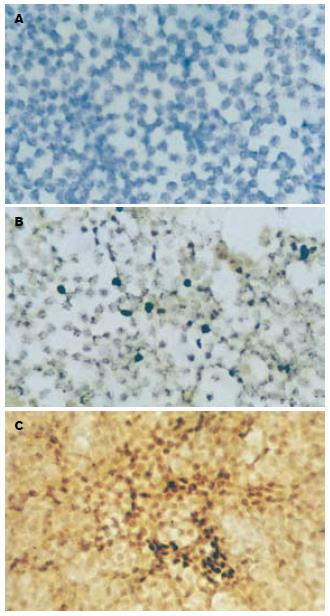
应用免疫组化法检测对照组和应激性溃疡患者外周血细胞中HSP70的表达. 结果显示, 在对照组的外周血细胞涂片中几乎无HSP70阳性细胞(图2A), 但是在应激性患者的外周血细胞涂片中均可观察到HSP70阳性细胞, 而且各期的着染程度不同, 图2C为2期患者检测结果, 可见大量的HSP70阳性细胞; 图2B为1期患者检测结果显示有HSP70阳性细胞, 但其表达不如2期多. 计算其阳性率结果见表1, 1期HSP70阳性率为40%(4/10), 2期为80%(8/10), 3期为30%(3/10), 对照组为10%(1/10). 4组间比较, χ2值为10.8383, P = 0.0127<0.05, 差别有统计学意义, 多个样本率两两比较后显示, 除1期与3期之间差别无显著性差异外, 其他各组之间均有显著性差异, 表明应激性溃疡患者外周血白细胞HSP70的表达水平在不同病期有所不同, 以2期表达水平最高, 对照组表达最低.
以GAPDH为内参照, 应用半定量RT-PCR检测30例应激性溃疡患者和10例对照者胃液脱落细胞HSP70 mRNA水平, 部分标本检测结果见图1. 每份标本均可观察到280 bp和450 bp两条电泳条带, 即HSP70和GAPDH的扩增条带, 表1为应激性溃疡患者组和对照组HSP70平均表达水平. 统计分析结果表明2期患者HSP70表达水平(1.2385±0.4558)明显高于1期(0.7741±0.2442)、3期(0.8790±0.2722)和对照组(0.4626±0.2416), 差别有统计学意义(P<0.05); 1期和3期患者HSP70表达水平也明显高于对照组, 差别有统计学意义(P<0.05); 而1期和3期患者HSP70表达水平无显著性差异(P>0.05). 胃液脱落细胞HSP70检测结果与血细胞HSP70检测结果相似, 即实验组2期HSP70的表达最强而对照组HSP70的表达水平最低.
HSP70系列是最重要的应激蛋白, 几乎在所有生物的应激细胞中均高水平表达. 诱导HSP70系列产生的因素包括热应激、化学物质(氧自由基、乙醇等)、缺血缺氧、感染及严重创伤等[8-12]. 有学者在应激状态下动物实验研究中检测到HSP70基因的转录产物, 表明应激性状态下HSP70的转录产物高于正常[13-16]. 应激状态下胃黏膜上皮细胞HSP70表达增加的可能机制是:在应激状态下胃黏膜细胞内蛋白质构型发生改变, 产生变性聚集的蛋白, 激发细胞的应激反应,激活热休克基因, 编码产生HSP70. 诱导合成的HSP70又能促进细胞内蛋白质的合成、折叠、装配、转位, 并促使细胞从应激中恢复, 从而减少了黏膜细胞的损伤, 保护胃黏膜. 这与国外文献报道HSP70家族介导胃黏膜细胞的保护机制一致[17-21]. 研究显示, 诱导性HSP70家族可以修复损伤的前核糖体、防止溶酶体破坏、稳定细胞膜, 从而维持细胞正常的形态和功能, 对抗有害因素. 诱导产生的HSP70可以产生多种保护作用, 如可以在大鼠肺脓毒性损伤中产生保护性作用, 而且可以降低肿瘤坏死因子诱导的肝细胞凋亡, 表达HSP70的转基因小鼠可以抵抗局部缺血和致死性热损伤等不良刺激[22-26]. 但这种保护作用可被抑制HSP70表达的蛋白质合成抑制剂所阻断, 如果向纤维母细胞注射微量抗HSP70抗体, 就可增加细胞对亚致死温度的易损性[27-30]. 由此可见HSP70的表达对多种脏器具有保护作用.
应激状态下胃黏膜充血、水肿、糜烂、溃疡形成、进而引起溃疡出血, 同时伴有胃黏膜上皮细胞的脱落, 本研究采用半定量RT-PCR检测应激性溃疡患者胃液中脱落细胞和外周血白细胞HSP70的表达, 应用计量资料的方差分析对不同病期患者HSP70基因扩增的光密度比值进行统计分析. 结果显示, 胃液脱落细胞和血液白细胞中HSP70在应激状态下的表达相似, 不同病期应激性溃疡患者胃液脱落细胞及血液白细胞HSP70的表达有所不同. 对照组HSP70的表达明显低于应激性溃疡组, 溃疡出血2期即溃疡最严重期HSP70的表达明显高于其他期, 但是1期和3期之间即溃疡出血早期和溃疡恢复阶段HSP70的表达无显著性差异, 表明应激性溃疡可诱导HSP70表达, 且其表达随着应激性溃疡的发展而变化. 即当机体处于应激状态时, HSP70开始表达, 随着应激强度的增加应激性溃疡出血加重, HSP70的表达达到了高峰, 其保护作用也在增强, 随着溃疡的好转, HSP70的表达则逐渐降低. 同时, 我们也对血液白细胞HSP70表达进行了免疫组化检测, 所得的结果与RT-PCR的结果相符. 进一步证实应激可以诱导溃疡产生并在导致溃疡出血的同时诱导HSP70的表达, 而且HSP70表达在促进应激性溃疡恢复方面具有非常重要的作用.
虽然在应激状态下胃黏膜的保护作用减弱, 不可避免的会有炎性反应的产生, 进而会有炎性细胞的聚积, 因此从胃液中提取的细胞不仅仅是胃黏膜上皮细胞, 还有部分炎性细胞, 但是结果显示炎性细胞并没有影响应激状态下胃黏膜上皮细胞HSP70的表达. 而且我们初步认为, 胃黏膜的炎性反应也可能作为一种应激原诱导胃黏膜上皮细胞HSP70的表达.
热休克蛋白是一组高度保守、与应激相关的蛋白, 在细胞正常发育和多种应激状态下对维持细胞的稳定性具有重要作用. 其中, HSP70在正常情况下表达很低或是不表达, 而在应激状态下表达明显增强.
近年来, 关于应激性溃疡与HSP70相互关系的研究多为检测血细胞中或干预后的动物胃黏膜上皮细胞中HSP70的表达, 并且证实应激可以诱导动物胃溃疡的形成同时可以诱导HSP70表达.
有报道表明, 在睡眠剥夺鼠胃黏膜与正常对照胃黏 膜不同表达的基因研究中发现, 总的 5 8 8 个基因中有10个不同的表达基因, 这些基因大多数是与消化有关, HSP70基因就是其中之一; HSP70家族是细胞面对热刺激和其他物理刺激时存活下来所必须的, 而且大量证据支持HSP70具有在致死性刺激时可以提高细胞存活力的作用.
本研究同时检测应激性溃疡患者外周血细胞以及胃液中脱落细胞(胃黏膜上皮细胞和炎性细胞等)HSP70的表达,证实应激可以诱导溃疡产生并在导致溃疡出血的同时诱导HSP70的表达, 而且HSP70表达在促进应激性溃疡恢复方面具有非常重要的作用.
热休克蛋白的细胞保护作用为应激性溃疡的治疗提供了新的模式. HSP在多种病理生理情况下对应激产生导致的胃 黏膜损伤有拮抗作用, 因此寻找安全有效的HSP70诱导剂可以通过诱导HSP70的表保护细胞对抗环境因素的刺激, 到治疗消化性溃疡和其他应激诱发的疾病的目的, 他也可能用于日常饮食中作为日常生活中抗应激辅助物.
本文观察了应激性溃疡出血不同阶段, 外周血液、胃液热休克蛋白 70表达的变化, 为应激性溃疡出血时热休克蛋白70 表达的变化研究提供了一些有价值的信息.
电编: 张敏 编辑:张焕兰
| 1. | Coskun T, Yegen BC, Alican I, Peker O, Kurtel H. Cold restraint stress-induced gastric mucosal dysfunction. Role of nitric oxide. Dig Dis Sci. 1996;41:956-963. [PubMed] |
| 2. | Ren J, Gao J, Ojeas H, Lightfoot SA, Kida M, Brewer K, Harty RF. Involvement of capsaicin-sensitive sensory neurons in stress-induced gastroduodenal mucosal injury in rats. Dig Dis Sci. 2000;45:830-836. [PubMed] |
| 3. | Liu GS, Huang YX, Li SW, Pan BR, Wang X, Sun DY, Wang QL. Experimental study on mechanism and protection of stress ulcer produced by explosive noise. World J Gastroenterol. 1998;4:519-523. [PubMed] |
| 4. | Ozdemirler Erata G, Kanbagli O, Durlanik O, Bulut T, Toker G, Uysal M. Induced oxidative stress and decreased expression of inducible heat shock protein 70 (ihsp 70) in patients with colorectal adenocarcinomas. Jpn J Clin Oncol. 2005;35:74-78. [PubMed] |
| 5. | Tomanek L, Sanford E. Heat-shock protein 70 (Hsp70) as a biochemical stress indicator: an experimental field test in two congeneric intertidal gastropods (genus: Tegula). Biol Bull. 2003;205:276-284. [PubMed] |
| 7. | Cogan TA, Domingue G, Lappin-Scott HM, Benson CE, Woodward MJ, Humphrey TJ. Growth of Salmonella enteritidis in artificially contaminated eggs: the effects of inoculum size and suspending media. Int J Food Microbiol. 2001;70:131-141. [PubMed] |
| 8. | Minowada G, Welch WJ. Clinical implications of the stress response. J Clin Invest. 1995;95:3-12. [PubMed] |
| 9. | Villar J, Edelson JD, Post M, Mullen JB, Slutsky AS. Induction of heat stress proteins is associated with decreased mortality in an animal model of acute lung injury. Am Rev Respir Dis. 1993;147:177-181. [PubMed] |
| 10. | Currie RW, Tanguay RM, Kingma JG Jr. Heat-shock response and limitation of tissue necrosis during occlusion/reperfusion in rabbit hearts. Circulation. 1993;87:963-971. [PubMed] |
| 11. | Stojadinovic A, Kiang J, Smallridge R, Galloway R, Shea-Donohue T. Induction of heat-shock protein 72 protects against ischemia/reperfusion in rat small intestine. Gastroenterology. 1995;109:505-515. [PubMed] |
| 12. | Stojadinovic A, Kiang J, Goldhill J, Matin D, Smallridge R, Galloway R, Shea-Donohue T. Induction of the heat shock response prevents tissue injury during acute inflammation of the rat ileum. Crit Care Med. 1997;25:309-317. [PubMed] |
| 13. | Shen XZ, Chow JF, Koo MW, Cho CH. Gene expres-sion profiles in gastric mucosa of sleep deprivation rats. World J Gastroenterol. 2000;6:754-758. [PubMed] |
| 14. | Guo JS, Chau JF, Shen XZ, Cho CH, Luk JM, Koo MW. Over-expression of inducible heat shock protein 70 in the gastric mucosa of partially sleep-deprived rats. Scand J Gastroenterol. 2004;39:510-515. [PubMed] |
| 15. | Wang XP, Liu GZ, Song AL, Chen RF, Li HY, Liu Y. Expression and significance of heat shock protein 70 and glucose-regulated protein 94 in human esophageal carcinoma. World J Gastroenterol. 2005;11:429-432. [PubMed] |
| 16. | Fiorenza MT, Bevilacqua A, Canterini S, Torcia S, Pontecorvi M, Mangia F. Early transcriptional activation of the hsp70.1 gene by osmotic stress in one-cell embryos of the mouse. Biol Reprod. 2004;70:1606-1613. [PubMed] |
| 17. | Kiang JG, Ding XZ, McClain DE. Overexpression of HSP-70 attenuates increases in [Ca2+]i and protects human epidermoid A-431 cells after chemical hypoxia. Toxicol Appl Pharmacol. 1998;149:185-194. [PubMed] |
| 18. | Samali A, Cotter TG. Heat shock proteins increase resistance to apoptosis. Exp Cell Res. 1996;223:163-170. [PubMed] |
| 19. | Ohkawara T, Takeda H, Nishiwaki M, Nishihira J, Asaka M. Protective effects of heat shock protein 70 induced by geranylgeranylacetone on oxidative injury in rat intestinal epithelial cells. Scand J Gastroenterol. 2006;41:312-317. [PubMed] |
| 20. | Watanabe D, Otaka M, Mikami K, Yoneyama K, Goto T, Miura K, Ohshima S, Lin JG, Shibuya T, Segawa D. Expression of a 72-kDa heat shock protein, and its cytoprotective function, in gastric mucosa in cirrhotic rats. J Gastroenterol. 2004;39:724-733. [PubMed] |
| 21. | Rafiee P, Shi Y, Pritchard KA Jr, Ogawa H, Eis AL, Komorowski RA, Fitzpatrick CM, Tweddell JS, Litwin SB, Mussatto K, Jaquiss RD, Baker JE. Cellular redistribution of inducible Hsp70 protein in the human and rabbit heart in response to the stress of chronic hypoxia: role of protein kinases. J Biol Chem. 2003;278:43636-43644. [PubMed] |
| 22. | Ribeiro SP, Villar J, Downey GP, Edelson JD, Slutsky AS. Sodium arsenite induces heat shock protein-72 kilodalton expression in the lungs and protects rats against sepsis. Crit Care Med. 1994;22:922-929. [PubMed] |
| 23. | Marber MS, Mestril R, Chi SH, Sayen MR, Yellon DM, Dillmann WH. Overexpression of the rat inducible 70-kD heat stress protein in a transgenic mouse increases the resistance of the heart to ischemic injury. J Clin Invest. 1995;95:1446-1456. [PubMed] |
| 24. | O'Connell-Rodwell CE, Shriver D, Simanovskii DM, McClure C, Cao YA, Zhang W, Bachmann MH, Beckham JT, Jansen ED, Palanker D. A genetic reporter of thermal stress defines physiologic zones over a defined temperature range. FASEB J. 2004;18:264-271. [PubMed] |
| 25. | Li G, Bae S, Zhang L. Effect of prenatal hypoxia on heat stress-mediated cardioprotection in adult rat heart. Am J Physiol Heart Circ Physiol. 2004;286:H1712-1719. [PubMed] |
| 26. | Kiang JG, Bowman PD, Wu BW, Hampton N, Kiang AG, Zhao B, Juang YT, Atkins JL, Tsokos GC. Geldanamycin treatment inhibits hemorrhage-induced increases in KLF6 and iNOS expression in unresuscitated mouse organs: role of inducible HSP70. J Appl Physiol. 2004;97:564-569. [PubMed] |
| 27. | Burkart V, Liu H, Bellmann K, Wissing D, Jaattela M, Cavallo MG, Pozzilli P, Briviba K, Kolb H. Natural resistance of human beta cells toward nitric oxide is mediated by heat shock protein 70. J Biol Chem. 2000;275:19521-19528. [PubMed] |
| 28. | Rokutan K. Role of heat shock proteins in gastric mucosal protection. J Gastroenterol Hepatol. 2000;15 Suppl:D12-19. [PubMed] |