修回日期: 2006-11-30
接受日期: 2006-12-31
在线出版日期: 2007-03-08
目的: 将已构建的重组腺病毒Ad-VEGF165进行扩增和纯化并观察其对人胃腺癌细胞(BGC-823)在体外生长及其受体表达的影响.
方法: 以人胚肾293细胞对重组腺病毒Ad-VEGF165和对照病毒Ad-GFP进行包装、扩增后感染BGC-823细胞, 应用MTT比色法分析VEGF165对该种细胞体外生长的影响, 并以免疫细胞化学方法检测该种细胞VEGFR-2的表达情况.
结果: 成功扩增及纯化了重组腺病毒Ad-VEGF165及对照病毒Ad-GFP, 获得约3.2×1013 pfu/L滴度的重组腺病毒和2.0×1013 pfu/L滴度的对照病毒. 当感染复数(MOI)为20时转导率即接近100%而无明显细胞中毒现象. MTT结果显示Ad-VEGF165组吸光度明显高于Ad-GFP组(24 h: 0.960±0.01 vs 0.737±0.01, P<0.01; 48 h: 1.321±0.03 vs 0.981±0.02, P<0.01; 72 h: 1.663±0.03 vs 1.207±0.01, P<0.01)及对照组(24 h: 0.960±0.01 vs 0.724±0.03, P<0.01; 48 h: 1.321±0.03 vs 0.968±0.01, P<0.01; 72 h: 1.663±0.03 vs 1.185±0.02, P<0.01). 另外, 在该细胞株上检测到了VEGFR-2的表达, 且在Ad-VEGF165组其表达明显高于Ad-GFP组(62.5% vs 37.6%, P<0.01)和对照组(62.5% vs 34.1%, P<0.01).
结论: VEGF对胃癌细胞有直接的促生长作用, 并可上调其主要受体VEGFR-2的表达水平, 从而进一步证实了VEGF对胃癌细胞的自分泌作用.
引文著录: 关云艳, 欧希龙, 孙为豪, 颜芳, 产松苗, 杨柳. 血管内皮生长因子165基因对人胃癌细胞在体外生长及其受体表达的影响. 世界华人消化杂志 2007; 15(7): 700-705
Revised: November 30, 2006
Accepted: December 31, 2006
Published online: March 8, 2007
AIM: To amplify and purify the recombinant adenovirus vector carrying vascular endothelial growth factor 165 (Ad-VEGF165), and to investi-gate its effect of on the expression of VEGF receptor-2 (VEGFR-2) and the proliferation of human gastric adenocarcinoma cell line BGC-823 in vitro.
METHODS: The adenoviruses were packaged and amplified in human embryonic kidney 293 cells. Then human gastric adenocarcinoma cell line BGC-823 was transfected with the resultant adenoviruses. The proliferation and expression of VEGFR-2 were measured by MTT assay and immunocytochemistry, respectively.
RESULTS: The recombinant adenovirus vector carrying VEGF165 or GFP (control virus) was amplified and purified successfully. The viral titer of VEGF165 or GFP was 3.2 × 1013 and 2.0 × 1013 pfu/L, respectively. The transfection rate almost reached 100% in BGC-823 cells when the multiplicity of infection (MOI) was 20. The proliferation of BGC-823 cells (shown by absorbency) transfected with Ad-VEGF165 was significantly higher than that of the cells transfected with Ad-GFP (24 h: 0.960 ± 0.01 vs 0.737 ± 0.01, P < 0.01; 48 h: 1.321 ± 0.03 vs 0.981 ± 0.02, P < 0.01; 72 h: 1.663 ± 0.03 vs 1.207 ± 0.01, P < 0.01) or the controlled cells (24 h: 0.960 ± 0.01 vs 0.724 ± 0.03, P < 0.01; 48 h: 1.321 ± 0.03 vs 0.968 ± 0.01, P < 0.01; 72 h: 1.663 ± 0.03 vs 1.185 ± 0.02, P < 0.01). Moreover, the expression of VEGFR-2 was expressed was markedly higher in BGC-823 cells transfected with Ad-VEGF165 than that in Ad-GFP-transfected cells (62.5% vs 37.6%, P < 0.01) and the controlled cells (62.5% vs 34.1%, P < 0.01).
CONCLUSION: VEGF can promote the proliferation and increase VEGFR-2 expression of BGC-823 cells in vitro.
- Citation: Guan YY, Ou XL, Sun WH, Yan F, Chan SM, Yang L. Effect of vascular endothelial growth factor gene on its receptor-2 expression and proliferation of human gastric carcinoma cell in vitro. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 700-705
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/700.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.700
目前已知肿瘤的生长依赖于血管的形成, 而新生血管的形成是由于促血管生成因子增多所致, 在这些因素中血管内皮生长因子(VEGF)作用最强, 并且研究最多[1-3]. 但以往认为VEGF对肿瘤的促生长作用是通过VEGF与血管内皮细胞上的受体结合, 促进其增殖、迁移并增加血管通透性而实现的. 而近年来发现在很多种肿瘤细胞上存在有VEGF受体, 因而可介导VEGF对肿瘤细胞的自分泌作用, 促进其增殖. 因此, 我们利用复制缺陷型腺病毒作载体将VEGF165基因导入体外培养的胃癌细胞株BGC-823, 以观察其对胃癌细胞体外生长的影响, 以及对VEGF主要受体VEGFR-2表达的影响.
人胃腺癌细胞株BGC-823购自于中科院; 293细胞购自Microbix Biosystems公司;复制缺陷型腺病毒重组体及对照病毒由南京医科大学第一附属医院构建[4]并赠送. PacⅠ, LipofectAmine 2000试剂盒分别购自NEB公司和Gibco公司, 氯化铯(CsCl)为Sigma公司生产, 透析袋购自Spectrum公司. VEGFR-2一抗和免疫组化试剂盒均购自武汉博士德公司. 293细胞和BGC-823细胞都以100 mL/L胎牛血清、100 kU/L青霉素及0.1 g/L链霉素的RPMI1640为培养液在37℃、50 mL/L CO2孵箱中进行常规培养, 以2.5 g/L胰蛋白酶消化后进行传代.
1.2.1 Ad-VEGF165的包装、扩增及纯化: 取对数生长期的293细胞, 以细胞密度为5×108个/L的细胞悬液10 mL接种于100 mm直径的培养皿中, 当细胞70%贴壁时, 吸去原培养液, 改无血清无抗生素的RPMI1640培养, 将以PacⅠ酶切回收的线性化的Ad-VEGF165 1 μg通过Lipofectamine2000共转染至293细胞. 观察出现细胞病理反应(CPE)后收取细胞上清, 再以首次感染的病毒上清液转染更多的293细胞, 在37℃, 50 mL/L CO2孵箱中培养3 d后再收集293细胞, 将其于-80℃至37℃反复冻融3次, 收集细胞裂解液, 最后以氯化铯梯度超速离心进行纯化.
1.2.2 Ad-VEGF165滴度的测定: 采用组织培养半数感染剂量法(TCID50)测定Ad-VEGF165的滴度. 以1×104个/孔接种293细胞于96孔板, 待细胞密度约90%后, 倍比稀释病毒上清、分别以不同稀释浓度100 μL病毒溶液转染细胞, 以20 mL/L胎牛血清的培养基培养10 d后倒置显微镜下观察, 计算每一排中出现CPE的孔数, 根据Karbers公式计算病毒滴度. 同样方法对对照病毒Ad-GFP进行包装、扩增、纯化及滴度测定.
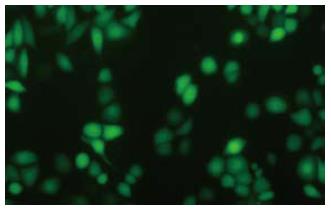
1.2.3 腺病毒体外转导效率的测定: BGC-823细胞以1×104个/孔接种于96孔板培养至60%-70%细胞贴壁时, 加入不同感染复数(MOI = 10, 20, 30, 50, 100)的Ad-GFP稀释液100 μL感染细胞, 8 h后换含100 mL/L胎牛血清的RPMI1640培养液继续培养, 48 h后在荧光显微镜下计数, 计算表达GFP的细胞数占视野中所有细胞的百分数, 取均值代表转导效率.
1.2.4 MTT法测定VEGF165的转导对BGC-823细胞增殖的影响: 实验分空白对照组(A组)、对照组(B组)、Ad-GFP(C组)、Ad-VEGF165(D组)共四组, 每组设三个复孔. 取对数生长期的BGC-823细胞, 以1×104个/孔接种细胞于96孔培养板中的B, C, D组, A组只加培养液. 于60%-70%细胞贴壁时对C, D两组予相应的无血清无抗生素培养液稀释的病毒液100 μL感染(37℃; MOI: 20), 感染8 h后换RPMI1640全培养液继续培养. 以感染当天为第0天, 分别于感染后第1-3天测定每孔吸光度(A值), 以空白对照孔的A值调零.
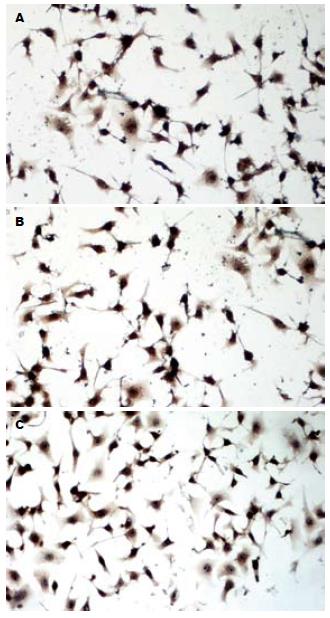
1.2.5 应用免疫细胞化学方法检测VEGFR-2在BGC-823细胞中的表达: 取对数生长期的BGC-823细胞, 消化后计数并调整培养液用量, 使细胞悬液终浓度为1.0×108/L, 接种至底部有小玻片的6孔板中, 每孔2 mL细胞悬液, 置孵育箱中培养. 次日, 细胞在小玻片上贴壁生长约70%融合, 分别于两孔中加入Ad-GFP、两孔中加入Ad-VEGF165(MOI: 20)的无血清无抗生素培养液稀释的病毒液1 mL感染(37℃; MOI: 20), 感染8 h后换RPMI1640全培养液继续培养. 两孔中不加病毒作为对照组. 再于36 h后取出小玻片用丙酮固定. PBS缓冲液冲洗, 3%双氧水灭活内源性过氧化酶, 微波抗原热修复后正常山羊血清封闭, 一抗冰箱过夜, 生物素标记的兔抗二抗工作液、辣根酶标记链酶卵白素工作液各30 min, DAB显色, 复染核、脱水、透明, 中性树胶封片. 用磷酸盐缓冲液(PBS)代替一抗作阴性对照, 已知阳性片作阳性对照. 胞质或胞膜见棕黄色颗粒为阳性. 在200倍显微镜下随机取5个视野细胞计数, 细胞阳性表达率 = 阳性细胞数/总细胞数×100%.
统计学处理 实验结果以均数±标准差表示, 均数间比较采用t检验. 两个率之间的比较应用χ2检验, 所有数据均采用SAS8.1统计软件进行分析, P<0.05表示有显著差异.
Ad-GFP的滴度为2.0×1013 pfu/L, Ad-VEGF165 cDNA的滴度为3.2×1013 pfu/L.
随着MOI值的加大, 腺病毒重组体对BGC-823细胞的感染效率逐渐增加, 当MOI为20时, 其转导效率接近100%而无明显细胞中毒现象(图1). 当MOI为50时, 其转导效率虽为100%, 但细胞很快就变圆、脱落.
Ad-GFP组和对照组比较: 24 h(t = 2.13, P = 0.1233), 48 h(t = 1.08, P = 0.3878), 72 h(t = 1.43, P = 0.2267); Ad-VEGF165组和对照组比较: 24 h(t = 15.26, P<0.01), 48 h(t = 23.48, P<0.01), 72 h(t = 23.23, P<0.01); Ad-VEGF165组和Ad-GFP组比较: 24 h(t = 24.98, P<0.01), 48 h(t = 12.86, P<0.01), 72 h(t = 25.16, P<0.01). 结果说明VEGF165能够促进BGC-823细胞的增殖. GFP对BGC-823细胞的增殖没有影响(表1).
| 分组 | A值 | ||
| 24 h | 48 h | 72 h | |
| 对照 | 0.724±0.03 | 0.968±0.01 | 1.185±0.02 |
| Ad-GFP | 0.737±0.01 | 0.981±0.02 | 1.207±0.01 |
| Ad-VEGF165 | 0.960±0.01 | 1.321±0.03 | 1.663±0.03 |
BGC-823细胞中有VEGFR-2的阳性表达, 且在Ad-VEGF165组的阳性表达率明显高于对照组和Ad-GFP组(图2). 对照组、Ad-GFP组及Ad-VEGF165组三组阳性率分别为34.1%, 37.6%和62.5%. Ad-GFP组和对照组比较: χ2 =1.048, P = 0.306; Ad-VEGF165组和Ad-GFP组比较: χ2 = 12.83, P<0.01; Ad-VEGF165组和对照组比较: χ2 = 22.29, P<0.01.
血管内皮生长因子(VEGF)基因的发现至今已有十余年, 随着对其研究的深入, 仍不断有新的认识. 目前认为, 在所有的已知实体肿瘤中均有VEGF的表达上调[5-6], VEGF表达水平与肿瘤大小、浸润程度、转移及预后密切相关[7-11]. 根据mRNA剪接方式不同, VEGF可形成多个变构体, 包括VEGF121, VEGF145, VEGF165, VEGF183, VEGF189, VEGF206. 而VEGF165无论是在数量上还是在功能上都占有主导地位, 因此广泛用于临床和实验中[12-13]. 同样, 我们也选择VEGF165 cDNA作为目的基因. VEGF第一外显子编码分泌肽序列, 能使VEGF蛋白从细胞中分泌出去, 再与受体结合而发挥生物学效应. 很多以病毒为载体研究显示, VEGF165转导入细胞后用酶联免疫吸附法检测培养液上清中的VEGF165的水平, 于48 h后达峰值, 并可持续2 wk左右[14-15]. 现已发现的VEGF受体有VEGFR-1(Flt-1), VEGFR-2(Flk-1/KDR), VEGFR-3(Flt-4), neuropilin-1(NRP-1)和neuropilin-2(NRP-2), 但在细胞的生长和分化中起重要作用的是VEGFR-2. VEGF与血管内皮细胞上的该受体结合后促使其发生磷酸化继之引起级联反应, 刺激内皮细胞增殖、迁移并增加血管通透性[16-17], 从而促进血管的构建和生长, Weisz et al[18]实验证实VEGF也可增加内皮细胞和平滑肌细胞中VEGFR-2的表达. 随着对该基因研究的深入, 又有研究证实在肺癌[19]、结肠癌[20]、前列腺癌[21]、胰腺癌[22]、膀胱癌[23]等多种实体肿瘤细胞上也有经典受体VEGFR-1或VEGFR-2的表达. 随后Bachelder et al[24]和Li et al[25]分别在不表达经典受体的乳腺癌和胰腺癌的肿瘤细胞上检测到NRP-1受体, 并认为肿瘤细胞也可通过该受体使VEGF对肿瘤细胞起到自分泌的作用, 促进其增殖、存活及侵袭转移能力. Tian et al[26]利用RT-PCR检测到胃腺癌MGC-803细胞株同时有VEGF和VEGFR-2 mRNA的表达, 且外源性VEGF165能直接刺激该种细胞的增殖. Ren et al[27]应用原位杂交技术证实在人胃癌SGC7901细胞中有VEGFR-2 mRNA的高表达, 并且VEGFR-2的反义寡脱氧核苷酸明显抑制了该受体的表达. 后来, Zhang et al[28]又检测了8种胃癌细胞株上受体表达情况, 其中6种同时有VEGFR-1和VEGFR-2 mRNA的表达, 一种只有VEGFR-1的表达, 但KATOⅢ细胞株上均无两者表达, 且在细胞增殖实验中, KATOⅢ细胞对VEGF165的刺激没有反应. 由此可见, 由于不同种类的肿瘤细胞表达受体的情况不同, 因而对VEGF的反应性也就不同. 为此, 我们利用复制缺陷型腺病毒作为载体将VEGF165基因导入BGC-823细胞, 检测VEGF对其生长的影响.
本实验之所以采用复制缺陷型腺病毒作为载体, 是因为复制缺陷型腺病毒载体可广泛感染宿主细胞, 但所携带的基因不会整合入宿主细胞的基因组中, 因而具有高转导率和安全性高的优点[29-30]. Tan et al[31]应用不同种类载体介导VEGF165转导内皮细胞时, 发现腺病毒载体转导效率高于其他病毒及非病毒载体, 但不足之处是其也能表达少量的腺病毒结构蛋白, 可能会对细胞产生一定的毒性. 我们的实验中, 当MOI值为50时即可见细胞变圆、脱落. MOI为20时, 转导效率接近100%而未见细胞中毒现象, 故本实验的病毒感染强度设为MOI = 20. 在实验中我们以绿色荧光蛋白(GFP)做平行对照, 因为GFP是目前唯一能在活细胞中表达的发光蛋白, 其基因序列很短, 易于构建质粒, 具有敏感的标记检测率, 而没有放射性的危害[32], 我们的结果显示GFP对BGC-823细胞的增殖没有影响, 也进一步证实GFP是在基因转染实验中较理想的平行对照基因.
本实验成功制备了高滴度的Ad-GFP和Ad-VEGF165 cDNA, 并对胃癌细胞有较高的转导效率. MTT结果显示转染Ad-VEGF165组细胞吸光度明显高于未转染组及空载体转染组. 而未转染组及空载体转染组之间比较无明显差异, 说明VEGF165能够促进体外培养的BGC-823细胞的生长. 另外, 我们应用免疫细胞化学方法在该种细胞株上也检测到了VEGFR-2的阳性表达, 且转染组阳性细胞表达率高于对照组和GFP组, 说明VEGF水平的增多可上调其受体的表达. 这些结果进一步证实了VEGF基因对肿瘤生长和转移的促进作用除了通过血管机制以外, 对肿瘤细胞也有直接的促生长作用.
恶性肿瘤严重地威胁着人类健康和生命, 他在体内的生长依赖于血管的形成, 而血管内皮生长因子(VEGF)在迄今所发现的促血管生成因子中作用是最强的, 故针对这方面的治疗已成为治疗肿瘤的的另一希望. 该基因虽已发现多年, 但并未对其完全认识, 近年认为 VEGF的促肿瘤生长作用除了通过促血管生成作用外对某些肿瘤细胞也有直接的促增殖作用, 但研究显示不同的肿瘤细胞VEGF受体种类及表达程度不同. 为此, 本文研究了人血管内皮生长因子对胃癌细胞BGC-823在体外生长的影响及对其受体表达的影响
近年来在多种肿瘤细胞上发现有VEGF受体的表达, 证实了VEGF的自分泌作用,说明如果阻断VEGF, 不仅抑制了肿瘤的血管形成, 同时也对肿瘤细胞生长有直接的抑制作用. 但并不是所有的肿瘤细胞上均有受体存在, 因而细胞有无受体表达也可作为估计抗VEGF制剂的疗效的一个预测性指标之一
实验通过对腺病毒重组体的扩增和纯化后, 将 VEGF导入胃腺癌细胞株, 不仅检测了细胞的增殖情况也检测了对受体表达的影响, 具有一定新意
本研究证实了VEG F对胃腺癌 BGC-823细胞株的体外促增殖作用, 并证实VEGF又可上调细胞VEGFR-2的表达,从而阐释了VEGF促进肿瘤生长的多种途径, 进一步为临床应用抗 VEGF制剂治疗恶性肿瘤提供了理论依据.
血管内皮细胞生长因子(VEGF)基因: 该基因位于染色体的6p21.3, 由8个外显子和7个内含子构成. 编码34-45 kDa的同源二聚体蛋白, 两亚基通过二硫键相连. 由于mRNA的剪接不同可产生5 种变构体, VEGF165无论是在数量上还是在功能上都占有主导地位, 因此广泛用于临床和实验中.
本文研究了重组腺病毒Ad-VEGF165对人胃腺癌细胞(BGC-823)在体外生长及其受体表达的影响, 发现VEGF对胃癌细胞有直接的促生长作用, 并可上调其主要受体VEGFR-2的表达水平, 证实了 VEGF对胃癌细胞的自分泌作用. 本实验属于基础研究, 有一定的深度和较好的学术价值, 对胃癌细胞的生长、增殖、迁移机制的探讨具有重要意义.
电编: 张敏 编辑:张焕兰
| 1. | McNeish IA, Bell SJ, Lemoine NR. Gene therapy progress and prospects: cancer gene therapy using tumour suppressor genes. Gene Ther. 2004;11:497-503. [PubMed] |
| 2. | Dvorak HF. Vascular permeability factor/vascular endothelial growth factor: a critical cytokine in tumor angiogenesis and a potential target for diagnosis and therapy. J Clin Oncol. 2002;20:4368-4380. [PubMed] |
| 3. | Ichikura T, Tomimatsu S, Ohkura E, Mochizuki H. Prognostic significance of the expression of vascular endothelial growth factor (VEGF) and VEGF-C in gastric carcinoma. J Surg Oncol. 2001;78:132-137. [PubMed] |
| 4. | 周 磊, 张 馥敏, 杨 志健, 陆 丽, 丁 兆丰, 丁 必森, 哈 团柱, 李 传富, 高 翔, 马 文珠. 人血管生成素-1和血管内皮生长因子165基因克隆及复制缺陷型腺病毒载体构建. 中华心血管病杂志. 2003;31:699. |
| 5. | Glass CA, Harper SJ, Bates DO. The anti-angiogenic VEGF isoform VEGF165b transiently increases hydraulic conductivity, probably through VEGF receptor 1 in vivo. J Physiol. 2006;572:243-257. [PubMed] |
| 6. | Byrne AM, Bouchier-Hayes DJ, Harmey JH. Angiogenic and cell survival functions of vascular endothelial growth factor (VEGF). J Cell Mol Med. 2005;9:777-794. [PubMed] |
| 7. | Poon RT, Fan ST, Wong J. Clinical significance of angiogenesis in gastrointestinal cancers: a target for novel prognostic and therapeutic approaches. Ann Surg. 2003;238:9-28. [PubMed] |
| 8. | Harmey JH, Bouchier-Hayes D. Vascular endothelial growth factor (VEGF), a survival factor for tumour cells: implications for anti-angiogenic therapy. Bioessays. 2002;24:280-283. [PubMed] |
| 9. | Kakeji Y, Koga T, Sumiyoshi Y, Shibahara K, Oda S, Maehara Y, Sugimachi K. Clinical significance of vascular endothelial growth factor expression in gastric cancer. J Exp Clin Cancer Res. 2002;21:125-129. [PubMed] |
| 10. | Baker EA, Bergin FG, Leaper DJ. Plasminogen activator system, vascular endothelial growth factor, and colorectal cancer progression. Mol Pathol. 2000;53:307-312. [PubMed] |
| 11. | Kakeji Y, Maehara Y, Sumiyoshi Y, Oda S, Emi Y. Angiogenesis as a target for gastric cancer. Surgery. 2002;131:S48-54. [PubMed] |
| 12. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [PubMed] |
| 13. | Partovian C, Adnot S, Raffestin B, Louzier V, Levame M, Mavier IM, Lemarchand P, Eddahibi S. Adenovirus-mediated lung vascular endothelial growth factor overexpression protects against hypoxic pulmonary hypertension in rats. Am J Respir Cell Mol Biol. 2000;23:762-771. [PubMed] |
| 14. | Maeda Y, Ikeda U, Shimpo M, Shibuya M, Monahan J, Urabe M, Ozawa K, Shimada K. Adeno-associated virus-mediated vascular endothelial growth factor gene transfer into cardiac myocytes. J Cardiovasc Pharmacol. 2000;36:438-443. [PubMed] |
| 15. | Giunta RE, Holzbach T, Taskov C, Holm PS, Konerding MA, Schams D, Biemer E, Gansbacher B. AdVEGF165 gene transfer increases survival in overdimensioned skin flaps. J Gene Med. 2005;7:297-306. [PubMed] |
| 16. | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003;9:669-676. [PubMed] |
| 17. | Gupta MK, Qin RY. Mechanism and its regulation of tumor-induced angiogenesis. World J Gastroenterol. 2003;9:1144-1155. [PubMed] |
| 18. | Weisz A, Koren B, Cohen T, Neufeld G, Kleinberger T, Lewis BS, Flugelman MY. Increased vascular endothelial growth factor 165 binding to kinase insert domain-containing receptor after infection of human endothelial cells by recombinant adenovirus encoding the Vegf(165) gene. Circulation. 2001;103:1887-1892. [PubMed] |
| 19. | Zhang G, Zhao M, Xu M, Yang Y, Wang M, Yang C. Correlation of angiogenesis with expression of vascular endothelial growth factor and its receptors in lung carcinoma. Zhonghua Jie He He Hu Xi Za Zhi. 2002;25:89-93. [PubMed] |
| 20. | Fan F, Wey JS, McCarty MF, Belcheva A, Liu W, Bauer TW, Somcio RJ, Wu Y, Hooper A, Hicklin DJ. Expression and function of vascular endothelial growth factor receptor-1 on human colorectal cancer cells. Oncogene. 2005;24:2647-2653. [PubMed] |
| 21. | Jackson MW, Roberts JS, Heckford SE, Ricciardelli C, Stahl J, Choong C, Horsfall DJ, Tilley WD. A potential autocrine role for vascular endothelial growth factor in prostate cancer. Cancer Res. 2002;62:854-859. [PubMed] |
| 22. | Wey JS, Fan F, Gray MJ, Bauer TW, McCarty MF, Somcio R, Liu W, Evans DB, Wu Y, Hicklin DJ. Vascular endothelial growth factor receptor-1 promotes migration and invasion in pancreatic carcinoma cell lines. Cancer. 2005;104:427-438. [PubMed] |
| 23. | Wu W, Shu X, Hovsepyan H, Mosteller RD, Broek D. VEGF receptor expression and signaling in human bladder tumors. Oncogene. 2003;22:3361-3370. [PubMed] |
| 24. | Bachelder RE, Crago A, Chung J, Wendt MA, Shaw LM, Robinson G, Mercurio AM. Vascular endothelial growth factor is an autocrine survival factor for neuropilin-expressing breast carcinoma cells. Cancer Res. 2001;61:5736-5740. [PubMed] |
| 25. | Li M, Yang H, Chai H, Fisher WE, Wang X, Brunicardi FC, Yao Q, Chen C. Pancreatic carcinoma cells express neuropilins and vascular endothelial growth factor, but not vascular endothelial growth factor receptors. Cancer. 2004;101:2341-2350. [PubMed] |
| 26. | Tian X, Song S, Wu J, Meng L, Dong Z, Shou C. Vascular endothelial growth factor: acting as an autocrine growth factor for human gastric adenocarcinoma cell MGC803. Biochem Biophys Res Commun. 2001;286:505-512. [PubMed] |
| 27. | Ren J, Dong L, Xu CB, Pan BR. The role of KDR in the interactions between human gastric carcinoma cell and vascular endothelial cell. World J Gastroenterol. 2002;8:596-601. [PubMed] |
| 28. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [PubMed] |
| 29. | Vorburger SA, Hunt KK. Adenoviral gene therapy. Oncologist. 2002;7:46-59. [PubMed] |
| 30. | Zhang C, Liu ZK. Gene therapy for gastric cancer: a review. World J Gastroenterol. 2003;9:2390-2394. [PubMed] |
| 31. | Tan PH, Xue SA, Manunta M, Beutelspacher SC, Fazekasova H, Alam AK, McClure MO, George AJ. Effect of vectors on human endothelial cell signal transduction: implications for cardiovascular gene therapy. Arterioscler Thromb Vasc Biol. 2006;26:462-467. [PubMed] |