修回日期: 2006-11-01
接受日期: 2006-11-21
在线出版日期: 2007-02-28
目的: 探讨大肠癌组织中埃兹蛋白(Ezrin), 黏着斑激酶(FAK)及上皮细胞钙黏蛋白(E-cadherin)的表达及其与肿瘤侵袭和转移的关系.
方法: 大肠癌组织标本50例, 其中高分化腺癌13例, 中低分化腺癌37例; 无淋巴结转移30例, 淋巴结转移20例. 采用免疫组织化学方法检测50例大肠癌组织中Ezrin, FAK及E-cadherin的蛋白表达, 并运用统计学方法分析Ezrin, FAK及E-cadherin的表达与大肠癌各种临床病理特征的关系及三者的相关性.
结果: Ezrin在中低分化、伴有淋巴结转移及Dukes C+D期大肠癌的阳性表达率显著高于高分化、无淋巴结转移及Dukes A+B期大肠癌(83.78% vs 46.15%, P<0.01; 95.00% vs 60.00%, P<0.01; 95.00% vs 60.00%, P<0.01), 而E-cadherin在以上组织中的表达正好相反(24.32% vs 69.23%, P<0.01; 10.00% vs 53.33%, P<0.01; 10.00% vs 53.33%, P<0.01), 其均与患者性别及年龄大小均无关(P>0.05). FAK在Dukes C+D期、伴有淋巴结转移大肠癌组织中的阳性表达显著高于Dukes A+B、无淋巴转移组织(100.00% vs 63.33%, P<0.01; 100.00% vs 63.33%, P<0.01),而与肿瘤的分化程度、患者性别及年龄大小均无关(P>0.05). 经Spearman相关分析, Ezrin与FAK在大肠癌组织中的表达呈正相关(r = 0.346, P<0.05), E-cadherin与Ezrin、FAK在大肠癌组织中的表达均呈明显负相关(r = -0.410, P<0.01; r = -0.406, P<0.01).
结论: Ezrin, FAK及E-cadherin在大肠癌组织中的异常表达与肿瘤组织的浸润和转移密切相关, 联合检测可以作为一组有效的大肠癌肿瘤标记和预后指标.
引文著录: 王红建, 史成章, 秦先锋, 黄秋实. Ezrin、FAK及E-cadherin在大肠癌组织中的表达及其临床意义. 世界华人消化杂志 2007; 15(6): 591-595
Revised: November 1, 2006
Accepted: November 21, 2006
Published online: February 28, 2007
AIM: To investigate the expression of ezrin, focal adhesion kinase (FAK) and E-cadherin (E-cad) as well as their correlations with the invasion and metastasis of colorectal carcinoma.
METHODS: Immunohistochemistry was used to detect the expression of ezrin, FAK and E-cad in 50 cases of colorectal carcinoma (including 13 well-differentiated adencarcinomas, 37 moderately- or poorly-differentiated adenocarcinomas; 30 cases without lymph node metastasis and 20 with lymph node metastasis). The correlations among Ezrin, FAK and E-cadherin expression as well as the clinical and pathological characteristics were analyzed by statistical method.
RESULTS: The expression of ezrin was significantly higher in colorectal carcinomas with moderate or poor differention, lymph node metastasis and Dukes C+D stages than that in the ones with high differention, non-metastasis, and Dukes A+B stages (83.78% vs 46.15%, P < 0.01; 95.00% vs 60.00%, P < 0.01; 95.00% vs 60.00%, P < 0.01), but E-cad expression was in the contrary situation (24.32% vs 69.23%, P < 0.01; 10.00% vs 53.33%, P < 0.01; 10.00% vs 53.33%, P < 0.01). The expression of ezrin and E-cad had no marked correlations with the age and sex of patients (P > 0.05). FAK expression was markedly higher in colorectal carcinomas with Dukes C+D stages and lymph node metastasis than that in the ones with Dukes A+B stages and without metastasis (100.00% vs 63.33%, P < 0.01; 100.00% vs 63.33%, P < 0.01), but it had no significant correlation with the differetion degree of tumors, the sex and ages of patients (P > 0.05). Spearman analysis showed that there existed positive correlation between Ezrin and FAK expression (r = 0.346, P < 0.05), and negative correlation between E-cadherin and Ezrin (r = -0.410, P < 0.01) as well as E-cadherin and FAK expression (r = -0.406, P < 0.01).
CONCLUSION: The abnormal expression of ezrin, FAK and E-cad are closely correlated with the infiltration and metastasis of colorectal carcinoma, and the combined detection can be used to judge the prognosis of patients with colorectal carcinoma.
- Citation: Wang HJ, Shi CZ, Qin XF, Huang QS. Expression of ezrin, E-cadherin and focal adhesion kinase in colorectal carcinoma and their clinical significances. Shijie Huaren Xiaohua Zazhi 2007; 15(6): 591-595
- URL: https://www.wjgnet.com/1009-3079/full/v15/i6/591.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i6.591
埃兹蛋白(Ezrin)是ERM(ezrin-radixin-moesin)蛋白家族的成员之一, 其功能为连接细胞表面受体尤其是黏附分子和肌动蛋白细胞骨架. 主要集中表达于细胞表面的顶端, 参与上皮细胞极性的维持. 最近研究发现, Ezrin通过调节黏附分子和信号转导途径, 参与细胞与细胞、细胞与基质之间的相互作用, 可能在肿瘤细胞的侵袭和转移过程中起重要作用[1-2]. 黏着斑激酶(FAK)是一种重要的非受体蛋白酪氨酸激酶[3], 近年来研究表明, FAK的表达上调对肿瘤的增殖、生存、迁移、侵袭、转移和血管形成等行为起着重要的调控作用[4-7]. E-钙黏附蛋白(E-cadherin)是钙依赖性细胞间连接的黏附分子, 主要介导同种细胞间的黏附反应, 是维护上皮细胞形态和结构的完整性和极性的重要分子[8], 并起细胞骨架作用, 当E-cadherin表达失活时可导致细胞间黏附能力下降, 极性紊乱, 促进肿瘤的转移. 我们通过检测大肠癌标本中Ezrin, E-cadherin, FAK的表达, 探讨他们的表达水平与各临床病理指标间的关系以及他们之间的相关性, 判断他们在大肠癌发生、浸润、转移中的作用, 为临床预测预后, 选择合适的辅助治疗措施提供依据.
50例大肠癌标本均选自郑州大学第一附属医院2003-01/2004-12手术切除后经病理诊断明确的存档蜡块. 患者年龄31-80(中位55.5)岁. 男28例, 女22例. 结肠癌30例, 直肠癌20例. 组织学类型: 高分化腺癌13例, 中分化腺癌20例, 低分化腺癌17例; Dukes分期: A期17例, B期13例, C+D期20例; 伴淋巴结转移20例. 鼠抗人Ezrin mAb购自福建迈新生物技术开发有限公司, 鼠抗人FAK mAb购自美国Santa Cruz公司, 鼠抗人上皮性钙黏附蛋白mAb工作液、SP试剂盒、DAB显色剂购自北京中杉金桥生物技术有限公司. 实验步骤按试剂盒说明书进行. 阴性对照采用0.01 mmol/L磷酸盐修复液(PBS)代替一抗, 阳性对照为正常结直肠黏膜阳性切片.
采用免疫组织化学SP法进行染色, 操作过程参照试剂盒说明书. 结果判断: Ezrin阳性着色按染色强度和阳性表达数, 参考Mathew et al[9]分级标准: 0分, 无表达; 1分, <50%细胞阳性表达或染色较浅; 2分, ≥50%阳性. 0-1分记为阴性, 2分记为阳性. E-cadherin根据阳性细胞所占的百分率参照Gonzalez et al[10]分级标准: 0分, 无着色; 1分, 阳性细胞率<75%; 2分, 阳性细胞率≥75%. 0-1分记为阴性, 2分记为阳性. FAK染色结果判定从光镜下分析A: 按切片中细胞染色深浅记分: 0分: 细胞无显色; 1分: 显色为浅黄; 2分: 显色为棕黄; 3分: 显色为棕褐色. B: 按切片中显色细胞的比例评分: 1分: 显色细胞占切片中癌细胞总数的20%以下; 2分: 21%-70%癌细胞显色; 3分: 71%以上癌细胞显色. 每例肿瘤积分 = A×B. 按积分高低分为阴性: 积分为0分-4分; 阳性: 积分大于4分.
统计学处理 采用SPSS10.0软件包进行统计学分析. Ezrin, FAK, E-cadherin与大肠癌临床病理因素之间的分析采用行×列表的χ2检验. Ezrin, FAK, E-cadherin之间相关性检验采用Spearman相关分析. 以α = 0.05作为检验水准.
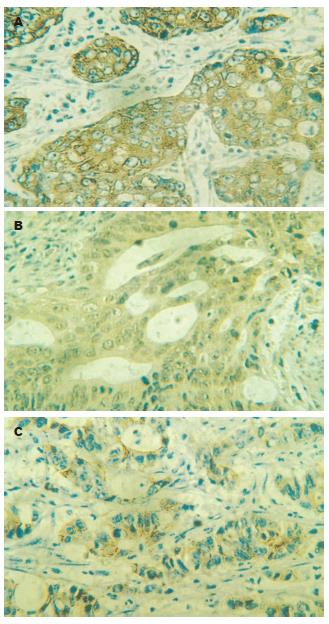
Ezrin的表达与大肠癌的分化程度、淋巴结转移和Dukes分期均密切相关(P<0.01, 表1)而与患者性别及年龄大小均无关(P>0.05, 图1A). 其中随着大肠癌Dukes分期的增加Ezrin在大肠癌组织中的表达增加, 且Dukes C+D期阳性率明显高于Dukes A+B期, 两组间比较有显著性差异(P<0.01, 表1), FAK的表达与大肠癌的淋巴结转移和Dukes分期均密切相关(P<0.01, 表1). 而与肿瘤的分化程度、患者性别及年龄大小无关(P>0.05, 图1B). 淋巴结转移及DukesC+D期肿瘤组织中FAK明显高度表达. 其中Dukes C+D期阳性率明显高于Dukes A+B期, 两组间比较有显著性差异(P<0.01, 表1). E-cadherin的阳性表达与大肠癌的分化程度、淋巴结转移和Dukes分期等因素均呈明显的负相关(P<0.01, 表1)而与患者性别及年龄大小均无关(P>0.05, 图1C). 在中低分化, 淋巴结转移及Dukes C+D期的大肠癌组织中E-cadherin的表达明显降低.其中Dukes C+D期肿瘤组织中E-cadherin的阳性率明显低于Dukes A+B期, 两组间比较有显著性差异(P<0.01, 表1).
| 病理因素 | n | Ezrin | FAK | E-cadherin |
| 性别 | ||||
| 男 | 28 | 23(82.14) | 24(85.71) | 8(28.57) |
| 女 | 22 | 14(63.63) | 15(68.18) | 10(45.45) |
| 年龄(岁) | ||||
| <50 | 19 | 12(63.16) | 13(68.42) | 6(31.58) |
| ≥50 | 31 | 25(80.64) | 26(83.87) | 12(38.71) |
| 分化程度 | ||||
| 高分化 | 13 | 6(46.15)b | 8(61.54) | 9(69.23)b |
| 中低分化 | 37 | 31(83.78) | 31(83.78) | 9(24.32) |
| 淋巴结转移 | ||||
| 有 | 20 | 19(95.00)b | 20(100.00)b | 2(10.00)b |
| 无 | 30 | 18(60.00) | 19(63.33) | 16(53.33) |
| Dukes分期 | ||||
| A+B | 30 | 18(60.00)b | 19(63.33)b | 16(53.33)b |
| C+D | 20 | 19(95.00) | 20(100.00) | 2(10.00) |
侵袭和转移是恶性肿瘤的主要生物学特征, 肿瘤细胞在转移过程中存在细胞黏附分子及其介导的行为改变, 恶性肿瘤发生转移的基础是肿瘤细胞摆脱细胞之间黏附作用对他的控制从而脱离原发灶, 在此过程中肿瘤细胞表面黏附分子的去黏附作用至关重要.
Ezrin是ERM蛋白家族中的成员之一, 近年来研究发现, Ezrin蛋白在肿瘤转移过程中扮演重要角色[11], Ezrin对骨癌[12]、乳腺癌[13]、子宫内膜癌[14]、前列腺癌[15]的转移是不可缺少的因素. 转移能力较强的肿瘤细胞系常伴有Ezrin的过表达[16]. Khanna et al[17] 和Yu et al[18]通过实验表明, Ezrin在具有高转移特性的鼠横纹肌肉瘤及骨肉瘤细胞株中高度表达, 抑制横纹肌肉瘤细胞及骨肉瘤细胞中Ezrin的表达能显著抑制肿瘤的肺转移.本研究发现, Ezrin在低分化大肠癌组织中的表达明显高于高分化癌组织, 且Ezrin表达强度与肿瘤侵袭性正相关. 有淋巴结转移和DukesC+D期癌组织中Ezrin的表达显著高于无转移和DukesA和B期癌组织中Ezrin的表达. 提示Ezrin的异常表达与恶性肿瘤细胞的侵袭和转移有关.
FAK是一种非受体蛋白酪氨酸激酶, 分布在细胞黏着斑部位.近年来研究表明, 在多种肿瘤组织中都有FAK表达的显著增加[19], 且FAK的表达与肿瘤的发生及生物学行为有一定的相关性[20]. FAK可激活多条信号传导通路, 参与细胞分化、增生、伸展和迁移以及肿瘤的侵袭和转移等过程[21]. 并且在许多上皮组织起源的肿瘤, 肝癌、胃癌、乳腺癌、卵巢癌等组织中都发现有FAK的过表达[22].Weiner et al[23]认为, 85%侵袭性肿瘤中都存在有FAK的表达升高, 而伴有转移的肿瘤中100%的存在FAK的表达升高. 本研究发现, 有淋巴结转移和Dukes分期C+D期大肠癌组织中FAK的表达显著高于无转移和DukesA和B期大肠癌组织中FAK的表达. 提示FAK在调节癌细胞侵袭和转移方面扮演有重要角色, FAK的过表达可能是各种不同肿瘤细胞侵袭与转移潜能的一个共同通路.
E-cadherin是一种跨膜糖蛋白分子, 介导同种细胞间黏附, 参与建立和维持细胞间的连接. 因此, E-cadherin的表达程度和活性状态可直接影响细胞间的黏附性. 有研究表明, 随肿瘤分期升高E-cadherin的表达呈下降趋势[24], E-cadherin表达水平的降低与肿瘤细胞的浸润转移能力呈明显的相关性[25-26]. 本研究发现, E-cadherin的表达与肿瘤的分化程度、淋巴结转移、Dukes分期有密切关系. 随着肿瘤恶性程度的增高, E-cadherin在大肠癌组织中的表达明显降低. 提示, E-cadherin作为一种肿瘤侵袭抑制因子在肿瘤的发生、发展、侵袭、转移过程中起重要作用. 对评价肿瘤的恶性程度、预测转移、判断预后有重要参考价值.
Ezrin主要参与上皮细胞细胞骨架与细胞膜之间的连接, 具有维持细胞形态、连接黏附分子及调节信号转导等功能. FAK分子氨基端含有同整合素β亚单位、细胞骨架蛋白和信号传导蛋白结合的位点, 并含有150个氨基酸的黏着斑定位序列, 能将黏着斑与FAK结合起来. Ezrin和FAK通过细胞骨架的连接作用参与细胞黏着斑的形成从而在影响细胞黏附过程中扮演重要角色. 有研究表明, Ezrin通过活化RhoA和MAPK途径, 能够促进黏着斑的形成, 促进肿瘤细胞与其他细胞以及间质组织的黏附[4]. 活化的Ezrin蛋白C末端与细胞骨架的肌动蛋白相连, N末端则通过与细胞表面黏附分子E-cadherin、CD44等连接, 调节细胞间及细胞与细胞外基质之间的黏附, 从而影响肿瘤细胞侵袭性等生物学行为[27-28]. Pujuguet et al[29]研究发现, Ezrin可通过Rho蛋白调节E-cadherin在细胞膜上的表达, 从而参与调节细胞间的黏附. 同时, Ezrin在E-cadherin的膜定位也具有重要作用, 具有活化Ezrin结构的细胞能够使细胞内的E-cadherin发生聚集, 从而破坏细胞间接触, 而Ezrin的过度表达同样导致细胞间黏附作用减弱[30]. 因此我们认为, Ezrin, FAK, E-cadherin间通过黏着斑和细胞骨架的连接参与细胞表面复合物的形成, 从而介导细胞间的黏附功能, 并参与肿瘤的侵袭和转移过程. 本研究显示, Ezrin和FAK在大肠癌组织中的高度表达与E-cadherin在大肠癌组织中的低表达相互关联, 共同参与了大肠癌的侵袭和转移过程. 对Ezrin, FAK, E-cadherin及他们与肿瘤相关性的深入研究将有助于我们进一步揭示肿瘤的浸润和转移机制, 找到抑制肿瘤转移的靶点或预测肿瘤患者预后的指标.
侵袭和转移是影响肿瘤患者治疗效果和预后的重要因素, 控制肿瘤细胞的侵袭和转移仍是当今肿瘤研究中的重要课题. 研究表明, 黏 附分子对肿瘤细胞的侵袭和转移特性具有调控作用, 但其具体作用机制不明, 对黏附分子及一些影响 黏附分子功能的基因产物的深入研究, 可能有助于我们探明恶性肿瘤浸润和转移的机制.
近年来, Ezrin与肿瘤的发生、增殖、浸润和转移的关系渐被人们所重视, 有关 Ezrin与其他肿瘤相关黏附分子在肿瘤发生、发展和转移过程中的相互联系、信号转导及表达调控机制将会成为当今肿瘤研究中的新热点之一.
相关研究表明, Ezrin可与多种细胞黏附分子通过细胞骨架结构相连接, 参与细胞极性的维持, 细胞骨 架的收缩和组装, 跨膜信号传导, 并调节基因表达.
Ezrin,FA K及 E-cadherin作为影响细胞间及细胞与基质间黏附作用的重要分子, 对他们之间相互作用机制的深入研究将为我们找到抑制肿瘤转移的靶点或为预测肿瘤患者预后的分子标记提供依据.
1 埃兹蛋白: 以往又称cytovillin, p81 或villin-2, 是一种膜细胞骨架连接蛋白, 为连接细胞膜与细胞骨架的 ERM家族成员之一, 具有维持细胞形态和运动、连接黏附分子及调节信号转导等功能.2 黏着斑激酶: 是一种非受体型酪氨酸激酶, 被认为是整合素依赖性信号转导通路中的基础分子, 具有调节细胞发育、细胞与细胞外基质黏附、细胞骨 架重组等多种生物学功能.
本文对深入理解大肠癌病理生物学行为的分子机制有一定的参考价值, 科学性尚可, 具备一定的创新性和可读性.
电编: 李琪 编辑:王晓瑜
| 1. | Martin TA, Harrison G, Mansel RE, Jiang WG. The role of the CD44/ezrin complex in cancer metastasis. Crit Rev Oncol Hematol. 2003;46:165-186. [PubMed] |
| 2. | Fais S. A role for ezrin in a neglected metastatic tumor function. Trends Mol Med. 2004;10:249-250. [PubMed] |
| 3. | Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003;116:1409-1416. [PubMed] |
| 4. | Birukov KG, Leitinger N, Bochkov VN, Garcia JG. Signal transduction pathways activated in human pulmonary endothelial cells by OxPAPC, a bioactive component of oxidized lipoproteins. Microvasc Res. 2004;67:18-28. [PubMed] |
| 5. | Thamilselvan V, Basson MD. Pressure activates colon cancer cell adhesion by inside-out focal adhesion complex and actin cytoskeletal signaling. Gastroenterology. 2004;126:8-18. [PubMed] |
| 6. | Schlaepfer DD, Mitra SK. Multiple connections link FAK to cell motility and invasion. Curr Opin Genet Dev. 2004;14:92-101. |
| 7. | Hecker TP, Gladson CL. Focal adhesion kinase in cancer. Front Biosci. 2003;8:s705-s714. [PubMed] |
| 9. | Mathew J, Hines JE, Obafunwa JO, Burr AW, Toole K, Burt AD. CD44 is expressed in hepatocellular carcinomas showing vascular invasion. J Pathol. 1996;179:74-79. [PubMed] |
| 10. | Gonzalez MA, Pinder SE, Wencyk PM, Bell JA, Elston CW, Nicholson RI, Robertson JF, Blamey RW, Ellis IO. An immunohistochemical examination of the expression of E-cadherin, alpha- and beta/gamma-catenins, and alpha2- and beta1-integrins in invasive breast cancer. J Pathol. 1999;187:523-529. [PubMed] |
| 11. | McClatchey AI. Merlin and ERM proteins: unappreciated roles in cancer development? Nat Rev Cancer. 2003;3:877-883. |
| 12. | Khanna C, Wan X, Bose S, Cassaday R, Olomu O, Mendoza A, Yeung C, Gorlick R, Hewitt SM, Helman LJ. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 2004;10:182-186. [PubMed] |
| 13. | Elliott BE, Meens JA, SenGupta SK, Louvard D, Arpin M. The membrane cytoskeletal crosslinker ezrin is required for metastasis of breast carcinoma cells. Breast Cancer Res. 2005;7:R365-R373. [PubMed] |
| 14. | Ohtani K, Sakamoto H, Rutherford T, Chen Z, Satoh K, Naftolin F. Ezrin, a membrane-cytoskeletal linking protein, is involved in the process of invasion of endometrial cancer cells. Cancer Lett. 1999;147:31-38. [PubMed] |
| 15. | Valdman A, Fang X, Pang ST, Nilsson B, Ekman P, Egevad L. Ezrin expression in prostate cancer and benign prostatic tissue. Eur Urol. 2005;48:852-857. [PubMed] |
| 16. | Lamb RF, Ozanne BW, Roy C, McGarry L, Stipp C, Mangeat P, Jay DG. Essential functions of ezrin in maintenance of cell shape and lamellipodial extension in normal and transformed fibroblasts. Curr Biol. 1997;7:682-688. [PubMed] |
| 17. | Khanna C, Wan X, Bose S, Cassaday R, Olomu O, Mendoza A, Yeung C, Gorlick R, Hewitt SM, Helman LJ. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 2004;10:182-186. [PubMed] |
| 18. | Yu Y, Khan J, Khanna C, Helman L, Meltzer PS, Merlino G. Expression profiling identifies the cytoskeletal organizer ezrin and the developmental homeoprotein Six-1 as key metastatic regulators. Nat Med. 2004;10:175-181. [PubMed] |
| 19. | Roy P, Jacobson K. Overexpression of profilin reduces the migration of invasive breast cancer cells. Cell Motil Cytoskeleton. 2004;57:84-95. [PubMed] |
| 23. | Weiner TM, Liu ET, Craven RJ, Cance WG. Expression of focal adhesion kinase gene and invasive cancer. Lancet. 1993;342:1024-1025. [PubMed] |
| 24. | Piura B, Rabinovich A, Aizenberg N, Wolfson M. Cadherins in malignancies of the female genital tract. Harefuah. 2005;144:261-265. [PubMed] |
| 25. | Bremnes RM, Veve R, Gabrielson E, Hirsch FR, Baron A, Bemis L, Gemmill RM, Drabkin HA, Franklin WA. High-throughput tissue microarray analysis used to evaluate biology and prognostic significance of the E-cadherin pathway in non-small-cell lung cancer. J Clin Oncol. 2002;20:2417-2428. [PubMed] |
| 26. | Wei Y, Van Nhieu JT, Prigent S, Srivatanakul P, Tiollais P, Buendia MA. Altered expression of E-cadherin in hepatocellular carcinoma: correlations with genetic alterations, beta-catenin expression, and clinical features. Hepatology. 2002;36:692-701. [PubMed] |
| 27. | Hunter KW. Ezrin, a key component in tumor metastasis. Trends Mol Med. 2004;10:201-204. [PubMed] |
| 28. | Curto M, McClatchey AI. Ezrin...a metastatic detERMinant? Cancer Cell. 2004;5:113-114. [PubMed] |
| 29. | Pujuguet P, Del Maestro L, Gautreau A, Louvard D, Arpin M. Ezrin regulates E-cadherin-dependent adherens junction assembly through Rac1 activation. Mol Biol Cell. 2003;14:2181-2191. [PubMed] |