修回日期: 2006-12-01
接受日期: 2006-12-27
在线出版日期: 2007-02-28
目的: 通过观察丹芍化纤胶囊对肝纤维化大鼠PDGFR-b和p-ERK1/2的影响, 探索其抗肝纤维化的可能机制.
方法: ♂SD大鼠55只, 体质量180-220 g, 随机分为正常组、模型组、预防组. 除正常组外, 其余均采用四氯化碳、高脂饮食及乙醇复合因素复制肝纤维化模型, 造模同时预防组每日一次予以0.8 g/kg丹芍化纤自来水悬液灌胃, 模型组、正常组予以等体积自来水灌胃, 持续8 wk. 造模结束后肝组织HE染色病理检查, 免疫组化检测肝组织PDGFR-β、蛋白印迹检测肝组织p-ERK1/2在各组表达, 生化法检测各组血清透明质酸(HA)、层黏蛋白(LN)、Ⅲ型前胶原(PⅢP)、白蛋白(ALB)、总蛋白(TP), 计算白球比(A/G).
结果: 造模8 wk后经病理学证实模型大鼠形成典型的肝纤维化, 模型成功. 与正常组相比, 模型组肝组织PDGFR-β、p-ERK1/2及血清HA、LN、PⅢP均有显著升高, ALB、A/G显著降低(PDGFR-β: 184.6±8.5 vs 89.6±5.8, P<0.05; p-ERK1/2: 360.0±14.5 vs 15.4±2.1, P<0.05; HA: 517.5±91.5 μg/L vs 254.4±33.1 μg/L, P<0.05; LN: 58.4±11.3 μg/L vs 37.3±9.8 μg/L, P<0.05; PⅢP: 36.9±5.6 μg/L vs 4.7±1.5 μg/L, P<0.05; ALB: 27.4±4.9 g/L vs 42.1±1.6 g/L, P<0.05; A/G: 0.89±0.08 vs 1.38±0.09, P<0.05); 与模型组相比, 预防组肝组织PDGFR-β、p-ERK1/2及血清HA、LN、PⅢP均有显著降低, ALB、A/G显著升高(PDGFR-β: 91.1±6.3 vs 184.6±8.5, P<0.05; p-ERK1/2: 253.8±18.2 vs 360.0±14.5, P<0.05; HA: 322.9±41.4 μg/L vs 517.5±91.5 μg/L, P<0.05; LN: 46.0±9.4 μg/L vs 58.4±11.3 μg/L, P<0.05; PⅢP: 14.5±2.4 μg/L vs 36.9±5.6 μg/L, P<0.05; ALB: 37.2±2.8 g/L vs 27.4±4.9 g/L, P<0.05; A/G: 1.18±0.13 vs 0.89±0.08, P<0.05).
结论: PDGFR-β及p-ERK1/2在肝纤维化形成中起重要作用, 丹芍化纤胶囊具有良好的预防肝纤维化形成的作用, 其降低PDGFR-β及p-ERK1/2在肝组织的表达可能是其作用机制之一.
引文著录: 史保生, 侯瑞芳, 吴君, 程明亮. 丹芍化纤胶囊对肝纤维化大鼠PDGFR-β和p-ERK1/2的影响. 世界华人消化杂志 2007; 15(6): 574-579
Revised: December 1, 2006
Accepted: December 27, 2006
Published online: February 28, 2007
AIM: To investigate the effects of Danshao Huaxian capsule (DSHX) on the expression of platelet-derived growth factor receptor β and phosphorylated ERK1/2 (p-ERK1/2) in rats with experimental hepatic fibrosis, and to explore the anti-fibrosis mechanism of DSHX.
METHODS: A total of 55 male Sprague Dawley rats were randomly divided into group A, B, and C. The rats in group A served as normal controls, and those in group B and C were treated with carbon tetrachloride, ethanol and high-fat diet to establish the model of liver fibrosis. Meanwhile, the rats in group C were intragastrically administered with 0.8 g/kg DSHX once per day for 8 weeks. HE staining was used to observe the pathological changes of liver tissues. The expression of PDGFR-β and p-ERK1/2 in fibrosis tissues were detected by immunohistochemistry and Western blot, respectively. Biochemical examination were performed to determine the serum levels of hyaluronic acid (HA), laminin (LN), type Ⅲ procollagen peptide (PⅢP), albumin (ALB), total protein (TP), and the ratio of albumin to globulin (A/G) was also calculated.
RESULTS: Pathological examination confirmed that the model of rat hepatic fibrosis was induced successfully at the end of the 8th week. As compared with those in group A, the expression of PDGFR-β, p-ERK1/2 in liver tissues, the serum levels of HA, LN, and PⅢP were significantly increased (PDGFR-β: 184.6 ± 8.5 vs 89.6 ± 5.8, P < 0.05; p-ERK1/2: 360.0 ± 14.5 vs 15.4 ± 2.1, P < 0.05; HA: 517.5 ± 91.5 μg/L vs 254.4 ± 33.1 μg/L, P < 0.05; LN: 58.4 ± 11.3 μg/L vs 37.3 ± 9.8 μg/L, P < 0.05; PⅢP: 36.9 ± 5.6 μg/L vs 4.7 ± 1.5 μg/L, P < 0.05) in group B, while the serum level of ALB and the value of A/G were markedly decreased (ALB: 27.4 ± 4.9 g/L vs 42.1 ± 1.6 g/L, P < 0.05; A/G: 0.89 ± 0.08 vs 1.38 ± 0.09, P < 0.05). However, in group C, the expression of PDGFR-b, p-ERK1/2 in liver tissues, the serum levels of HA, LN, and PⅢP were markedly decreased (PDGFR-β: 91.1 ± 6.3 vs 184.6 ± 8.5, P < 0.05; p-ERK1/2: 253.8 ± 18.2 vs 360.0 ± 14.5, P < 0.05; HA: 322.9 ± 41.4 vs 517.5 ± 91.5 μg/L, P < 0.05; LN: 46.0 ± 9.4 vs 58.4 ± 11.3 μg/L, P < 0.05; PⅢP: 14.5 ± 2.4 vs 36.9 ± 5.6 μg/L, P < 0.05), while the serum level of ALB and the value of A/G were notably increased (ALB: 37.2 ± 2.8 g/L vs 27.4 ± 4.9 g/L, P < 0.05; A/G: 1.18 ± 0.13 vs 0.89 ± 0.08, P < 0.05) in comparison with those in group B.
CONCLUSION: PDGFR-β and p-ERK1/2 may play pivotal roles in the pathogenesis of liver fibrosis, and DSHX can prevent liver from fibrosis by decreasing the expression of PDGFR-β and p-ERK1/2.
- Citation: Shi BS, Hou RF, Wu J, Cheng ML. Effect of Danshao Huaxian capsule on the expression of platelet-derived growth factor receptor β and phosphorylation events of the ERK1/2 in rats with experimental hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2007; 15(6): 574-579
- URL: https://www.wjgnet.com/1009-3079/full/v15/i6/574.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i6.574
肝纤维化的发生发展过程涉及多种细胞和细胞因子. 肝星状细胞(hepatic stellate cell, HSC)是肝纤维化形成中起关键作用的细胞, 他的激活是整个肝纤维化发生的中心环节[1]. 血小板衍生生长因子(platelet-derived growth factor, PDGF)对多种细胞均有促增殖和趋化作用, 他是HSC最强烈的有丝分裂原[2], 其信号转导通路在肝纤维化形成过程中起着重要作用. 复方中药制剂丹芍化纤胶囊(曾用名汉丹肝乐)是由丹参、赤芍、汉防己、银杏等组成, 大量的实验及临床研究中已经显示出有良好防治肝纤维化作用[3-19]. 我们一方面进一步验证丹芍化纤胶囊抗肝纤维化的作用, 另一方面选取PDGF细胞信号转导途径中PDGFR-β和p-ERK1/2两个关键点作为研究对象, 对丹芍化纤抗肝纤维化的分子药理机制及药物作用靶点进行深入研究.
♂SD大鼠55只, 体质量180-220 g, 由贵阳医学院动物中心提供; 白蛋白(ALB)、总蛋白(TP)血清学检测试剂盒购自上海复星长征医学科学有限公司; 透明质酸(HA)、层黏蛋白(LN)、Ⅲ型前胶原(PⅢP)放射免疫分析测定盒购自北京北方生物技术研究所; 兔抗大鼠PDGFR-β多克隆抗体及SABC免疫组化试剂盒购自武汉博士德公司; 鼠抗人p-ERK1/2多克隆抗体购自Cell Signaling Technology (CST)公司; 丹芍化纤胶囊(主要由丹参、汉防己碱、赤勺等组成, 棕色粉末状)由贵州贵阳制药厂生产(用自来水配成所需浓度悬液使用); 四氯化碳和乙醇购自贵阳医学院设备科. 美国Abbott公司AEROSET2000型全自动生化分析仪; 芬兰WALLAC公司Wizard 1470型γ计数器; 德国Eppndorf公司5810R型台式冷冻离心机; 美国Amersham biosciences公司Ultropro 2100核酸蛋白分析仪; 美国Amersham biosciences公司Hoefer TE22小型垂直电泳仪; 美国Pall公司Reseach rodi-50-RE小型实验室纯水系统.
1.2.1 动物模型复制和给药: 该动物模型复制过程中实验动物有一定的死亡率[20], 酌情调整各组大鼠数量: 55只大鼠随机分为三组: 正常组10只、模型组25只、预防组20只. 除正常组外, 所有大鼠均饲以由79.5%玉米粉、20%猪油和0.5%胆固醇组成的混合饲料, 隔日自由饮用300 mL/L乙醇, 按体质量3 mL/kg(首剂5 mL/kg)每周两次皮下注射400 g/L四氯化碳植物油混合液. 造模过程中间断出现动物不能耐受实验而死亡, 造模结束时正常组﹑模型组、预防组分别剩余10, 13, 16只. 8 wk末5 g/L异戊巴比妥钠按体质量0.4 mL/kg ip麻醉后股动脉放血处死大鼠, 收集肝脏组织, 部分于40 g/L的中性甲醛溶液固定24 h后转移到0.1 mmol/L PBS溶液中保存, 部分迅速转移至-80℃冰箱冻存.
1.2.2 大鼠血清HA, LN, PⅢP, Alb, TP检测并计算白球比(A/G): Alb, TP检测由贵阳医学院第一附属医院生化实验室用美国Abbott公司AEROSET2000型全自动生化分析仪完成. HA, LN, PⅢP检测由贵阳医学院第一附属医院中心实验室用放射免疫检测方法完成.
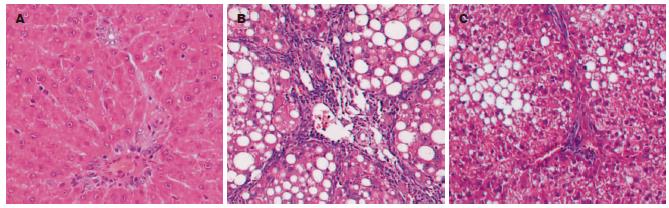
1.2.3 肝组织病理检测: 肝组织石蜡包埋、切片、HE染色由贵阳医学院病理科完成, 根据病理切片中纤维组织增生程度, 按王宝恩 et al的半定量分级法[21]分为0-Ⅵ级: 0级: 肝组织正常, 无胶原纤维增生; Ⅰ级: 胶原纤维从汇管区或中央静脉周围轻度向外延伸; Ⅱ级: 胶原纤维延伸明显, 但未相互连接包绕整个肝小叶; Ⅲ级: 胶原纤维延伸明显, 相互连接, 包绕整个肝小叶; Ⅳ级: 胶原纤维包绕、分割肝小叶, 以至正常肝小叶结构破坏, 假小叶形成, 但以大、方形假小叶为主; Ⅴ级: 肝小叶结构完全破坏, 假小叶形成, 大、方形假小叶与小圆形假小叶约各占50%; Ⅵ级: 肝内布满小圆形假小叶, 纤维间隔粗大增生.
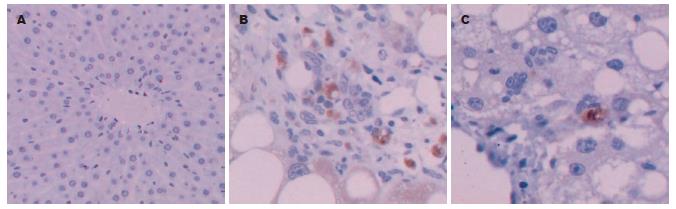
1.2.4 免疫组织化学SABC方法检测PDGFR-β表达: 肝组织切片依次经过60℃烤箱、二甲苯脱蜡、酒精梯度水化、30 mL/L过氧化氢溶液、热修复抗原、加正常兔血清封闭液、加一抗(兔抗鼠PDGFR-β)等步骤, 4℃冰箱过夜. 次日取出切片PBS冲洗3次, 依次加二抗(山羊抗兔)、SABC、新鲜配制DAB溶液显色, 镜下控制显色时间, 自来水冲洗终止, 苏木素复染、脱水, 中性树胶固定封片. 以购买标本作阳性对照, 用PBS液代替一抗作阴性对照, 用图象分析免疫组化图片检测PDGFR-β的表达. 结果判断: 细胞质呈棕黄色为阳性细胞. 每组取五个视野(×400倍), 每个视野取5个视场, 每个视场面积为443 268 μm2, 采用Biomias99彩色高清晰图象分析系统进行分析, 测定组织中PDGFR-β染色光密度值.
1.2.5 蛋白印迹方法检测p-ERK1/2表达: 考马斯亮蓝测各标本蛋白浓度. 每个标本取25 μg总蛋白分别加样, 电泳(120 V, 0.8 mA/cm2)120 min, 转膜(50 V稳压, 4℃)1 h, 考马斯亮蓝染色评价转膜效率, 5 g/L的脱脂奶粉封闭过夜. 加鼠抗人p-ERK1/2(用TBST按1:2000配制)并室温振摇孵育1 h, 加二抗羊抗鼠(用TBST按1:2000配制)并室温振摇孵育1 h, 曝光及胶片冲洗. 美国Bio-Rad公司Quantity one凝胶图象分析系统检测蛋白质条带灰度值.
统计学处理 采用SPSS12.0软件分析, 计量资料假设检验用方差分析, 等级资料的假设检验采用Ridit分析.
8 wk后正常组肝小叶结构完整, 无变性、坏死、炎性细胞浸润及纤维组织增生, 纤维化分级均为0级; 模型组可见大量纤维组织增生, 部分包绕分割肝细胞形成假小叶, 肝细胞广泛脂肪变性, 部分未形成假小叶的部位亦可见肝细胞广泛脂肪变性,仅少量肝细胞残存, 纤维组织由中央静脉或汇管区向外延伸, 增生程度不等, 纤维组织增生程度大部分为Ⅲ-Ⅴ; 预防组纤维增生程度仅为Ⅰ-Ⅲ级, 以Ⅱ级为主, 较模型组减轻(图1). 经过Ridit分析, 模型组和正常组比较有统计学差异, 表明模型复制成功, 模型组和预防组比较有统计学差异, 表明药物干预有效(表1).
丹芍化纤胶囊预防组与其模型组相比, 大鼠血清ALB及A/G值升高(P<0.05), HA, LN, PⅢP水平降低(P<0.05, 表2).
复方中药制剂丹芍化纤胶囊中已经在实验及临床研究被证实有良好防治肝纤维化作用, 本研究在肝纤维化形成过程中给药, 进一步观察丹芍化纤胶囊对肝纤维化形成的抑制作用、对肝功能和纤维化血清学指标的改善作用及对PDGF信号转导途径中PDGFR-β和p-ERK1/2的影响. 8 wk后模型组纤维组织增生程度大部分为Ⅲ-Ⅴ级, 丹芍化纤胶囊组纤维增生程度仅为Ⅰ-Ⅲ级,以Ⅱ级为主, 两组间比较有显著性差异, 另外丹芍化纤胶囊组血清HA, LN, PⅢP水平较其模型组降低(P<0.05), 从病理和血清两方面均说明丹芍化纤胶囊可以抑制肝纤维化形成. 丹芍化纤胶囊组与其模型组相比, 大鼠血清ALB及A/G值升高(P<0.05), 说明丹芍化纤胶囊对肝功能有明显的改善作用.
PDGF被公认为与肝纤维化形成有密切关系的细胞因子, PDGF必须与细胞膜上的相应受体结合后才能发挥其生物学效应, PDGF受体由两种亚单位α及β构成, 静止的HSC只表达α亚单位, 激活的HSC才表达β亚单位[22-24], 因此认为PDGFR-β在肝纤维化过程中的作用尤为突出, 我国学者也有类似结论[25]. PDGF可以通过多种途径促进HSC的增殖进而促进肝纤维化的发展, ERK1/2途径是发现的第一个有丝分裂原激活的蛋白激酶途径, 也是阐述最完全的经典途径. 胞质中ERK1/2被上游激酶磷酸化激活后才能转位入核作用于相应的目的基因, 进而促细胞分裂增殖[24]. 国内也有不少学者的研究也认为PDGF和肝纤维化的关系密切[26-31], 但研究点相对孤立, 机制阐述有限, 有必要进一步深入研究. 另外已有的研究显示, 丹芍化纤胶囊可以通过抑制HSC增殖及胶原蛋白合成、增加胶原酶活性、促进胶原降解、增强免疫调节功能、提高MMP-1的表达等多种途径来发挥抗纤维化作用[3-20], 但其是否对肝纤维化形成过程中的PDGF信号转导通路有一定的干预作用, 有待于探索. 基于以上理论和实验研究结果, 我们在原有大量研究的基础上, 选取PDGF信号转导途径中PDGFR-β和p-ERK1/2两个关键点作为研究对象, 通过探索丹芍化纤胶囊抑制肝纤维化形成过程中PDGFR-β及p-ERK1/2的变化, 对其抗肝纤维化的机制及药物作用靶点进行研究, 以期为丹芍化纤胶囊的靶向作用提供理论依据. 结果显示, 在肝纤维化形成过程中PDGFR-β和p-ERK1/2在预防组的表达较模型组减少, 且均有显著性差异, 提示降低PDGFR-β和p-ERK1/2在肝组织的表达可能是丹芍化纤胶囊抗肝纤维化重要机制之一.
目前, 虽然现代生物医学抗肝纤维化防治研究已经取得了令人鼓舞的成就, 但绝大多数还局限在实验室内或停留在动物实验层次, 尚无实质意义上抗肝纤维化的药物或方法投入临床应用. 现代生物医学抗肝纤维化治疗研究是着眼于发病机制的某个关键环节, 这种寻求单环节阻断的治疗方法与肝纤维化的复杂病理机制难相适应; 而相关细胞因子的副作用及基因治疗的安全性也是有待解决的难题. 而中药复方抗肝纤维化治疗已显示出明显的优势及价值,其多环节、多层次及多靶点的综合药理学作用可能是其优势所在. 迄今报道有代表性的复方有强肝软坚汤、扶正化瘀319方、复方861合剂、复方鳖甲软肝片、丹芍化纤胶囊和传统中药大黄蛰虫丸等均有较好防治肝纤维化效果. 但目前研究大都采用传统的中药复方, 由于天然中药的成分复杂, 一味中药即含有十几种甚至数十种以上的化学成分, 而复方的成分就更加复杂,难以阐明其确切的作用机制, 基础研究相对滞后也就成为阻碍中医药抗肝纤维化应用的难点之一. 因此, 我们应立足于中医药抗肝纤维化的整体优势, 吸收现代生物医学研究精华,进一步揭示中医药抗肝纤维化的作用机制, 为中医药抗肝纤维化奠定坚实的理论基础, 进而研制出安全有效的抗肝纤维化药物.
我国乃至世界肝纤维化患者众多, 肝纤维化发生机制复杂, 一直都是肝病界研究重点. 虽然现代生物医学抗肝纤维化防治研究已经取得了令人鼓舞的成就, 但其往往着眼于发病机制的某个关键环节, 这种寻求单环节阻断的治疗方法与肝纤维化的复杂病理机制难相适应; 相关细胞因子的副作用及基因治疗的安全性也是有待解决的难题, 而中药复方抗肝纤维化治疗显示出明显的优势及价值.
国外Pinzani et al的研究表明PDGF和肝纤维化关系密切, 并且对 PDGF信号转导途径进行了研究. 国内陆翠华 et al的研究均表明PDGF和肝病尤其是肝纤维化关系密切. 程明亮 et al研究表明丹芍化纤胶囊可以通过抑制HSC增殖及胶原蛋白合成、增加胶原酶活性、促进胶原降解、增强免疫调节功能、提高MMP-1的表达等多种途径来发挥抗纤维化作用.
国内有不少学者的研究认为PDGF和肝纤维化的关系密切, 但研究点相对孤立, 机制阐述有限. 我们在已有研究的基础上, 选取 PDGF信号转导途径中PDG FR-β和 p-ERK1/2 两个关键点作为研究对象进行在体研究, 使研究点相对连续, 对肝纤维化发生机制的研究整体性更强. 同时对丹芍化纤胶囊抗肝纤维化的作用和机制提供新的依据.
本文研究结果为肝纤维化的防治提供了新的理论依据和药物作用靶点, 肯定了我国中药复方抗肝纤维化治疗的优势及价值.
本文主要探讨丹芍化纤胶囊对肝纤维化大 鼠PDGFR-β 和 p-ERK1/2的影响,有一定研究价值, 研究方法正确, 结果相对可靠.
电编: 李琪 编辑:王晓瑜
| 1. | Li D, Friedman SL. Liver fibrogenesis and the role of hepatic stellate cells: new insights and prospects for therapy. J Gastroenterol Hepatol. 1999;14:618-633. [PubMed] |
| 2. | Pinzani M, Marra F, Carloni V. Signal transduction in hepatic stellate cells. Liver. 1998;18:2-13. [PubMed] |
| 12. | 谢 汝佳, 杨 勤, 耿 晓霞, 罗 新华, 李 诚秀, 程 明亮. 中药丹芍化纤胶囊对肝纤维化大鼠金属蛋白酶组织抑制因子-1表达的影响. 中国中西医结合杂志基础理论研究特集. 2005;25:54-57. |
| 13. | 杨 勤, 罗 新华, 耿 晓霞, 谢 汝佳, 韩 冰, 李 诚秀, 程 明亮. 丹芍化纤胶囊治疗大鼠肝纤维化后肝星状细胞凋亡及细胞周期的变化. 中国病理生理杂志. 2005;21:975-979. |
| 22. | Friedman SL, Arthur MJ. Activation of cultured rat hepatic lipocytes by Kupffer cell conditioned medium. Direct enhancement of matrix synthesis and stimulation of cell proliferation via induction of platelet-derived growth factor receptors. J Clin Invest. 1989;84:1780-1785. [PubMed] |
| 23. | Wong L, Yamasaki G, Johnson RJ, Friedman SL. Induction of beta-platelet-derived growth factor receptor in rat hepatic lipocytes during cellular activation in vivo and in culture. J Clin Invest. 1994;94:1563-1569. [PubMed] |
| 24. | Marra F, Choudhury GG, Abboud HE. Interferon-gamma-mediated activation of STAT1alpha regulates growth factor-induced mitogenesis. J Clin Invest. 1996;98:1218-1230. [PubMed] |
| 25. | 陆 翠华, 陈 岳祥, 张 忠兵, 谢 渭芬, 黄 介飞, 倪 润洲, 郭 亚军, 卫 立辛, 金 由辛. 肝纤维化大鼠血小板衍生生长因子受体β亚单位的表达及其与细胞外基质成分的相关性. 中华肝脏病杂志. 2004;12:663-665. |
| 30. | 彭 小斌, 张 国安, 刘 小朋, 陈 紫榕, 施 水兰. 乙型肝炎患者TNF-α和PDGF水平及其与肝纤维化的关系. 胃肠病学和肝病学杂志. 2000;9:201-202. |