修回日期: 2006-12-01
接受日期: 2006-12-18
在线出版日期: 2007-02-18
目的: 了解Cajal间质细胞(ICC)、干细胞因子(SCF)在糖尿病大鼠结肠慢传输运动模型中的变化, 探讨其作用及可能的调控机制.
方法: 54只♂SD大鼠分为糖尿病和正常对照组, 经腹腔注射链脲佐菌素建立糖尿病大鼠模型, 于造模后6, 8, 10 wk各组分别处死9只大鼠, 以免疫组化、透射电镜研究近端结肠组织中ICC的变化, 以Western blot方法检测近端结肠组织中膜结合型干细胞因子的表达, 以ELISA测定血清中可溶型SCF的浓度, 分析他们之间的相关性.
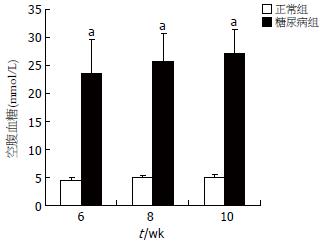
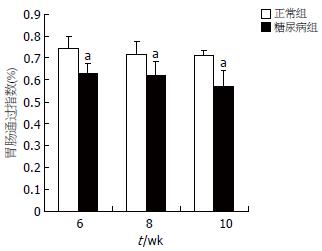
结果: 糖尿病大鼠血糖随时间增加而升高, 而胃肠推进率却降低(P>0.05). 免疫组化结果显示, 6, 8, 10 wk时的糖尿病大鼠肌间ICC表达较对照组明显减少(P<0.05), 且糖尿病大鼠近端结肠ICC数量随时间推移有逐渐降少的趋势. 透射电镜显示糖尿病大鼠结肠ICC线粒体肿胀、空泡样变, 细胞器数量明显减少. 与对照组相比, 糖尿病大鼠血清中可溶型SCF显著降低(6 wk: 0.93±0.53 μg/L vs 1.87±0.92 μg/L, P<0.05; 8 wk: 0.78±0.21 μg/L vs 1.76±0.94 μg/L, P<0.05; 10 wk: 0.73±0.20 μg/L vs 1.82±0.96 μg/L, P<0.05), 而结肠组织中的膜结合型SCF无明显差异(P>0.05), 且可溶型干细胞因子与ICC具有相同的变化趋势.
结论: 糖尿病胃肠动力障碍大鼠存在血清中可溶性干细胞因子浓度下降以及结肠组织中ICC数量减少和结构破坏, 这些变化及其可能存在的序贯性调控作用可能是糖尿病出现结肠慢传输变化的基础.
引文著录: 罗云, 林琳, 张红杰, 李学良, 吴高珏, 王美峰. 糖尿病慢传输运动结肠Cajal间质细胞和干细胞因子的变化. 世界华人消化杂志 2007; 15(5): 458-463
Revised: December 1, 2006
Accepted: December 18, 2006
Published online: February 18, 2007
AIM: To observe the alterations of interstitial cells of Cajal (ICC) and stem cell factors (SCF) in colon tissues with slow transit motility of diabetes mellitus, and study their roles and possible regulatory mechanism.
METHODS: A total of 54 male Sprague-Dawley rats were randomly and averagely divided into diabetes group and control group. Diabetes model was induced by intraperitoneal injection of streptozotocin. Nine rats of the above two groups were killed respectively 6, 8 and 10 weeks after injection. The alterations of ICC and membrane-bound SCF (M-SCF) in the proximal colon tissues were analyzed by immunohistochemistry, transmission electron microscopy and Western blot, and the serum concentration of soluble SCF (S-SCF) were examined by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The level of blood glucose was elevated while the intestinal propulsive rate was lowered with the prolonging of time (P > 0.05). Immunohistochemistry showed that the number of myenteric ICC was significantly higher in diabetic rats than that in the controls, and the expression of proximal colon ICC was decreased with the time prolonging. Electron microscopy exhibited damaged microstructures of colonic ICC such as swelling, vacuole-like degeneration of mitochondria and obvious decrease of organelles. Meanwhile, the serum concentration of S-SCF was remarkably lower in diabetic rats than that in the controls (6 wk: 0.93 ± 0.53 μg/L vs 1.87 ± 0.92 μg/L, P < 0.05; 8 wk: 0.78 ± 0.21 μg/L vs 1.76 ± 0.94 μg/L, P < 0.05; 10 wk: 0.73 ± 0.20 μg/L vs 1.82 ± 0.96 μg/L, P < 0.05), but the content of M-SCF in the colon tissues had no significant difference between the diabetic and normal rats (P > 0.05). The alteration trend of S-SCF concentration was in accordance with that of ICC numbers.
CONCLUSION: Decrease of colonic ICC quantity and serum S-SCF concentration, and damaged microstructures of ICC are demonstrated in diabetic rats with slow transit motility of colon, and these changes and their successive regulation may contribute to the pathogenesis of slow transit motility.
- Citation: Luo Y, Lin L, Zhang HJ, Li XL, Wu GJ, Wang MF. Alteration of Cajal interstitial cells and stem cell factors in colon with slow transit motility of diabetes mellitus. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 458-463
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/458.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.458
糖尿病胃肠动力障碍是糖尿病最常见的并发症之一, 但其发病机制目前尚不十分清楚, 研究已经发现, 这可能与糖尿病胃肠道中对胃肠运动起重要作用的Cajal间质细胞(interstitial cells of Cajal, ICC)的数量和结构异常有关[1-9], 但引起ICC异常的调控因素却知之甚少. 有关研究已经发现: Kit受体(蛋白)是ICC的特异性标记物, 其天然配基干细胞因子(stem cell factor, SCF)与Kit受体结合形成SCF-KIT系统, 参与机体所有含Kit受体细胞的发育、增殖及分化[10-16], 而干细胞因子又有两种形式: 可溶型干细胞因子(soluble stem cell factor, S-SCF)及膜结合型干细胞因子(membrane-bound stem cell factor, M-SCF), 目前对SCF的研究报道主要集中在S-SCF, 而对M-SCF的生物学作用知之相对为少. 两者都有生物学活性, 均可影响髓系和红系造血, 且S-SCF可能指导造血祖细胞的迁移和精原细胞、黑色素细胞(均为Kit阳性细胞)在胚胎发育中的生成或皮肤黑色素细胞的存活; 而对于同样拥有Kit受体的ICC, 其调控作用尚不明确. 糖尿病胃肠动力障碍时胃肠道ICC表达异常是否与SCF改变有关, 本实验拟对此作出研究-观察两种SCF和ICC在糖尿病胃肠动力障碍机体肠道中的变化情况, 并探讨SCF对ICC可能的调控作用.
成年♂SD大鼠(上海, 斯莱克公司)54只, 体质量180-200 g, 随机分为: 实验组(糖尿病组)27只; 正常对照组27只. 链脲佐菌素(streptozotocin, STZ, Sigma, USA), 印度墨水(南京晚晴化玻仪器有限公司), c-Kit抗体(sc-168, 兔多克隆抗体, Santa Cruz, USA), SCF抗体(Peprotech, 羊多克隆抗体, USA), 兔抗羊二抗(Santa Cruz, USA), 免疫组化SP法试剂盒(福州迈新生物有限公司), SCF ELISA试剂盒(RapidBio Lab, California, USA), 透射电镜等.
1.2.1 糖尿病大鼠模型的建立: 实验组大鼠腹腔内一次性注射STZ 60 mg/kg[17-18]; 正常对照组腹腔内注射等量柠檬酸注射液. 3 d后测定血糖, 糖尿病组大鼠以血糖≥16.7 mmol/L(300 mg/dl)者为糖尿病模型建立, 血糖<16.7 mmol/L者剔除实验[17]. 所有大鼠在无特定病原体(specific pathogen free, SPF)级环境饲养, 监测大鼠血糖等一般情况.
1.2.2 糖尿病胃肠动力障碍模型的形成和确认: 所有大鼠均记录(1)日平均粪便重量和性状; (2)胃肠推进率: 于造模后6, 8, 10 wk各组分别处死9只大鼠, 所有大鼠于处死前均给予印度墨水(10 μL/g体质量)灌胃, 30 min后颈椎脱臼处死大鼠, 剖腹取出全部胃肠道, 测量并计算无张力下胃肠推进率(胃肠推进率 = 墨汁推进距离/肠道全长×100%)[19]. 根据张亚萍 et al[6]报道方法, 具备以上任一种显著变化情况时, 则可认为糖尿病胃肠功能紊乱大鼠模型建立成功.
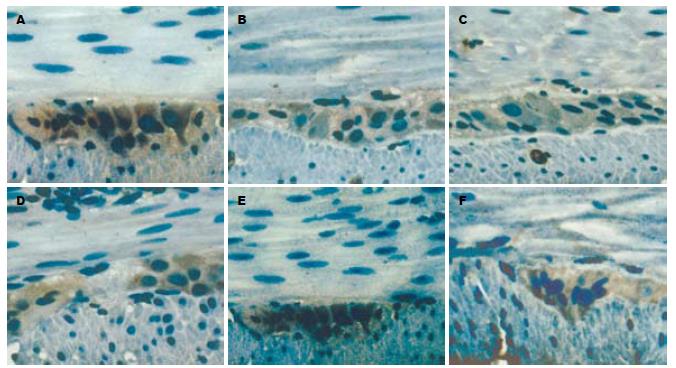
1.2.3 免疫组化(SP法)分析ICC表达情况: 剪取大鼠近端结肠长约0.5 cm, PBS冲洗、40 g/L多聚甲醛固定, 常规包埋、切片、脱蜡、水化、抗原修复. 滴加c-Kit一抗(1:50稀释)50 μL, 37℃孵育1 h后4℃过夜, 先后滴加生物素标记的二抗C及链霉素抗生物素蛋白-过氧化酶D各50 μL, 室温孵育15 min, DAB显色1-10 min, 苏木素衬染细胞核, 冲洗、脱水透明、封片、显微镜观察. 阳性结果判断: 显微镜下胞质出现棕黄色片状或颗粒状物为阳性反应.
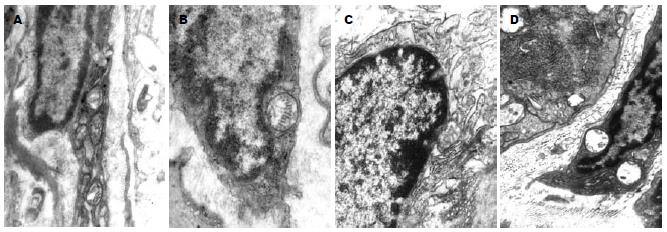
1.2.4 电镜观察: 取近端结肠长约1 cm, 清洗吸干后, 立即放入50 g/L戊二醛中固定. 经前固定、漂洗、后固定、漂洗、块染、脱水、浸渍后包埋成块, 60℃恒温箱36 h, 光镜下半薄切片定位, 确定组织分层后, LKB-Ⅱ超薄切片机切片, 行透射电镜观察、照相.
1.2.5 酶联免疫吸附实验(ELISA)检测血清中SCF(S-干细胞因子)的浓度: 血清按1:10 000稀释, 依照试剂盒要求步骤操作, 最后在酶标仪上450 nm波长处读取A值并换算成浓度.
1.2.6 Western blot法检测结肠组织中M-干细胞因子的含量: 近端结肠组织研磨后提取蛋白并定量, 150 g/L SDS-PAGE凝胶40 μg蛋白/孔, 恒流40 mA电泳, 恒压100 V电转膜2 h, 将蛋白转印至PVDF膜. 50 g/L脱脂奶粉于室温封闭2 h, 加入稀释的SCF羊抗鼠多克隆抗体(0.1 mg/L)37℃孵育1 h后4℃过夜. TBST洗膜后, 加1:3000 HRP标记二抗, 28℃孵育90 min, TBST洗膜, 加入化学发光试剂至膜上1 min, 最后曝光、显影.
统计学处理 所有数据录入SPSS10.0软件包分析, 采用成组t检验和方差分析, 以均数±标准差表示, P<0.05为有显著性差异.
饲养6, 8, 10 wk后, 糖尿病组血糖明显高于相应对照组(P<0.05)(图1), 且随病程延长糖尿病组血糖有逐渐升高的趋势(F = 1.156, P>0.05).
在6, 8, 10 wk时, 糖尿病组均较对照组显著降低, 有统计学差异(P<0.05)(图2), 且胃肠推进率随时间推移有逐渐降低的趋势(F = 2.201, P>0.05).
ICC主要位于结肠肌间、黏膜下及肌内, 尤以肌间表达丰富. 6, 8, 10 wk时的糖尿病大鼠肌间ICC表达较对照组明显减少(P<0.05), 且糖尿病大鼠近端结肠ICC表达随时间推移有逐渐降少的趋势(图3).
正常大鼠结肠ICC主要分布于环肌层与纵肌层之间、环肌细胞之间、环肌层内表面, 常与神经纤维末梢及神经束平行分布, 可见散在缝隙连接, 核不规则, 胞质少, 有较完整的基膜, 胞质内富有细胞器, 以线粒体最丰富, 紧密排列在胞质里, 游离核糖体与多聚核糖体亦多见, 偶有粗面内质网、滑面内质网及高尔基体等. 糖尿病大鼠结肠ICC线粒体肿胀、空泡样变、甚至溶解, 胞质、基膜部分溶解, 细胞器数量较正常明显减少, 细胞内大量空泡形成, 内质网明显扩张, 部分粗面内质网脱颗粒, ICC之间、与平滑肌细胞、神经末梢之间的缝隙连接结构破坏并减少. 此变化随时间延长有愈发严重的趋势(图4).
血清中S-SCF, 6 wk时糖尿病组和对照组分别为0.93±0.53 μg/L和1.87±0.92 μg/L(P<0.05); 8 wk时分别为0.78±0.21 μg/L和1.76±0.94 μg/L(P<0.05); 10 wk时分别为0.73±0.20 μg/L和1.82±0.96 μg/L(P<0.05); 均存在统计学差异, 且糖尿病各组S-SCF随时间推移有逐渐下降的趋势(F = 0.593, P>0.05).
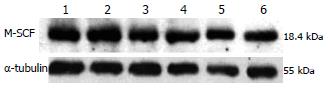
近端结肠组织中M-SCF, 经Western blot检测发现6, 8, 10 wk时糖尿病组与对照组之间, M-SCF均无明显差异(P>0.05)(图5).
胃肠动力障碍是糖尿病常见并发症, 随着对ICC是胃肠道起搏细胞并传导肌电信号理论[20-23]的不断认识, 愈来愈多的证据[1-9]表明胃肠道组织内ICC数量减少及结构破坏导致胃肠功能紊乱发生, 由于ICC数量减少和结构破坏, 导致胃肠起搏功能减弱及电兴奋传导衰减, 平滑肌产生异常的不规则慢波、收缩运动障碍、蠕动减少或不能产生有效的推进性收缩运动, 临床上出现胃肠动力障碍症状. 本实验中, 糖尿病大鼠模型, 经胃肠通过指数检测筛选出胃肠动力障碍大鼠(主要为胃肠转运减慢). 免疫组化和透射电镜发现糖尿病大鼠近端结肠肌间丛ICC数量明显减少, 超微结构破坏, 且随时间推移ICC数量进一步减少、超微结构破坏加重, 与文献报道相符, 提示胃肠道ICC数量减少和结构改变可能是导致糖尿病胃肠动力障碍的机制之一, 且随病程延长这种改变愈加明显. 由于ICC数量减少和结构破坏, 导致胃肠起搏功能减弱及电兴奋传导衰减, 平滑肌产生异常的不规则慢波、收缩运动障碍、蠕动减少或不能产生有效的推进性收缩运动, 临床上出现胃肠动力障碍症状. 本实验结果还提示, ICC数量减少和结构破坏与糖尿病的病程有关, 有随病程延长而改变愈加明显的的趋势.
SCF作为ICC的特异性标志物Kit受体的天然配基, 他参与机体发育中的多种细胞生长的调控, 是一种多功能细胞生长因子, 在细胞增殖、分化和迁移过程中发挥重要的调控作用[24]. 天然的SCF存在两种类型: S-SCF和M-SCF, 两者都有生物学活性, 他们是通过蛋白水解酶位点的相互剪切而产生(6位外显子编码一种蛋白水解酶, 含有可产生S-SCF, 否则产生M-SCF). Kit受体被其配体SCF活化后, PI3激酶活化, 导致磷酸肌醇的肌醇环O-H位点磷酸化, 产生3, 4, 5-三磷酸磷脂酰肌醇, 使多个信号途径活化, 此对于ICC的分化、发育、增殖及表型维持具有重要作用[16]. 另有文献报道, 造血干细胞和胰岛组织等含有Kit受体的细胞, 在其发育及分化过程中亦需要SCF-Kit信号的持续刺激[11-14], 可见SCF-Kit的信号通路在所有Kit阳性细胞的形态和功能维持方面具有重要的意义. 有关ICC受SCF-Kit系统的调控作用, 先前多数研究均集中于Kit受体方面(如ACK2受体阻滞)[20,25], 而理论上SCF的改变将可能同样影响ICC的存在及功能, Battaglia et al[8]的报道及ICC离体培养实验[15,26]均支持此种推测. 究竟糖尿病胃肠动力障碍时有无SCF表达下调、何种亚型表达异常并发挥作用, 目前尚无明确结论. 本实验显示: 糖尿病大鼠血清中S-SCF显著降低, 且随病程延长有愈加明显的趋势; 而在糖尿病病程的不同阶段, 均未见M-SCF的表达与正常组存在差异. 此与Horvath et al[27]关于糖尿病时胃肠道S-SCF-RNA表达下调报道相一致. 作为Kit受体的功能性配基, S-SCF表达的降低, 将导致SCF-Kit信号传导功能减弱, 影响ICC发育、增殖、分化及表型维持[15-16].
文献报道, SCF变异及降低后可见ICC的数量减少[28-29], Horvath et al[30]亦提出, 胰岛素及胰岛素样生长因子-Ⅰ刺激SCF的表达, 对于维持ICC的长期存在是必需的, 糖尿病胃肠动力障碍时可能由于胰岛素分泌减少, 使SCF表达下降, 导致ICC异常改变而致病. 本实验中作为信号通路的一方面, S-SCF的降低将影响ICC的表达, 结合糖尿病大鼠血清中S-SCF呈渐进性的降低, 与ICC随糖尿病病程的延长逐渐减少具有相同的变化趋势, 更加提示血清中SCF降低与结肠组织ICC异常改变具有一定相关性, SCF浓度降低可能是糖尿病胃肠慢传输运动时ICC表达下调的动因之一. 至于实验结果中糖尿病大鼠结肠组织M-SCF在病程的不同阶段改变均不明显, 是否与实验模型和检测部位有关, 或有其他作用途径, 尚需进一步实验加以证实.
ICC异常改变可能是糖尿病胃肠动力障碍的重要发病因素之一, SCF-Kit系统下调可能是其上游调控因素, 但糖尿病时血清中SCF表达下调的机制, 他是否影响ICC的存在及功能, 糖尿病胃肠动力障碍时ICC的改变是否受存在其他调控途径, 都有待于进一步研究.
糖尿病胃肠动力障碍作为糖尿病常见并发症, 严重影响着患者的生活质量和各种治疗性药物的吸收, 直到目前其发病原因仍不甚清楚. 随着对Cajal间质细胞功能的不断认识, 使人们看到了解决这个问题的曙光.
Cajal间质细胞作为胃肠道起搏细胞, 当前研究证实他与多种胃肠动力性疾病相关, 已成为此领域研究的一个热点.
本研究通过在体大鼠实验, 在验证糖尿病胃肠动力障碍Cajal间质细胞的变化基础上,从其配基干细胞因子方面探讨其可能的调控因素,此在国内尚无报道, 而国外仅见个别通过离体培养在此方面作出的相关研究.
阐明糖尿病胃肠动力障碍的致病原因及可能的调控因素, 可为临床治疗和开发相关用药提供理论基础.
Kit受体(蛋白): 是 Cajal间质细胞的特异性标记物, 中文名为酪氨酸蛋白激酶受体, 干细胞因子是其天然配基, 由于检测其含量可间接反映 Cajal间质细胞表达水平, 因此国内外都以他作为IC C定量的一个指标.
本文实验证据尚充足, 结果较明确, 文章的科学性、创新性和可读性能较好的反映我国或国际胃肠病学临床和基础研究的先进水平.
电编: 张敏 编辑:张焕兰
| 1. | Ordog T, Takayama I, Cheung WK, Ward SM, Sanders KM. Remodeling of networks of interstitial cells of Cajal in a murine model of diabetic gastroparesis. Diabetes. 2000;49:1731-1739. [PubMed] |
| 2. | Forster J, Damjanov I, Lin Z, Sarosiek I, Wetzel P, McCallum RW. Absence of the interstitial cells of Cajal in patients with gastroparesis and correlation with clinical findings. J Gastrointest Surg. 2005;9:102-108. [PubMed] |
| 3. | Lin Z, Forster J, Sarosiek I, Damjanov I, McCallum RW. Baseline status of interstitial cells of Cajal predicts long-term symptom improvement in gastroparetic patients treated with gastric electrical stimulation. Gastroenterology. 2004;126:A-73. |
| 4. | He CL, Soffer EE, Ferris CD, Walsh RM, Szurszewski JH, Farrugia G. Loss of interstitial cells of cajal and inhibitory innervation in insulin-dependent diabetes. Gastroenterology. 2001;121:427-434. [PubMed] |
| 5. | Nakahara M, Isozaki K, Hirota S, Vanderwinden JM, Takakura R, Kinoshita K, Miyagawa J, Chen H, Miyazaki Y, Kiyohara T. Deficiency of KIT-positive cells in the colon of patients with diabetes mellitus. J Gastroenterol Hepatol. 2002;17:666-670. [PubMed] |
| 8. | Battaglia E, Bassotti G, Bellone G, Dughera L, Serra AM, Chiusa L, Repici A, Mioli P, Emanuelli G. Loss of interstitial cells of Cajal network in severe idiopathic gastroparesis. World J Gastroenterol. 2006;12:6172-6177. [PubMed] |
| 9. | Long QL, Fang DC, Shi HT, Luo YH. Gastro-electric dysrhythm and lack of gastric interstitial cells of cajal. World J Gastroenterol. 2004;10:1227-1230. [PubMed] |
| 10. | Hollenbeck ST, Sakakibara K, Faries PL, Workhu B, Liu B, Kent KC. Stem cell factor and c-kit are expre-ssed by and may affect vascular SMCs through an autocrine pathway. J Surg Res. 2004;120:288-294. [PubMed] |
| 11. | Li J, Goodyer CG, Fellows F, Wang R. Stem cell factor/c-Kit interactions regulate human islet-epithelial cluster proliferation and differentiation. Int J Biochem Cell Biol. 2006;38:961-972. [PubMed] |
| 12. | Bashamboo A, Taylor AH, Samuel K, Panthier JJ, Whetton AD, Forrester LM. The survival of differentiating embryonic stem cells is dependent on the SCF-KIT pathway. J Cell Sci. 2006;119:3039-3046. [PubMed] |
| 13. | Muta K, Krantz SB, Bondurant MC, Dai CH. Stem cell factor retards differentiation of normal human erythroid progenitor cells while stimulating proliferation. Blood. 1995;86:572-580. [PubMed] |
| 14. | Wojda U, Leigh KR, Njoroge JM, Jackson KA, Natarajan B, Stitely M, Miller JL. Fetal hemoglobin modulation during human erythropoiesis: stem cell factor has "late" effects related to the expression pattern of CD117. Blood. 2003;101:492-497. [PubMed] |
| 15. | Nakahara M, Isozaki K, Vanderwinden JM, Shinomura Y, Kitamura Y, Hirota S, Matsuzawa Y. Dose-dependent and time-limited proliferation of cultured murine interstitial cells of Cajal in response to stem cell factor. Life Sci. 2002;70:2367-2376. [PubMed] |
| 16. | Ward SM, Brennan MF, Jackson VM, Sanders KM. Role of PI3-kinase in the development of interstitial cells and pacemaking in murine gastrointestinal smooth muscle. J Physiol. 1999;516:835-846. [PubMed] |
| 17. | Yumuk Z, Kucukbasmaci O, Buyukbaba Boral O, Kucuker Ang M, Dundar V. The effects of streptozotocin-induced diabetes on brucellosis of rats. FEMS Immunol Med Microbiol. 2003;39:275-278. [PubMed] |
| 18. | Vural H, Sabuncu T, Arslan SO, Aksoy N. Melatonin inhibits lipid peroxidation and stimulates the antioxidant status of diabetic rats. J Pineal Res. 2001;31:193-198. [PubMed] |
| 19. | 乔 娴, 刘 劲松, 吴 汉妮, 侯 晓华. 糖尿病大鼠胃肠运动障碍的实验研究. 胃肠病学和肝病学杂志. 1998;9:242-244. |
| 20. | Ordog T, Ward SM, Sanders KM. Interstitial cells of cajal generate electrical slow waves in the murine stomach. J Physiol. 1999;518:257-269. [PubMed] |
| 21. | Sanders KM. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract. Gastroenterology. 1996;111:492-515. [PubMed] |
| 22. | Ward SM, Harney SC, Bayguinov JR, McLaren GJ, Sanders KM. Development of electrical rhythmicity in the murine gastrointestinal tract is specifically encoded in the tunica muscularis. J Physiol. 1997;505:241-258. [PubMed] |
| 23. | Der-Silaphet T, Malysz J, Hagel S, Larry Arsenault A, Huizinga JD. Interstitial cells of cajal direct normal propulsive contractile activity in the mouse small intestine. Gastroenterology. 1998;114:724-736. [PubMed] |
| 24. | Orlic D, Kajstura J, Chimenti S, Limana F, Jakoniuk I, Quaini F, Nadal-Ginard B, Bodine DM, Leri A, Anversa P. Mobilized bone marrow cells repair the infarcted heart, improving function and survival. Proc Natl Acad Sci USA. 2001;98:10344-10349. [PubMed] |
| 25. | Torihashi S, Nishi K, Tokutomi Y, Nishi T, Ward S, Sanders KM. Blockade of kit signaling induces transdifferentiation of interstitial cells of cajal to a smooth muscle phenotype. Gastroenterology. 1999;117:140-148. [PubMed] |
| 26. | Li CX, Liu BH, Tong WD, Zhang LY, Jiang YP. Dissociation, culture and morphologic changes of interstitial cells of Cajal in vitro. World J Gastroenterol. 2005;11:2838-2840. [PubMed] |
| 27. | Horvath VJ, Vittal H, Lorincz A, Chen H, Almeida-Porada G, Redelman D, Ordog T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] |
| 28. | Ward SM, Burns AJ, Torihashi S, Harney SC, Sanders KM. Impaired development of interstitial cells and intestinal electrical rhythmicity in steel mutants. Am J Physiol. 1995;269:C1577-1585. [PubMed] |
| 29. | Mikkelsen HB, Malysz J, Huizinga JD, Thuneberg L. Action potential generation, Kit receptor immunohistochemistry and morphology of steel-Dickie (Sl/Sld) mutant mouse small intestine. Neurogastroenterol Motil. 1998;10:11-26. [PubMed] |
| 30. | Horvath VJ, Vittal H, Redelman D, Almeida-Porada G, Ordog T. Stimulation of stem cell factor (SCF) expression by insulin or insulin-like growth factor-1 (IGF-1) is required for the long-term maintenance of interstitial cells of Cajal (ICC). Gastroenterology. 2004;126:A-102. |