修回日期: 2006-11-01
接受日期: 2006-11-02
在线出版日期: 2007-02-08
目的: 研究大肠癌组织中碱性成纤维细胞生长因子(bFGF), 蛋白激酶B(PKB)及细胞周期蛋白A(Cyclin A)mRNA的表达水平及与临床病理的关系.
方法: 采用TRIzol法分别提取60例大肠癌组织, 癌旁组织和10例正常组织的RNA, 应用RT-PCR方法检测bFGF, PKB, Cyclin A mRNA的表达水平, PCR产物经凝胶成像及分析系统扫描后, 以β-actin为参照标化bFGF, PKB, Cyclin A的含量. 通过统计学分析其与临床病理关系.
结果: bFGF, PKB, Cyclin A在大肠癌组织中的表达与癌旁组织相比有显著差异(bFGF: 60% vs 10%; PKB: 55% vs 35%; Cyclin A: 70% vs 5%; all P<0.05), 其表达水平与大肠癌Dukes分期有关(bFGF: 2 = 4.434, P<0.05; PKB: 2 = 13.549, P<0.01; Cyclin A: 2 = 21.210, P<0.01). PKB在低分化肿瘤中的表达阳性率高于中高分化肿瘤(14/14 vs 29/46, P<0.05). Cyclin A的表达在高、中分化肿瘤中明显高于低分化肿瘤(37/46 vs 3/14, P<0.05).
结论: bFGF, PKB, Cyclin A的mRNA水平与大肠癌的发生、发展相关.
引文著录: 林杰, 王桂玲, 单吉贤. 大肠癌组织bFGF, PKB, Cyclin A的表达及其与临床的相关性. 世界华人消化杂志 2007; 15(4): 370-374
Revised: November 1, 2006
Accepted: November 2, 2006
Published online: February 8, 2007
AIM: To investigate the expression of basic fibroblast growth factor (bFGF), protein kinase B (PKB), and Cyclin A in colorectal cancer and their correlations with the clinical pathology.
METHODS: After RNA was extracted by TRIzol method from 60 cases of colorectal cancer, their adjacent tissues and 10 cases of normal colorectal tissues, reverse transcriptase polymerase chain reaction (RT-PCR) was used to detect the mRNA expression of bFGF, PKB, Cyclin A. The correlation between the results and clinical pathology was analyzed.
RESULTS: Compared with those in the cancer-adjacent tissues, the expression of bFGF, PKB, Cyclin A mRNA were significantly up-regulated in colorectal cancer tissues (bFGF: 60% vs 10%; PKB: 55% vs 35%; Cyclin A: 70% vs 5%; all P < 0.05), which were significantly correlated with Dukes stages (bFGF: χ2 = 4.434, P < 0.05; PKB: χ2 = 13.549, P < 0.01; Cyclin A: χ2 = 21.210, P < 0.01). The level of PKB expression was markedly higher in lowly-differentiated tumor than that in highly and moderately-differentiated one (14/14 vs 29/46, P < 0.05), but Cyclin A expression showed reverse results (3/14 vs 37/46, P < 0.05).
CONCLUSION: The expression of bFGF, PKB, Cyclin A mRNA may play important roles in the carcinogenesis and development of colorectal cancer.
- Citation: Lin J, Wang GL, Shan JX. Expression of basic fibroblast growth factor, protein kinase B, Cyclin A and their clincial significances in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 370-374
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/370.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.370
大肠癌是我国发病率及死亡率最高的恶性肿瘤之一, 其发病机制尚未完全清楚. 手术治疗是大肠癌首选治疗方法.但相当一部分在发现时已出现浸润或转移, 即便手术切除之后仍有复发, 对放疗和化疗的治疗效果亦不甚理想. 细胞生长因子、信号转导与肿瘤的关系已日益受到重视. 我们采用RT-PCR法检测了60例大肠癌组织及相应癌旁黏膜、正常黏膜中bFGF, PKB及Cyclin A mRNA的表达水平, 并结合临床病理情况进行分析, 以探讨其在大肠癌发生发展过程中的意义.
辽宁省肿瘤医院2005-01/2005-05大肠癌手术切除的新鲜标本60例, 其中男38例, 女22例; 年龄27-78(平均55.4)岁. 其中高分化28例(47%), 中分化18例(30%), 低分化14例(23%); Dukes分期A期14例(23%), B期20例(33%), C期+D期26例(44%). 每例标本于手术中取250 mg左右组织, 置于-70℃超低温冰箱备用. 所有患者术前均未接受化疗或放疗. 全部标本均经病理学证实为大肠腺癌. 癌旁组织取距癌组织5 cm的肠组织; 对照组10例, 均为正常大肠组织. RT-PCR试剂盒Ver2.1购于TakaRa公司. bFGF, PKB, Cyclin A及β-actin引物购于TakaRa 公司; TRIzol试剂购于Gibcobrl公司; 自动电泳凝胶成像分析仪为Olympus公司产品; PCR 扩增仪PTC-100TM为美国PE公司产品.
采用TRIzol法提取总RNA, 用紫外分光光度计检测RNA纯度及浓度设计并合成引物见表1, 进行逆转录和PCR检测大肠癌组织中bFGF, PKB, Cyclin A的表达, 用β-actin做内对照. PCR产物经凝胶成像及分析系统扫描后, 以β-actin为参照标化bFGF, PKB, Cyclin A的含量.
| 引物名称 | 引物序列 | 引物长度(bp) |
| bFGF | 5'-GGCTACAAGGTCCGTTATG -3' | 105 |
| 5'-GATGCTGCCGTACTCATTC -3' | ||
| PKB | 5'-ACCTTTGGGCTCTTGGAT-3' | 450 |
| 5'-GCTCTATGTTGCTGCCTGAC-3' | ||
| cyclin A | 5'-TGGAGTTGTGCTGGCTAC-3' | 216 |
| 5'-TCAGGGAGTGCTTTCTTT-3' | ||
| β-actin | 5'-GAAACTACCTTCAACTCCATC -3' | 498 |
| 5'-CTAGAAGCATTTGCGGTGGACGATGGAGGGGCC-3' |
统计学处理 应用SPSS10.0统计软件包, 进行χ2检验, 检测bFGF, PKB, Cyclin A mRNA的表达水平与临床病理因素的关系.
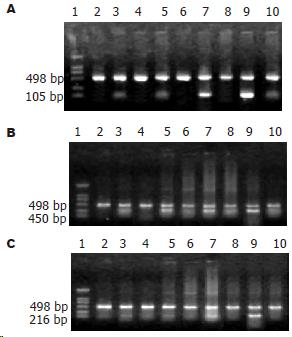
扩增后bFGF产物为105 bp(图1A), PKB产物为450 bp(图1B); Cyclin A产物为216 bp(图1C). 内参照β-actin为498 bp, 所有组织中均有稳定表达. 以正常大肠组织为对照, 取其相对含量95%的可信区间为0.547-0.682, 当所测mRNA/β-actin>0.69为阳性表达. 60例大肠癌中, bFGF阳性表达45例(60%), PKB 33例(55%), Cyclin A 42例(70%); 相应癌旁组织中, bFGF阳性表达6例(10%), PKB 21例(35%), Cyclin A 3例(5%). 上述三项指标在大肠癌中的阳性表达率均明显高于癌旁组织(P<0.05).
癌组织中bFGF表达明显高于癌旁组织(P<0.01), C期和D期明显高于A, B期(P<0.05), 而bFGF的表达水平与大肠癌组织分化程度无关(P>0.05)(表2). PKB在正常组织和癌旁组织中的表达差异无统计学意义(P>0.05); 但其阳性表达率和强度均显著低于大肠癌组织(P<0.05), C、D期阳性表达率高A、B期(P<0.01), PKB在低分化肿瘤中的表达阳性率高于中和高分化肿瘤(P<0.05)(表3). 大肠癌中Cyclin A的表达阳性率与癌旁相比, 差异有非常显著性(P<0.01), A, B期无淋巴结转移组明显高于C、D期有淋巴结转移组(P<0.01); 在高、中分化肿瘤中Cyclin A明显高于低分化肿瘤(P<0.01)(表4).
| 病理参数 | n | 癌组织(n) | 癌旁组织(n) | ||
| + | - | + | - | ||
| Dukes分期 | |||||
| A | 14 | 8 | 6 | 1 | 13 |
| B | 20 | 14 | 6 | 2 | 18 |
| C | 18 | 16 | 2 | 2 | 16 |
| D | 8 | 7 | 1 | 1 | 7 |
| 组织学分级 | |||||
| 高分化 | 28 | 21 | 7 | 2 | 26 |
| 中分化 | 18 | 14 | 4 | 2 | 16 |
| 低分化 | 14 | 10 | 4 | 2 | 12 |
| 病理参数 | n | 弱阳性表达(n) | 中或强阳性(n) | 阳性(n) | |
| 组织类型 | 正常组织 | 10 | 3 | 1 | 4 |
| 癌旁组织 | 60 | 15 | 6 | 21 | |
| 癌组织 | 60 | 8 | 35 | 43 | |
| Dukes | A、B期 | 34 | 3 | 15 | 18 |
| 分期 | C、D期 | 26 | 5 | 20 | 25 |
| 组织学 | 高中分化 | 46 | 5 | 24 | 29 |
| 分级 | 低分化 | 14 | 3 | 11 | 14 |
| 病理参数 | n | 癌组织(n) | 癌旁组织(n) | ||
| + | - | + | - | ||
| Dukes分期 | |||||
| A | 14 | 13 | 1 | 2 | 12 |
| B | 20 | 18 | 2 | 1 | 19 |
| C | 18 | 6 | 12 | 0 | 18 |
| D | 8 | 3 | 5 | 0 | 8 |
| 组织学分级 | |||||
| 高分化 | 28 | 23 | 5 | 2 | 26 |
| 中分化 | 18 | 14 | 4 | 1 | 17 |
| 低分化 | 14 | 3 | 11 | 0 | 14 |
上述结果表明bFGF, PKB, Cyclin A在大肠癌组织中有过度表达, 其表达水平与大肠癌Dukes分期有关. 且PKB, Cyclin A的mRNA表达水平与大肠癌的分化组织有关.
bFGF作为一种细胞有丝分裂原和促血管生成因子, 在许多肿瘤的生长中起着重要的作用. 他对神经胶质瘤、白血病、肺癌、肝癌等细胞有促增殖分化功能, 参与了胚胎发育、血管生成、损伤修复、神经再生、肿瘤生长等多项生理及病理过程[1-2]. 但对大肠癌细胞这方面的研究报道很少. 现代分子生物学研究表明bFGF过度表达与肿瘤发生、发展及预后有密切关系[3-6]. 在大肠癌中也表现出相似结果[7]. PKB与人类多种恶性肿瘤, 如结肠癌、卵巢癌、乳腺癌和前列腺癌的发生密切相关, 其过量产生和活化参与细胞转化[8-14]. 体外实验发现, 不仅PKB水平在人肺癌癌前病变细胞和肺癌细胞中明显高于正常支气管上皮细胞, 而且PKB在前二者中处于持续活化状态, 在后者中却处于非活化状态, 提示PKB在肺癌的发生过程中可能起重要作用[15-17]. 本研究结果表明, PKB在大肠癌组织中表达的阳性率和强度均明显高于癌旁大肠组织和大肠良性病变组织, 也提示PKB在大肠癌的发生过程中可能发挥作用. 我们还发现, PKB在晚期大肠癌组织中的表达明显高于在早期大肠癌组织中的表达, 在伴有淋巴结转移大肠癌中的表达也显著高于在无淋巴结转移大肠癌中的表达. 这与PKB在前列腺癌中的表达规律相似[16]. 有研究证实, 在非小细胞肺癌细胞株中, PKB能增强肿瘤细胞的生存能力,对化疗和放疗产生对抗作用[18-21]; 在乳腺癌和卵巢癌中, PKB过表达能增强其外侵和转移能力[13]. 这些结果提示, PKB与大肠癌的进展可能也密切相关, 甚至可能是预防和治疗中晚期和高恶性大肠癌的有用靶分子.
恶性肿瘤的发生有多种可能的机制, 如目前公认的癌基因的过度扩增、抑癌基因的缺失、生长因子信号传导通路的持续激活等, 这些机制正是通过直接或间接影响细胞周期调控因子的功能, 促进细胞周期持续演进, 细胞进入自主的无限制的增殖和分裂, 表现出旺盛的增殖活性而发生恶性转化. 从一定程度上细胞周期是所有这些机制的"最后公路". 近年研究认为, 细胞周期主要由细胞周期蛋白、细胞周期蛋白依赖性激酶和细胞周期蛋白依赖性激酶抑制物三类物质在G1/S, G2/M两个关键性限制点进行调控. Cyclin A是细胞周期G2/M限制点的主要调控元件, 在部分恶性肿瘤中呈过度表达[22-23]. Cyclin A是参与细胞周期G2/M转换的重要正性调节因子. 他们过度表达使细胞周期G2/M转换时间缩短, 进而促进细胞周期的进程和细胞过度增殖,导致细胞癌变[24]. Cyclin A是一类在哺乳动物细胞S期和G2/M期两个节点均起重要作用的蛋白, 这提示Cyclin A的过表达可能是大肠癌发生的早期事件, Cyclin A是细胞周期进入S期和M期所必须的调节蛋白, 他的过度表达将会使出于S期和G2/M期的细胞百分比增加, 从而影响细胞周期的过程, 促进细胞的增殖, 因此可能是影响大肠黏膜细胞正常细胞周期重要途径之一.
本实验结果表明, 60例大肠癌组织中Cyclin A表达阳性者42例, 阳性率70%, 相应癌旁黏膜仅检出6例阳性表达, 占10%, 而正常黏膜未见有Cyclin A的阳性表达, 说明在大肠癌组织中存在着Cyclin A的过表达. 本实验通过进一步分析Cyclin A的表达与大肠癌临床病理特点之间的关系,发现在高、中分化癌中的表达均显著高于低分化癌中的表达(P<0.01); 在浸润至肌层组中的表达明显高于浸润至浆膜层组(P<0.05). 这提示Cyclin A的过表达可能是大肠癌发生的早期事件, Cyclin A是细胞周期进入S期和M期所必须的调节蛋白, 他的过度表达将会使出于S期和G2/M期的细胞百分比增加, 从而影响细胞周期的进程, 促进细胞的增殖, 因此可能是影响大肠黏膜细胞正常细胞周期重要途径之一.
近年来, 细胞生长因子、信号转导与肿瘤的关系已日益受到重视. bFGF作为一种细胞丝裂原和促血管生成因子, 可能参与肿瘤病理发生的主要途径, 具有重要的研究价值. PKB是丝氨酸/苏氨酸蛋白激酶, PKB是磷脂酰肌醇3-激酶的直接下游靶蛋白, PKB成为信号转导深入研究的焦点, 所介导细胞存活且在恶性肿瘤发生中起着关键的作用. 细胞周期是所有肿瘤发生机制的“最后公路”. Cyclin A是参与细胞周期G2/M转换的重要作用的蛋白, 其过度表达使细胞周期G2/M转换时间缩短, 进而促进细胞周期的进程和细胞过度增殖, 导致细胞癌变.
肿瘤细胞信号转导特别是细胞生长因子与肿瘤发生的信号转导更是该领域的研究热点, bFGF通过 PI3-K/PKB通路调控大肠癌细胞生长的信号转导机制是其中之.
本文通过对60例大肠癌组织中bFGF, PKB及CyclinAmRNA的检测, 进一步证实bFGF, PKB及 Cyclin A在大肠癌组织中有过度表达, 其表达水平与大肠癌Dukes分期有关. 为研究 bFGF通过PI3-K/PKB通路调控大肠癌细胞增殖的信号转导机制提供了更有力的支持.
本研究通过检测大肠癌组织及相应癌旁黏膜、正常黏膜中bFGF、PKB及Cyclin A的表达, 并结合临床病理情况进行分析, 为探求包括大肠癌等肿瘤的发生、发展、浸润和转移的机制以及治疗和预后提供重要理论和临床依据.
本文通过对大肠癌组织bFGF, PKB, Cyclin A的表达的研究, 探讨了bFGF, PKB, Cyclin A对于诊断治疗的特殊价值, 与目前国内外报道一致. 论文具有较高的理论水平及临床应用价值.
电编: 李琪 编辑:张焕兰
| 1. | Tsang M, Friesel R, Kudoh T, Dawid IB. Identification of Sef, a novel modulator of FGF signalling. Nat Cell Biol. 2002;4:165-169. [PubMed] |
| 2. | Okada-Ban M, Thiery JP, Jouanneau J. Fibroblast growth factor-2. Int J Biochem Cell Biol. 2000;32:263-267. [PubMed] |
| 3. | Dow JK, deVere White RW. Fibroblast growth factor 2: its structure and property, paracrine function, tumor angiogenesis, and prostate-related mitogenic and oncogenic functions. Urology. 2000;55:800-806. [PubMed] |
| 4. | Jang JH, Chung CP. A novel splice variant of fibroblast growth factor receptor 2 in human leukemia HL-60 cells. Blood Cells Mol Dis. 2002;29:133-137. [PubMed] |
| 6. | Zhao J, Miao J, Zhao B, Zhang S, Yin D. Suppressing Akt phosphorylation and activating Fas by safrole oxide inhibited angiogenesis and induced vascular endothelial cell apoptosis in the presence of fibroblast growth factor-2 and serum. Int J Biochem Cell Biol. 2006;38:1603-1613. [PubMed] |
| 8. | Zhang B, Cao H, Rao GN. Fibroblast growth factor-2 is a downstream mediator of phosphatidylinositol 3-kinase-Akt signaling in 14,15-epoxyeicosatrienoic acid-induced angiogenesis. J Biol Chem. 2006;281:905-914. [PubMed] |
| 11. | Chou CH, Wei LH, Kuo ML, Huang YJ, Lai KP, Chen CA, Hsieh CY. Up-regulation of interleukin-6 in human ovarian cancer cell via a Gi/PI3K-Akt/NF-kappaB pathway by lysophosphatidic acid, an ovarian cancer-activating factor. Carcinogenesis. 2005;26:45-52. [PubMed] |
| 12. | Okada-Ban M, Thiery JP, Jouanneau J. Fibroblast growth factor-2. Int J Biochem Cell Biol. 2000;32:263-267. [PubMed] |
| 13. | Arboleda MJ, Lyons JF, Kabbinavar FF, Bray MR, Snow BE, Ayala R, Danino M, Karlan BY, Slamon DJ. Overexpression of AKT2/protein kinase Bbeta leads to up-regulation of beta1 integrins, increased invasion, and metastasis of human breast and ovarian cancer cells. Cancer Res. 2003;63:196-206. [PubMed] |
| 14. | Roy HK, Olusola BF, Clemens DL, Karolski WJ, Ratashak A, Lynch HT, Smyrk TC. AKT proto-oncogene overexpression is an early event during sporadic colon carcinogenesis. Carcinogenesis. 2002;23:201-205. [PubMed] |
| 15. | Zinda MJ, Johnson MA, Paul JD, Horn C, Konicek BW, Lu ZH, Sandusky G, Thomas JE, Neubauer BL, Lai MT. AKT-1, -2, and -3 are expressed in both normal and tumor tissues of the lung, breast, prostate, and colon. Clin Cancer Res. 2001;7:2475-2479. [PubMed] |
| 16. | Malik SN, Brattain M, Ghosh PM, Troyer DA, Prihoda T, Bedolla R, Kreisberg JI. Immunohistochemical demonstration of phospho-Akt in high Gleason grade prostate cancer. Clin Cancer Res. 2002;8:1168-1171. [PubMed] |
| 17. | Kandasamy K, Srivastava RK. Role of the phosphatidylinositol 3'-kinase/PTEN/Akt kinase pathway in tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in non-small cell lung cancer cells. Cancer Res. 2002;62:4929-4937. [PubMed] |
| 18. | Brognard J, Clark AS, Ni Y, Dennis PA. Akt/protein kinase B is constitutively active in non-small cell lung cancer cells and promotes cellular survival and resistance to chemotherapy and radiation. Cancer Res. 2001;61:3986-3997. [PubMed] |
| 19. | Jee SH, Chu CY, Chiu HC, Huang YL, Tsai WL, Liao YH, Kuo ML. Interleukin-6 induced basic fibroblast growth factor-dependent angiogenesis in basal cell carcinoma cell line via JAK/STAT3 and PI3-kinase/Akt pathways. J Invest Dermatol. 2004;123:1169-1175. [PubMed] |
| 20. | Chaudhary LR, Hruska KA. Inhibition of cell survival signal protein kinase B/Akt by curcumin in human prostate cancer cells. J Cell Biochem. 2003;89:1-5. [PubMed] |
| 21. | Maffucci T, Piccolo E, Cumashi A, Iezzi M, Riley AM, Saiardi A, Godage HY, Rossi C, Broggini M, Iacobelli S. Inhibition of the phosphatidylinositol 3-kinase/Akt pathway by inositol pentakisphosphate results in antiangiogenic and antitumor effects. Cancer Res. 2005;65:8339-8349. [PubMed] |
| 22. | Dobashi Y, Jiang SX, Shoji M, Morinaga S, Kameya T. Diversity in expression and prognostic significance of G1/S cyclins in human primary lung carcinomas. J Pathol. 2003;199:208-220. [PubMed] |
| 23. | Ohashi R, Gao C, Miyazaki M, Hamazaki K, Tsuji T, Inoue Y, Uemura T, Hirai R, Shimizu N, Namba M. Enhanced expression of cyclin E and cyclin A in human hepatocellular carcinomas. Anticancer Res. 2001;21:657-662. [PubMed] |
| 24. | Shih HC, Shiozawa T, Kato K, Imai T, Miyamoto T, Uchikawa J, Nikaido T, Konishi I. Immunohistochemical expression of cyclins, cyclin-dependent kinases, tumor-suppressor gene products, Ki-67, and sex steroid receptors in endometrial carcinoma: positive staining for cyclin A as a poor prognostic indicator. Hum Pathol. 2003;34:471-478. [PubMed] |