修回日期: 2006-10-01
接受日期: 2006-10-11
在线出版日期: 2007-02-08
目的: 观察早期肠内谷氨酰胺补给对烫伤大鼠回肠p-ERK1/2表达的影响.
方法: 选健康SD大鼠88只随机分为肠内营养组(EN组, n = 40)、肠内营养加谷氨酰胺补给组(EN+Gln组, n = 40)和伤前对照组(n = 8), 制备总烧伤面积(TBSA)为30%的Ⅲ0烫伤动物模型, 伤后早期分别给予肠内营养制剂能全力和能全力加Gln, 于6, 12, 24, 48和96 h观察肠黏膜细胞p-ERK的表达分布及血浆D-乳酸浓度变化.
结果: 烧伤后血浆D-乳酸水平升高, EN组在观察时间内血浆D-乳酸水平没有恢复正常 (P<0.05), EN+Gln组血浆D-乳酸水平在伤后48 h恢复至伤前水平且明显低于EN组(4.7±0.9 vs 6.9±1.2, P<0.05). p-ERK1/2免疫组化染色显示烧伤后阳性细胞数量显著增加, EN+Gln组回肠阳性细胞百分比在24, 48, 96 h明显高于EN组(绒毛: 87.6%±9.6%, 84.4%±10.3%, 74.6%±9.7% vs 64.6%±7.3%, 59.6%±7.1%, 58.4%±7.4%, P<0.05; 隐窝: 73.6%±11.2%, 67.4%±8.6%, 63.6%±7.9% vs 54.3%±6.3%, 51.6%±5.9%, 48.4%±5.3%, P<0.05). Western blot显示EN组伤后6 h p-ERK1/2表达明显增加, 12 h达高峰, 然后逐渐下降, EN+Gln在24 h达到高峰并逐渐下降.
结论: 相对于肠内营养, 早期肠内给予Gln能促进肠上皮细胞p-ERK1/2的表达, 改善黏膜局部的屏障功能.
引文著录: 郭光华, 邓志云, 范骏, 张红艳, 李国辉. 早期肠内谷氨酰胺补给对烫伤大鼠回肠p-ERK通路的影响. 世界华人消化杂志 2007; 15(4): 353-358
Revised: October 1, 2006
Accepted: October 11, 2006
Published online: February 8, 2007
AIM: To investigate the effect of initial enteral glutamine supplementation on p-ERK1/2 expression in ileal mucosa of scalded rats.
METHODS: Healthy adult Sprague Dawley rats were randomly divided into enteral nutrition (EN) group (n = 40), enteral nutrition plus glutamine (EN + Gln) group (n = 40) and pseudo-scalded (PS) group (n = 8). Scalded model (30% total body surface area, Ⅲ0 scald injury) was established in the rats of the former two groups, and the corresponding methods were used. The expression of p-ERK1/2 in ileal mucosa was analyzed by immunohistochemical staining and Western blot, and the changes of plasma D-lactate concentration in portal vein were measured by ultraviolet spectrophotometry.
RESULTS: The concentration of D-lactate was heightened after scalding, and it restored to the normal level after 48 hours in EN + Gln group, which was significantly lower than that in EN group (4.7 ± 0.9 vs 6.9 ± 1.2, P < 0.05). Immunohistochemistry revealed the number of p-ERK1/2-positive cells had been increased after scalded injury, and the percentages of p-ERK1/2-positive cells had been markedly higher in EN + Gln group than that in EN group at the 24th, 48th, and 96th hour (villus: 87.6% ± 9.6%, 84.4% ± 10.3%, 74.6% ± 9.7% vs 64.6% ± 7.3%, 59.6% ± 7.1%, 58.4% ± 7.4%, P < 0.05; recess: 73.6% ± 11.2%, 67.4% ± 8.6%, 63.6% ± 7.9% vs 54.3% ± 6.3%, 51.6% ± 5.9%, 48.4% ± 5.3%, P < 0.05). Western blot showed that the expression of p-ERK1/2 had been obviously increased in EN group at the 12th hour after scalded injury, and then decreased gradually, while it reached the peak at 24th hour, and then decreased gradually in EN + Gln group.
CONCLUSION: In comparison with enteral nutrition, enteral glutamine supplementation can promote the expression of p-ERK1/2 in ileal mucosa and improve the function of intestinal barrier in scalded rats.
- Citation: Guo GH, Deng ZY, Fan J, Zhang HY, Li GH. Effect of initial enteral glutamine supplementation on p-ERK1/2 pathway in ileal mucosa of scalded rats. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 353-358
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.353
在严重烧伤、感染、休克等应激条件下, 因肠道缺血缺氧、炎性因子的瀑式释放、营养底物的缺乏等导致肠黏膜受损, 上皮细胞通透性增加及增殖受抑制, 肠屏障功能受损, 肠道细菌移位. 丝裂素活化蛋白激酶(mitogen activated protein kinase, MAPK)级联是细胞内重要的信号转导途径, 其将细胞外刺激传递至细胞核, 参与细胞的生长、发育、分化等一系列生理过程. 肠道损伤所涉及缺血、炎症、凋亡等多个病理机制与MAPK信号道路的调节有关, MAPK/ ERK是其中一条重要的信号转导通路, 可被生长因子、G蛋白偶联受体的配体和转录因子等激活[1]; ERK通路在促进肠上皮增生、分化、抑制凋亡中发挥重要作用. 近来研究发现, 谷氨酰胺(Gln)能促进肠黏膜细胞的增生、减轻肠道损伤、防止肠黏膜萎缩等作用, 有利于维持肠黏膜屏障功能. 为此我们设计了本实验, 对烧伤后大鼠早期肠内补给Gln, 观察其对MAPK/ERK的活性形式p-ERK1/2的激活作用, 探讨肠内Gln补给与ERK信号途径关系及其可能的机制.
成年健康Wistar大鼠88只, 体质量220-250 g, 雌雄兼用, 由南昌大学医学院医学实验动物科学部提供. 雌雄分笼, 适应性喂养1 wk, 自由摄水饮食. p-ERK鼠mAb购自美国cell signaling technology公司, 以及相应的试剂(北京中山生物技术有限公司).
1.2.1 烫伤模型的制作: 动物随机分为两组, 即肠内营养组(EN组)和肠内营养组加谷氨酰胺补给组(EN+Gln组), 两组所有大鼠均制成烫伤模型, 每组40只. 另取8只作为伤前对照, 制成假烫模型, 所得数据作为伤前参考值. 大鼠烫伤前禁食12 h时, 10 g/L戊巴比妥钠(40 mg/kg)腹腔麻醉, 背部电推剃毛, 称其质量后采用本实验中心自制蒸汽烫伤控制器, 设定压力为0.03 mPa, 温度108℃, 持续8 s, 造成总体表面积(TBSA)为30% 的Ⅲ0烫伤. 伤后立即腹腔注射平衡液50 mL/kg 抗休克. 将大鼠放入限制笼内饲养, 于伤后6, 12, 24, 48和96 h检测观察指标, 在每个时间点, 每组大鼠均为8只.
1.2.2 营养液的配制与供给: 各组给予同等热量的肠内营养物, EN组给予肠内营养剂能全力(Nutricia公司), EN+Gln组在此基础上添加Gln(重庆药友制药有限公司惠赠)0.3 g/d•kg; 伤后4 h开始灌喂营养液; 每日总热量按文献[3]报道的731.5 kJ/kg给予, 每天计划量分3-5次喂完, 不限饮水.
1.2.3 检测指标和方法: (1)血浆D-乳酸测定: 门静脉血离心后分离血浆, -80℃保存, 用酶联紫外分光光度法测定血浆D-乳酸水平. (2)肠黏膜p-ERK1/2的免疫组化测定: 取大鼠回肠末段石蜡包埋后切片, 应用p-ERK小鼠mAb(cell signaling technology, Inc, 美国)以及相应的第二抗体, 按照试剂说明书要求进行免疫组织化学技术操作. 结果以细胞质或细胞核着棕色者为阳性染色. 另用PBS代替一抗做阴性对照. 光镜下观察阳性细胞在小肠黏膜的分布; 每只大鼠观察50个纵向切开的隐窝和绒毛, 统计阳性细胞百分率. 其结果以均数±标准差表示; (3)Western blot法检测p-ERK1/2的表达: 主要步骤为载玻片刮取大鼠回肠黏膜层, 称其质量后加入去污剂裂解缓冲液, 匀浆器匀浆, 冰上裂解30 min, 将已裂解的组织转移入1.5 mL EP管中, 4℃, 10 000 g离心10 min, 取上清, 用Folin酚法进行蛋白定量后, 取40 μL蛋白, 加入上样缓冲液煮沸3 min变性后, 完成十二磺基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白转膜操作, 膜片分别与一抗(鼠抗p-ERK1/2 mAb, 稀释浓度为1:1000)进行抗原抗体结合反应, 然后将NC移入10 mL含有羊抗大鼠IgG-HRP的反应液(二抗1:1000溶于封闭液)中, 室温平摇120 min; 经适当洗涤, 膜片与ECL温浴1 min, 保鲜膜包裹后, 经X光片曝光, 显影和定影, 显现特异的蛋白信号. 激光光密度仪扫描, 所得p-ERK1/2蛋白带的综合密度除以伤前相对应样的综合密度的比值, 即相对A值代表蛋白的相对表达量.
在烧伤后6 h时EN组和EN+Gln组动物血浆D-乳酸浓度较伤前均升高, 在实验所观察时间内EN组均高于伤前水平(P<0.01或P<0.05); EN+Gln组在48和96 h时D-乳酸浓度与伤前比较差异无显著性意义(P>0.05), 组间对照EN+Gln组在48和96 h时D-乳酸浓度明显低于EN组(P<0.05), 说明补充Gln的肠内营养能降低血浆D-乳酸浓度(表1).
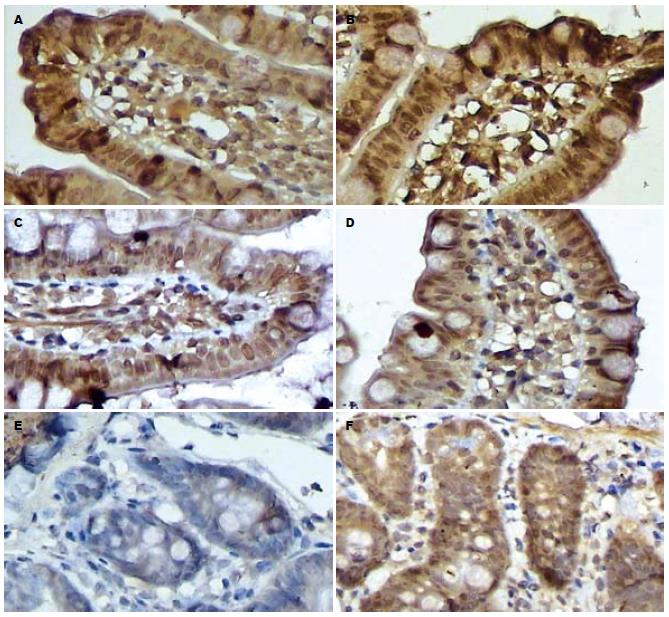
烧伤后肠绒毛p-ERK1/2阳性细胞百分升高, EN组和EN+Gln组在伤后12 h与伤前比较均明显升高(P<0.01或P<0.05); 组间比较EN+Gln组在24, 48和96 h时p-ERK1/2阳性细胞明显高于EN组(P<0.05)(表2).
在烧伤后EN组和EN+Gln组肠绒毛p-ERK1/2阳性细胞百分比较伤前均显著升高(P<0.01或P<0.05); 组间比较EN+Gln组在24, 48和96 h时p-ERK阳性细胞与EN组相比均显著升高(P<0.05). 隐窝p-ERK阳性细胞百分比较伤前均升高(P<0.01或P<0.05)(表3).
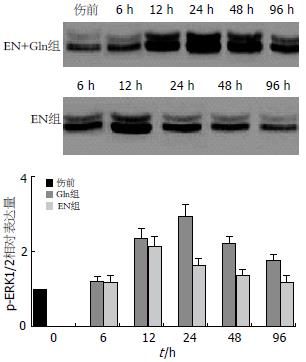
Western blot分析显示, 烧伤后p-ERK1/2蛋白表达的水平升高, EN组在伤后12 h达到最高后逐渐下降; EN+Gln组在24 h时达到峰值后逐渐下降; 在伤后24, 48 h时EN+Gln组p-ERK1/2表达明显高于EN组(P<0.01或P<0.05), 说明补充Gln的肠内营养能促进伤后p-ERK1/2蛋白的表达(图1-2).
严重烧伤后机体呈低血容量状态, 在烧伤等应激状态下, 在各种细胞因子、激素作用下以高代谢为特征, 机体组织血流发生改变; 因局部营养物质、供氧不足和细胞因子的瀑式释放等使肠道黏膜及其屏障功能受损; 近来的研究表明, 创伤后Gln补给能通过自身代谢和调节细胞增生分化的作用, 以维护肠黏膜细胞、保持肠黏膜屏障的功能. ERK1/2在胞质内分布广泛, 已证明p-ERK1/2途径是成纤维细胞、角质细胞、IEC-6等细胞增生的主要细胞内信号传导通路[2]. 在未受刺激的细胞内主要表现为脱磷酸型, 其苏氨酸和酪氨酸残基被磷酸化后发生激活, 对机体细胞的生长、分化和增殖过程中发挥重要的调控作用[3], p-ERK1/2被激活后, 可以表现为持久激活或短暂激活, 持久激活(活性高)的p-ERK1/2可部分转入核内, 可以使相应的转录因子发生磷酸化, 而短暂激活(活性低)的p44/42 MAPK不能进入核内, 二者由于"入核量"的差异使细胞表达不同质或量的产物, 从而产生不同的细胞生物学效应, 因此ERK1/2在转录水平上的差异可以使其产生不同的效应.
本实验中在伤前大鼠的回肠黏膜上皮细胞内, p-ERK1/2主要存在于胞质中, 核内少量表达. 烧伤后肠上皮和小肠隐窝阳性细胞的比例显著增加, 表明烧伤后机体的应激可以激活p-ERK1/2通路. 在实验各个时间点免疫组化切片可见小肠绒毛和隐窝处p-ERK1/2阳性细胞均明显高于伤前; Western blot半定量分析显示, 在EN组p-ERK1/2的表达在伤后6 h升高后逐步下降, 而在Gln组则在24 h时再次升高并持续一定时间; 对此我们推测p-ERK1/2的表达在6 h时的上升主要是由烧伤后机体的应激状态引起; Gln组出现再次升高是肠内补充Gln的结果. Gln是快速增殖细胞如肠上皮细胞、淋巴细胞的主要能量来源, 众多的研究显示, Gln在肠黏膜代谢和维护中的作用, 如参与葡萄糖三羧酸循环、氧化生成ATP供能, 参与黏膜细胞核酸及蛋白质的合成代谢, 促进肠黏膜细胞的更新和再生, 保持其超微结构的完整性[4]. 在烧伤后机体对Gln的需求量远远超过体内合成Gln的能力, 可使肠道黏膜萎缩、绒毛变稀变矮, 肠黏膜屏障功能下降. 在近几年的临床和动物实验中发现, 补充Gln后能明显增加大鼠肠黏膜的质量、DNA和RNA含量, 恢复绒毛高度、黏膜表面积和隐窝深度, 增加隐窝细胞的有丝分裂, 加快肠上皮细胞更新速度, 增强修复能力, 并能增强细胞间的紧密连结, 减少上皮细胞的凋亡, 阻止肠黏膜萎缩及炎症所致的通透性增加, 从而恢复并维持黏膜形态和功能的完整性[5]. 但对于其作用的具体机制目前尚无具体的报道. Wiren et al[6]利用肠切除的动物模型观察早期肠内谷氨酰胺补给对回肠黏膜表皮细胞生长因子(EGF)、胰岛素样生长因子-Ⅱ(IGF-Ⅱ)的影响, 发现Gln能特异性增加两者的水平. EGF是强有力的促细胞分裂因子, 对肠黏膜细胞具有促进生长和增生的作用[7-8], p-ERK1/2转导通路被认为是EGF调节细胞生长和增生的一个关键通路[9], 在EGF等生长因子刺激引起的细胞反应中起重要调控作用[10]. 体外研究证实, EGF可以通过激活p-ERK1/2通路促进小肠上皮细胞的增生反应[11-13], 因此我们推测Gln组p-ERK1/2在24 h时再次升高可能是Gln补充引起EGF增加的结果.
D-乳酸是肠道细菌特有的代谢产物, 在肠道应激缺血时, 肠道细菌产生的大量D-乳酸可通过受损的肠黏膜进入血循环, 引起血浆D-乳酸水平升高. 在本实验中我们发现, 烧伤后D-乳酸均升高, Gln组在48和96 h时D-乳酸浓度基本恢复正常, 说明Gln早期肠内补给能改善肠黏膜屏障功能. 这可能与Gln在的直接作用及间接调控有关. 最新研究表明, Gln可以作为信号分子和生存因子, 起到减轻炎症反应和抗细胞凋亡的作用, 更为重要的是有试验证实Gln可以诱导HSP70的产生, 提高细胞生存能力[14-29]; 另一方面, 在应激、感染等情况下, 由于钙耗竭等因素导致上皮细胞间紧密连接的重要成分Occludin去磷酸化而致紧密连接蛋白(TJ)的破坏[30]; 而Basuroy et al[31]利用Caco-2细胞的体外培养体系发现, p-ERK1/2直接和Occludin的C末端相互作用, 阻止Occludin苏氨酸残基的去磷酸化, 引起TJ蛋白及其相关信号分子的磷酸化, 从而上调上皮细胞间TJ的表达, 维护肠黏附的完整性及其屏障功能. 我们通过Western blot法分析了肠黏膜中p-ERK1/2表达的变化, 发现Gln补充24 h后再次升高且持续一定的时间, 上述变化对于局部屏障功能的维护无疑是有益的, 这也可能是Gln组D-乳酸浓度下降的重要原因.
总之, 烧伤后早期肠内补给Gln能促进p-ERK1/2的表达, 从而促进肠黏膜细胞的增殖活化, 改善肠黏膜的屏障功能. 这也可能是Gln改善伤后肠道功能的重要机制之一.
严重烧伤后早期肠内营养, 维护肠 黏膜屏障功能, 减少肠内细菌、内毒素移位, 同时提 高机体免疫功能, 己成为治疗的关键. 肠黏膜屏障功能的维护除应有良好的血供、氧供外, 还应促进肠 黏膜细胞的生长与修复. 肠内免疫营养剂中的谷氨酰胺是肠黏膜细胞的组织特需营养物质, 加之肠黏 膜细胞必须从肠腔内获得营养与在食糜的刺激下才能增长, 这是肠外营养所不能, 故免疫营养配方多为肠内营养, 具有维护肠黏膜屏障功能的作用, 是未来首选的营养支持途径.
本研究根据免疫营养理论, 将Gln加入肠内营养剂能全力(Nutricia公司), 应用于烫伤动物模型, 通过与单纯应用肠内营养剂能全力(Nutricia公司)的比较, 采用免疫组化、蛋白印迹等先进研究方法和检测手段, 观察肠内免疫营养对烫伤大鼠回肠黏膜细胞p-ERK1/2的表达, 从分子生物学和细胞学水平, 探讨肠内免疫营养对严重烫伤后肠黏膜机械屏障功能的影响及其可能机制, 为严重烧伤患者营养支持和免疫功能紊乱的治疗提供理论依据据. 据Internet检索, 目前未见相关报道
本文描述了早期内谷氨酰胺补给对烫伤大鼠回 p-ERK通路的影响, 总体上书写比较流畅, 有一定科学性.
电编: 张敏 编辑:王晓瑜
| 2. | Thrane EV, Schwarze PE, Thoresen GH, Lag M, Refsnes M. Persistent versus transient map kinase (ERK) activation in the proliferation of lung epithelial type 2 cells. Exp Lung Res. 2001;27:387-400. [PubMed] |
| 3. | Zhao D, Letterman J, Schreiber BM. beta-Migrating very low density lipoprotein (beta VLDL) activates smooth muscle cell mitogen-activated protein (MAP) kinase via G protein-coupled receptor-mediated transactivation of the epidermal growth factor (EGF) receptor: effect of MAP kinase activation on beta VLDL plus EGF-induced cell proliferation. J Biol Chem. 2001;276:30579-30588. [PubMed] |
| 4. | Coster J, McCauley R, Hall J. Glutamine: metabolism and application in nutrition support. Asia Pac J Clin Nutr. 2004;13:25-31. [PubMed] |
| 5. | Ding LA, Li JS. Effects of glutamine on intestinal permeability and bacterial translocation in TPN-rats with endotoxemia. World J Gastroenterol. 2003;9:1327-1332. [PubMed] |
| 6. | Wiren M, Adrian TE, Arnelo U, Permert J, Staab P, Larsson J. Early gastrointestinal regulatory peptide response to intestinal resection in the rat is stimulated by enteral glutamine supplementation. Dig Surg. 1999;16:197-203. [PubMed] |
| 7. | Berlanga-Acosta J, Playford RJ, Mandir N, Goodlad RA. Gastrointestinal cell proliferation and crypt fission are separate but complementary means of increasing tissue mass following infusion of epidermal growth factor in rats. Gut. 2001;48:803-807. [PubMed] |
| 8. | Reindel JF, Gough AW, Pilcher GD, Bobrowski WF, Sobocinski GP, de la Iglesia FA. Systemic proliferative changes and clinical signs in cynomolgus monkeys administered a recombinant derivative of human epidermal growth factor. Toxicol Pathol. 2001;29:159-173. [PubMed] |
| 9. | Krueger JS, Keshamouni VG, Atanaskova N, Reddy KB. Temporal and quantitative regulation of mitogen-activated protein kinase (MAPK) modulates cell motility and invasion. Oncogene. 2001;20:4209-4218. [PubMed] |
| 10. | Sah JF, Eckert RL, Chandraratna RA, Rorke EA. Retinoids suppress epidermal growth factor-associated cell proliferation by inhibiting epidermal growth factor receptor-dependent ERK1/2 activation. J Biol Chem. 2002;277:9728-9735. [PubMed] |
| 11. | Tanimura S, Nomura K, Ozaki K, Tsujimoto M, Kondo T, Kohno M. Prolonged nuclear retention of activated extracellular signal-regulated kinase 1/2 is required for hepatocyte growth factor-induced cell motility. J Biol Chem. 2002;277:28256-28264. [PubMed] |
| 12. | Lewis MD, Ham J, Rees DA, Lewis BM, Scanlon MF. Mitogen-activated protein kinase mediates epidermal growth factor-induced morphogenesis in pituitary GH3 cells. J Neuroendocrinol. 2002;14:361-367. [PubMed] |
| 13. | Marques SA, Dy LC, Southall MD, Yi Q, Smietana E, Kapur R, Marques M, Travers JB, Spandau DF. The platelet-activating factor receptor activates the extracellular signal-regulated kinase mitogen-activated protein kinase and induces proliferation of epidermal cells through an epidermal growth factor-receptor-dependent pathway. J Pharmacol Exp Ther. 2002;300:1026-1035. [PubMed] |
| 14. | Wischmeyer PE, Riehm J, Singleton KD, Ren H, Musch MW, Kahana M, Chang EB. Glutamine attenuates tumor necrosis factor-alpha release and enhances heat shock protein 72 in human periphe-ral blood mononuclear cells. Nutrition. 2003;19:1-6. [PubMed] |
| 15. | Peng ZY, Hamiel CR, Banerjee A, Wischmeyer PE, Friese RS, Wischmeyer P. Glutamine attenuation of cell death and inducible nitric oxide synthase expression following inflammatory cytokine-induced injury is dependent on heat shock factor-1 expression. JPEN J Parenter Enteral Nutr. 2006;30:400-406; discussion 406-407. [PubMed] |
| 16. | Morrison AL, Dinges M, Singleton KD, Odoms K, Wong HR, Wischmeyer PE. Glutamine's protection against cellular injury is dependent on heat shock factor-1. Am J Physiol Cell Physiol. 2006;290:C1625-1632. [PubMed] |
| 17. | Singleton KD, Serkova N, Beckey VE, Wischmeyer PE. Glutamine attenuates lung injury and improves survival after sepsis: role of enhanced heat shock protein expression. Crit Care Med. 2005;33:1206-1213. [PubMed] |
| 18. | Singleton KD, Serkova N, Banerjee A, Meng X, Gamboni-Robertson F, Wischmeyer PE. Glutamine attenuates endotoxin-induced lung metabolic dysfunction: potential role of enhanced heat shock protein 70. Nutrition. 2005;21:214-223. [PubMed] |
| 19. | Peng ZY, Serkova NJ, Kominsky DJ, Brown JL, Wischmeyer PE. Glutamine-mediated attenuation of cellular metabolic dysfunction and cell death after injury is dependent on heat shock factor-1 expression. JPEN J Parenter Enteral Nutr. 2006;30:373-378; discussion 379. [PubMed] |
| 20. | Wischmeyer PE. Glutamine: role in gut protection in critical illness. Curr Opin Clin Nutr Metab Care. 2006;9:607-612. [PubMed] |
| 21. | Wischmeyer PE. The glutamine story: where are we now? Curr Opin Crit Care. 2006;12:142-148. [PubMed] |
| 22. | Wischmeyer PE. Glutamine: the first clinically relevant pharmacological regulator of heat shock protein expression? Curr Opin Clin Nutr Metab Care. 2006;9:201-206. [PubMed] |
| 23. | Wischmeyer PE. Glutamine and heat shock protein expression. Nutrition. 2002;18:225-228. [PubMed] |
| 24. | Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine induces heat shock protein and protects against endotoxin shock in the rat. J Appl Physiol. 2001;90:2403-2410. [PubMed] |
| 25. | Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine reduces cytokine release, organ damage, and mortality in a rat model of endotoxemia. Shock. 2001;16:398-402. [PubMed] |
| 26. | Wischmeyer PE. Clinical applications of L-glutamine: past, present, and future. Nutr Clin Pract. 2003;18:377-385. [PubMed] |
| 27. | Ko YG, Kim EY, Kim T, Park H, Park HS, Choi EJ, Kim S. Glutamine-dependent antiapoptotic interaction of human glutaminyl-tRNA synthetase with apoptosis signal-regulating kinase 1. J Biol Chem. 2001;276:6030-6036. [PubMed] |
| 28. | Exner R, Weingartmann G, Eliasen MM, Gerner C, Spittler A, Roth E, Oehler R. Glutamine deficiency renders human monocytic cells more susceptible to specific apoptosis triggers. Surgery. 2002;131:75-80. [PubMed] |
| 29. | Hayashi Y, Sawa Y, Fukuyama N, Nakazawa H, Matsuda H. Preoperative glutamine administration induces heat-shock protein 70 expression and attenuates cardiopulmonary bypass-induced inflammatory response by regulating nitric oxide synthase activity. Circulation. 2002;106:2601-2607. [PubMed] |
| 30. | Simonovic I, Rosenberg J, Koutsouris A, Hecht G. Enteropathogenic Escherichia coli dephosphorylates and dissociates occludin from intestinal epithelial tight junctions. Cell Microbiol. 2000;2:305-315. [PubMed] |