修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-02-08
目的: 探讨白藜芦醇(Res)对胃癌细胞SGC7901增殖与凋亡的影响.
方法: MTT法检测不同浓度(0, 10, 20, 50, 100, 200 μmol/L)Res处理24, 48, 72 h对SGC7901细胞的抑制率. 流式细胞仪采用AnnexinⅤ和PI双染检测细胞的早期凋亡率. 电镜扫描观察SGC7901细胞形态学改变, 分光光度法检测caspase-3活性.
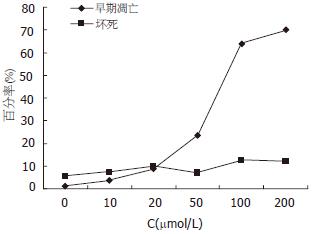
结果: Res在20-300 μmol/L浓度范围内, 以浓度和剂量依赖的方式抑制胃癌细胞的增殖(P<0.01). 经0, 10, 20, 50, 100, 200 μmol/L Res处理24 h后, 细胞凋亡率分别为1.17%, 3.73%, 8.75%, 23.35%, 63.97%和70.10%, 晚期凋亡和坏死的细胞比例分别为5.66%, 7.22%, 9.86%, 6.91%, 12.51%及11.98%, 各组之间差异不大. 电镜下见到典型的细胞凋亡的形态学改变. 100 μmol/L Res处理后6 h caspase-3活性增加, 18 h达高峰, 24 h后下降, 48 h仍高于正常(0.135±0.036 vs 0.069±0.008, P<0.05). 经20, 50, 100 μmol/L Res处理18 h后的细胞的caspase-3活性分别为0.169±0.017, 0.247±0.028, 0.353±0.044 (P<0.01), 较对照组(0.063±0.006)分别增加2.68倍、3.92倍和5.61倍.
结论: Res通过诱导caspase-3活性增加以时间依赖和浓度依赖的方式抑制SGC7901细胞增殖, 诱导细胞凋亡.
引文著录: 王学清, 王贺玲, 李岩, 田丰, 王颖. 白藜芦醇对胃癌细胞SGC7901增殖与凋亡的影响. 世界华人消化杂志 2007; 15(4): 340-345
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: February 8, 2007
AIM: To investigate the effect of resveratrol on the proliferation and apoptosis of gastric cancer cell line SGC7901.
METHODS: Gastric cancer cell line SGC7901 was cultured and treated with different concentrations (0, 10, 20, 50, 100, 200 mmol/L) of resveratrol for 24, 48 and 72 hours. The growth inhibition rate of SGC7901 cells was detected by MTT method, and cell apoptosis was analyzed by flow cytometry (FCM) using annexin V/propidium iodide (PI) double staining. The morphological changes of SGC7901 cells were observed by electron microscopy, and caspase-3 activity was assessed by colorimetric assay.
RESULTS: Resveratrol inhibited the proliferation of SGC7901 cells in a time- and concentration-dependent manner ranging from 20 to 300 mmol/L (P < 0.01). After resveratrol treatment at 0, 10, 20, 50, 100, and 200 mmol/L for 24 hours, the apoptosis rate of SGC7901 cells was 1.17%, 3.73%, 8.75%, 23.35%, 63.97% and 70.10%, while the necrosis rate was 5.66%, 7.22%, 9.86%, 6.91%, 12.51% and 11.98%, respectively. Electron microscopy showed typical morphological changes in SGC7901 cells. After 100 mmol/L resveratrol treatment for 6 hours, the activity of caspase-3 was increased, and reached the peak at the 18th hour, then declined gradually. Caspase-3 activity was still higher at the 48th hour than the normal level (0.135 ± 0.036 vs 0.069 ± 0.008, P < 0.05). After SGC7901 cells were treated with 20, 50, and 100 mmol/L resveratrol for 18 hours, the activity of caspase-3 was 2.68, 3.92 and 5.61 folds as high as that in control group (0.169 ± 0.017, 0.247 ± 0.028, 0.353 ± 0.044 vs 0.063 ± 0.006, P < 0.01).
CONCLUSION: Resveratrol can inhibit the proliferation and induce apoptosis of SGC7901 cells in concentration- and time- dependent manners by increasing caspase-3 activity.
- Citation: Wang XQ, Wang HL, Li Y, Tian F, Wang Y. Effect of resveratrol on the proliferation and apoptosis of gastric cancer cell line SGC7901. Shijie Huaren Xiaohua Zazhi 2007; 15(4): 340-345
- URL: https://www.wjgnet.com/1009-3079/full/v15/i4/340.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i4.340
白藜芦醇(resveratrol, Res)是广泛存在于葡萄、花生和虎杖等多种药用植物中的一种多酚类化合物. 最近的研究表明, Res具有广泛的预防和抗肿瘤作用, 他对白血病、甲状腺癌、乳腺癌、肝癌等多种癌瘤细胞均具有明显的抑制作用[1-10]. 但目前, 国际上对Res在胃癌的研究还远未深入. 本实验研究Res对胃癌细胞SGC7901增殖与凋亡及其对caspase-3活性的影响, 旨在探讨Res对胃癌潜在的治疗作用.
人胃癌细胞株SGC7901购于中国医科大学细胞生物教研室. Res购自Sigma公司, 纯度99%, 用DMSO溶解配成100 mmol/L的原溶液, -20℃避光保存备用. 实验前以RPMI1640培养液稀释成不同浓度, DMSO终浓度<5 mL/L. AnnexinⅤ荧光试剂盒购自晶美生物技术有限公司. 四甲基偶氮唑蓝(MTT)临用前用PBS(pH 7.4)配成5 g/L溶液. caspase-3活性分光光度计检测试剂盒购于南京凯基生物公司.
人胃癌细胞株SCG7901接种于无菌培养瓶中, 加入含100 mL/L胎牛血清的RPMI1640培养基(含有青霉素100 U/mL和链霉素100 U /mL), 在37℃、50 mL/L CO2及饱和湿度培养箱中培养.
1.2.1 MTT法检测不同浓度Res对SCG7901细胞的生长抑制作用: 取处于对数生长期的SCG7901细胞调整细胞密度为4-5×107/L, 接种于96孔板, 细胞贴壁后, 实验组加入不同浓度的Res, 使其终浓度分别为5.0, 10, 20, 50, 100, 200, 300 μmol/L, 对照组则加等量不含药物的培养液, 另设二甲基亚砜对照组加入含3 g/L的二甲基亚砜的培养液, 空白对照孔加入200 μL培养基作本底, 对照调零. 每个剂量3个平行孔. 于24, 48, 72 h, 各取一块96孔培养板中, 每孔加入新鲜配制的浓度为5 g/L的MTT 20 μL. 继续培养3 h后取出培养皿, 小心吸弃培养基, 每孔加DMSO 150 μL, 轻轻震荡10 min后, 用酶联仪于490 nm处测出各孔吸光度值(A值), 按下式计算细胞抑制率: 细胞抑制率(%) = (1-给药孔平均A值/对照孔平均A值)×100%. 实验重复3次.
1.2.2 流式细胞仪(FCM): AnnexinⅤ荧光染色检测细胞凋亡 以0, 10, 20, 50, 100和200 μmol/L Res处理24 h的细胞, 分别消化收集各组细胞, 调整细胞浓度至1×1010/L各取100 μL; PBS洗涤两次后, 弃上清液; 加入预冷的结合缓冲液100 μL重悬细胞, 置冰浴; 加入5 μL AnnexinⅤ/FITC和10 μL PI于细胞悬液中, 轻轻混匀; 将试管置于室温避光染色15 min; 补加400 μL结合缓冲液混悬细胞, 流式细胞仪进行检测, 分析细胞凋亡的百分比.
1.2.3 电镜观察: 将100 μmol/L Res处理24 h的细胞用25 g/L戊二醛固定2 h, 10 g/L锇酸固定1.5 h, 逐级酒精脱水, 氧化丙烯浸透, 树脂包埋, 超薄切片机切片, 于透射电子显微镜下观察. 按常规电镜要求制备标本, 600-800 nm的超薄切片收集于带膜的铜网上, 经铀、铅电子染色后观察.
1.2.4 caspase-3活性检测: 分别收集0, 20, 50和100 μmol/L Res处理12 h以及100 μmol/L Res处理6, 12, 18, 24和48 h的细胞2×106个, PBS洗细胞2次, 加入50 μL预冷的细胞裂解液, 冰上孵育20 min, 4℃, 10 000 r/min离心1 min, 回收上清, 测定蛋白浓度, 吸取蛋白裂解上清, 加入50 μL的2×反应缓冲液、5 μL caspase-3底物DEVD-pNA 5 μL, 37℃孵育30 min, 分光光度仪405 nm波长测定吸光度值, 以此表示caspase-3的相对活性.
统计学处理 本实验所有数据用mean±SD表示, 采用t检验进行差异性分析.
Res在10 μmol/L以下对胃癌细胞生长无显著影响, 在20-300 μmol/L浓度范围内, 作用24 h后, 对胃癌细胞的增殖有显著的抑制作用(P<0.01), 并且随着浓度的增加, 对细胞的抑制率也逐渐增加. 同一浓度Res的对胃癌细胞的抑制作用随着时间的延长也逐渐增强(表1).
| 分组 | 24 h | 48 h | 72 h | |
| 对照组 | 0±8.36 | 0±7.12 | 0±6.88 | |
| DMSO | 1.46±5.17 | -1.94±6.87 | 0.95±10.02 | |
| 5 | 3.11±11.69 | 4.70±9.85 | 1.30±9.62 | |
| 10 | 5.49±8.35 | 4.21±8.50 | 3.85±4.99 | |
| 20 | 11.09±7.35 | 19.87±6.83b | 25.20±7.64b | |
| Res(μmol/L) | 50 | 22.06±7.21b | 27.98±7.55b | 33.94±6.44b |
| 100 | 28.99±11.04b | 36.22±7.19b | 42.48±9.84b | |
| 200 | 42.33±10.03b | 49.99±12.43b | 57.34±8.64b | |
| 300 | 58.60±8.12b | 66.233±12.75b | 70.22±9.10b |
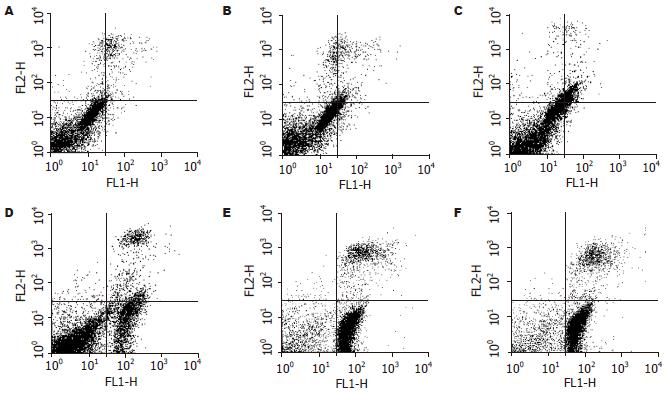
FCM分析检测细胞为4亚群, 正常细胞胞膜完整, 磷脂酰丝氨酸基团(PS)无外化, AnnexinⅤ/FITC不能与之结合, PI不能进入胞内, 为AV-/PI-亚群; 早期凋亡细胞胞膜完整, 但PS外化, 为AV+/PI-亚群; 晚期凋亡和坏死细胞, 为AV+/PI+亚群; 还有部分收集过程中出现损伤的损伤细胞(AV-/PI+-).
经10, 20, 50, 100, 200 μmol/L Res处理24 h后和对照组的细胞, 凋亡率分别为3.73%, 8.75%, 23.35%, 63.97%, 70.10%和1.17%, 提示Res作用后的SGC7901细胞产生明显凋亡, 并有浓度依赖性. 经10, 20, 50, 100, 200 μmol/L Res处理24 h后和对照组的细胞, 晚期凋亡和坏死的细胞比例分别为7.22%, 9.86%, 6.91%, 12.51%, 11.98%及5.66%, 各组之间变化不大(图1-2).
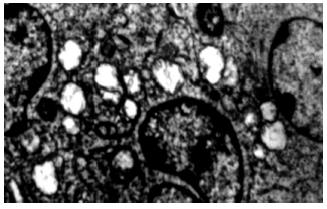
100 μmol/L Res处理后的细胞可见到典型的细胞凋亡性改变, 细胞核缩小, 染色质凝集, 细胞表面形成许多球形突起(起泡), 突起内见被包裹的胞质与细胞器、核的碎片或整个浓缩的细胞核, 部分突起与细胞脱离, 形成凋亡小体(apoptotic bodies)(图3).
100 μmol/L Res处理不同时间后的caspase-3活性变化见表2, Res处理后6 h caspase-3活性增加, 18 h达高峰, 24 h后下降, 48 h仍高于正常. 经20, 50, 100 μmol/L Res处理18 h后的细胞的caspase-3活性分别为0.169±0.017, 0.247±0.028, 0.353±0.044(P<0.01), 较对照组(0.063±0.006)分别增加2.68倍、3.92倍和5.61倍.
Res的化学名为3, 4', 5三羟基反均二苯代乙烯, 分子式C14H12O3, 分子质量228.25, 属于非黄酮类多酚化合物, 广泛存在于种子植物中, 并以新鲜葡萄皮中含量最高, 在我国, 则以中药植物虎杖中含量最为丰富. Res对植物本身起保护作用, 是植物在不利条件下, 如紫外线照射、真菌感染、以及机械性损伤所产生的"植物补体". 随着研究的深入, 人们发现Res对人类具有抗肿瘤特性和抗氧化性、抗突变作用, 可显著抑制多种人类肿瘤细胞的生长、诱导肿瘤细胞凋亡[3-13]. Chow et al[14]研究发现, 白藜芦醇以剂量依赖的方式抑制横纹肌肉瘤细胞RD细胞增殖, 并诱导细胞周期S/G2期捕获. 白藜芦醇能通过抑制CDK7蛋白激酶的活力、细胞分化、细胞周期的G2期抑制结肠癌细胞HT129, SW480的增殖[15], 可通过NF-κB和钙蛋白酶活性引起的磷酸肌醇3-激酶(PI3K)途经信号抑制, 下调Bcl-2诱导MCF-7人乳腺癌细胞凋亡[16], 以剂量依赖的方式抑制前列腺癌DU145细胞生长诱导凋亡[17].
本研究通过MTT法研究表明, 在20-300 μmol/L的浓度范围内, Res对SGC7901细胞的增殖有抑制作用, 并且表现出时间依赖性和浓度依赖性. AnnexinⅤ是Ca2+依赖性磷脂结合蛋白家族中的一员, AnnexinⅤ与磷脂酰丝氨酸基团(PS)有高特异性结合, PS从细胞膜的脂双层内层迁移至外层是细胞凋亡级联反应的初始事件, 利用AnnexinⅤ高度亲和PS可早期检测凋亡的发生. 本研究中, AnnexinⅤ和PI双染提示20-200 μmol/L处理胃癌细胞24 h后, 凋亡细胞数明显增多, 并且有浓度依赖性, 而坏死的细胞数变化不如凋亡率显著, 说明在该浓度范围内诱导胃癌细胞凋亡效应要强于引起细胞坏死的作用, 进一步证实诱导细胞凋亡是杀伤胃癌细胞的作用机制之一. 我们经过电镜检测发现Res处理后的细胞形态不完整, 细胞核固缩、裂解成细胞膜包绕的碎片, 且有凋亡小体出现, 表现出典型的凋亡的形态改变.
细胞凋亡可由死亡受体途径和线粒体细胞色素C途径所介导. 死亡受体通过与"死亡配体"特异性结合后将凋亡信号由胞外传入胞内, 在连接分子的媒介下, 引起上游procaspase-8的激活, 导致procaspase-9激活, 最终导致caspase-3, caspase-7激活, 进而裂解DNA损伤细胞, 引起细胞凋亡. 细胞凋亡还可通过细胞色素C途径. 细胞色素C从线粒体内释放是关键的一步. 在细胞凋亡信号的刺激下, 线粒体功能障碍, 膜通透性改变, 凋亡蛋白包括细胞色素C, Apaf1(apoptotic protease activating factor1)等从线粒体释放到胞质中, 胞质内的细胞色素C在dATP存在下, 与信号接头分子Apaf1结合, 募集并激活caspase-9,继而活化caspase-3, 启动caspase的级联反应,引起细胞凋亡. 作为凋亡过程中的效应分子, caspase-3既是线粒体途径又是死亡受体途径两条信号途径的共同通道, 二者一旦启动, 必然引起的caspase-3级联反应并使其活化, 引起细胞凋亡. 因此, caspase-3的表达增加标志着细胞内的凋亡机制已经启动.
Res是一种生物活性成分, 近年来发现其诱导一些肿瘤细胞凋亡中都有caspase-3的参与[17-26]. Cao et al[27]发现白藜芦醇引起急性白血病细胞凋亡需要caspase-3激活. 用Res处理脑胶质瘤U251细胞有caspase-3的活化, 而且Res诱导的DNA断裂能完全被一般的caspase抑制剂(Z-VAD-FMK)或选择性caspase-3抑制剂(Z-DEVD-FMK)阻断[28]. 那么Res诱导胃癌SGC7901细胞凋亡的过程中是否有caspase-3的活化呢? 本文用不同浓度的Res处理SGC7901细胞, 细胞内caspase-3活性随着作用时间的延长显著增加, 且有浓度依赖性, 表明在Res诱导胃癌SGC7901凋亡的过程中有caspase-3的活化.
细胞凋亡是细胞自身调节的一个程序性死亡过程, 他不引起炎症反应, 机体亦不会因此而引发不良现象. 因此细胞凋亡是肿瘤治疗研究中的一个重要环节. 白藜芦醇不仅能抑制肿瘤细胞增殖、诱导凋亡, 而且能增强放射诱导的白血病细胞株EOL-1凋亡[29]. 在特定的肿瘤中白藜芦醇是一种潜在的TRAIL敏感剂, 通过G1细胞周期捕获和survivin减少增强TRAIL诱导的凋亡[30]. 在白血病的联合化疗中, 白藜芦醇与细胞毒化疗药物协同发挥作用, 抑制生长、诱导凋亡[31-32]. 本实验证明Res能抑制胃癌细胞SGC7901生长, 诱导caspase-3激活引起细胞凋亡, 表明他对治疗胃癌有着很好的应用前景. 虽然Res对治疗胃癌的前景较好, 但是毒性实验、动物实验、体内临床实验都还需要验证, 对于Res抑制胃癌细胞生长并诱导凋亡的具体机制的研究也是很必要的.
白藜芦醇的抗肿瘤机制比较复杂, 可能是几种机制共同作用的结果, 也可能还有其他未知途径, 发挥作用的时间、浓度也因不同细胞类型而不同, 这可能与不同类型细胞的信号传递方式、细胞周期的分布差异有关. 但迄今为止, 其诱导肿瘤细胞凋亡分子水平的具体机制, 尚存在一定的争议, 甚至得出了一些看似矛盾的结论. 尽管近年来, 对白藜芦醇抗肿瘤的机制进行了一定的研究, 但白藜芦醇对胃癌的作用报道较少, 尤其是白藜芦醇对胃癌增殖的影响及其分子机制.
本文用不同浓度的Res 处理SGC7 901细胞, 细胞内caspase-3活性随着作用时间的延长显著增加, 且有浓度依赖性, 表明在Res诱导胃癌SGC7901凋亡的过程中有 caspase-3的活化,为白藜芦醇的开发和临床应用提供科学的理论依据.
本文探讨白藜芦醇(Res)对胃癌细胞SGC7901增殖与凋亡的影响, 有一定创新性, 且实 验设计尚合理, 结果可靠, 有一定说服力.
电编: 张敏 编辑:张焕兰
| 1. | Tyagi A, Singh RP, Agarwal C, Siriwardana S, Sclafani RA, Agarwal R. Resveratrol causes Cdc2-tyr15 phosphorylation via ATM/ATR-Chk1/2-Cdc25C pathway as a central mechanism for S phase arrest in human ovarian carcinoma Ovcar-3 cells. Carcinogenesis. 2005;26:1978-1987. [PubMed] |
| 2. | Chen Y, Tseng SH, Lai HS, Chen WJ. Resveratrol-induced cellular apoptosis and cell cycle arrest in neuroblastoma cells and antitumor effects on neuroblastoma in mice. Surgery. 2004;136:57-66. [PubMed] |
| 3. | Marier JF, Chen K, Prince P, Scott G, del Castillo JR, Vachon P. Production of ex vivo lipopolysaccharide-induced tumor necrosis factor-alpha, interleukin-1beta, and interleukin-6 is suppressed by trans-resveratrol in a concentration-dependent manner. Can J Vet Res. 2005;69:151-154. [PubMed] |
| 4. | Aggarwal BB, Bhardwaj A, Aggarwal RS, Seeram NP, Shishodia S, Takada Y. Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies. Anticancer Res. 2004;24:2783-2840. [PubMed] |
| 5. | Ulrich S, Wolter F, Stein JM. Molecular mechanisms of the chemopreventive effects of resveratrol and its analogs in carcinogenesis. Mol Nutr Food Res. 2005;49:452-461. [PubMed] |
| 6. | Aziz MH, Reagan-Shaw S, Wu J, Longley BJ, Ahmad N. Chemoprevention of skin cancer by grape constituent resveratrol: relevance to human disease? FASEB J. 2005;19:1193-1195. [PubMed] |
| 7. | Le Corre L, Chalabi N, Delort L, Bignon YJ, Bernard-Gallon DJ. Resveratrol and breast cancer chemoprevention: molecular mechanisms. Mol Nutr Food Res. 2005;49:462-471. [PubMed] |
| 8. | Pervaiz S. Chemotherapeutic potential of the chemopreventive phytoalexin resveratrol. Drug Resist Updat. 2004;7:333-344. [PubMed] |
| 9. | Levi F, Pasche C, Lucchini F, Ghidoni R, Ferraroni M, La Vecchia C. Resveratrol and breast cancer risk. Eur J Cancer Prev. 2005;14:139-142. [PubMed] |
| 10. | Boissy P, Andersen TL, Abdallah BM, Kassem M, Plesner T, Delaisse JM. Resveratrol inhibits myeloma cell growth, prevents osteoclast formation, and promotes osteoblast differentiation. Cancer Res. 2005;65:9943-9952. [PubMed] |
| 11. | Zhou HB, Yan Y, Sun YN, Zhu JR. Resveratrol induces apoptosis in human esophageal carcinoma cells. World J Gastroenterol. 2003;9:408-411. [PubMed] |
| 12. | Liu HS, Pan CE, Yang W, Liu XM. Antitumor and immunomodulatory activity of resveratrol on experimentally implanted tumor of H22 in Balb/c mice. World J Gastroenterol. 2003;9:1474-1476. [PubMed] |
| 13. | Yu L, Sun ZJ, Wu SL, Pan CE. Effect of resveratrol on cell cycle proteins in murine transplantable liver cancer. World J Gastroenterol. 2003;9:2341-2343. [PubMed] |
| 14. | Chow AW, Murillo G, Yu C, van Breemen RB, Boddie AW, Pezzuto JM, Das Gupta TK, Mehta RG. Resveratrol inhibits rhabdomyosarcoma cell proliferation. Eur J Cancer Prev. 2005;14:351-356. [PubMed] |
| 15. | Liang YC, Tsai SH, Chen L, Lin-Shiau SY, Lin JK. Resveratrol-induced G2 arrest through the inhibition of CDK7 and p34CDC2 kinases in colon carcinoma HT29 cells. Biochem Pharmacol. 2003;65:1053-1060. [PubMed] |
| 16. | Pozo-Guisado E, Merino JM, Mulero-Navarro S, Lorenzo-Benayas MJ, Centeno F, Alvarez-Barrientos A, Fernandez-Salguero PM. Resveratrol-induced apoptosis in MCF-7 human breast cancer cells involves a caspase-independent mechanism with downregulation of Bcl-2 and NF-kappaB. Int J Cancer. 2005;115:74-84. [PubMed] |
| 17. | Kim YA, Rhee SH, Park KY, Choi YH. Antipro-liferative effect of resveratrol in human prostate carcinoma cells. J Med Food. 2003;6:273-280. [PubMed] |
| 18. | Tedesco I, Nappo A, Petitto F, Iacomino G, Nazzaro F, Palumbo R, Russo GL. Antioxidant and cytotoxic properties of lyophilized beer extracts on HL-60 cell line. Nutr Cancer. 2005;52:74-83. [PubMed] |
| 19. | Chan WH. Effect of resveratrol on high glucose-induced stress in human leukemia K562 cells. J Cell Biochem. 2005;94:1267-1279. [PubMed] |
| 20. | Mertens-Talcott SU, Percival SS. Ellagic acid and quercetin interact synergistically with resveratrol in the induction of apoptosis and cause transient cell cycle arrest in human leukemia cells. Cancer Lett. 2005;218:141-151. [PubMed] |
| 21. | Quiney C, Dauzonne D, Kern C, Fourneron JD, Izard JC, Mohammad RM, Kolb JP, Billard C. Flavones and polyphenols inhibit the NO pathway during apoptosis of leukemia B-cells. Leuk Res. 2004;28:851-861. [PubMed] |
| 22. | Jeong WS, Kim IW, Hu R, Kong AN. Modulatory properties of various natural chemopreventive agents on the activation of NF-kappaB signaling pathway. Pharm Res. 2004;21:661-670. [PubMed] |
| 23. | Cardile V, Scifo C, Russo A, Falsaperla M, Morgia G, Motta M, Renis M, Imbriani E, Silvestre G. Involvement of HSP70 in resveratrol-induced apoptosis of human prostate cancer. Anticancer Res. 2003;23:4921-4926. [PubMed] |
| 24. | Wang Q, Li H, Wang XW, Wu DC, Chen XY, Liu J. Resveratrol promotes differentiation and induces Fas-independent apoptosis of human medulloblastoma cells. Neurosci Lett. 2003;351:83-86. [PubMed] |
| 25. | Kim YA, Lee WH, Choi TH, Rhee SH, Park KY, Choi YH. Involvement of p21WAF1/CIP1, pRB, Bax and NF-kappaB in induction of growth arrest and apoptosis by resveratrol in human lung carcinoma A549 cells. Int J Oncol. 2003;23:1143-1149. [PubMed] |
| 26. | Ito T, Akao Y, Yi H, Ohguchi K, Matsumoto K, Tanaka T, Iinuma M, Nozawa Y. Antitumor effect of resveratrol oligomers against human cancer cell lines and the molecular mechanism of apoptosis induced by vaticanol C. Carcinogenesis. 2003;24:1489-1497. [PubMed] |
| 27. | Cao Y, Wang F, Liu HY, Fu ZD, Han R. Resveratrol induces apoptosis and differentiation in acute promyelocytic leukemia (NB4) cells. J Asian Nat Prod Res. 2005;7:633-641. [PubMed] |
| 28. | Jiang H, Zhang L, Kuo J, Kuo K, Gautam SC, Groc L, Rodriguez AI, Koubi D, Hunter TJ, Corcoran GB. Resveratrol-induced apoptotic death in human U251 glioma cells. Mol Cancer Ther. 2005;4:554-561. [PubMed] |
| 29. | Baatout S, Derradji H, Jacquet P, Mergeay M. Increased radiation sensitivity of an eosinophilic cell line following treatment with epigallocatechin-gallate, resveratrol and curcuma. Int J Mol Med. 2005;15:337-352. [PubMed] |
| 30. | Fulda S, Debatin KM. Resveratrol-mediated sensitisation to TRAIL-induced apoptosis depends on death receptor and mitochondrial signalling. Eur J Cancer. 2005;41:786-798. [PubMed] |
| 31. | Horvath Z, Saiko P, Illmer C, Madlener S, Hoechtl T, Bauer W, Erker T, Jaeger W, Fritzer-Szekeres M, Szekeres T. Synergistic action of resveratrol, an ingredient of wine, with Ara-C and tiazofurin in HL-60 human promyelocytic leukemia cells. Exp Hematol. 2005;33:329-335. [PubMed] |
| 32. | Wu SL, Sun ZJ, Yu L, Meng KW, Qin XL, Pan CE. Effect of resveratrol and in combination with 5-FU on murine liver cancer. World J Gastroenterol. 2004;10:3048-3052. [PubMed] |