修回日期: 2007-11-28
接受日期: 2007-12-22
在线出版日期: 2007-12-28
目的: 研究vimentin在胰腺癌细胞中的表达及意义.
方法: 采用免疫组织化学的方法检测99例胰腺癌组织中vimentin的表达, 并分析其与临床病理资料的关系. 免疫荧光、Western blot分析不同胰腺癌细胞中vimentin的表达, Transwell 侵袭小室法检测细胞的运动能力.
结果: 在99例胰腺癌组织中vimentin阳性16例(16%), vimentin的阳性表达和淋巴结转移(P = 0.02)、远处转移(P<0.001)、肿瘤细胞的分化程度(P = 0.002)存在明显的相关性. Vimentin在低分化的胰腺癌细胞Panc-1中呈高表达, 而在中分化和高分化的胰腺癌细胞AsPC-1和BxPc-3中表达较低. vimentin的表达和细胞体外运动能力相关.
结论: 胰腺祖细胞标记物vimentin在胰腺癌细胞中存在表达, 胰腺癌的发生和干细胞可能存在一定的联系, 并可能预测胰腺癌的恶性程度.
引文著录: 殷涛, 王春友, 熊炯炘, 陶京, 赵刚. Vimentin在胰腺癌细胞中的表达及临床意义. 世界华人消化杂志 2007; 15(36): 3822-3825
Revised: November 28, 2007
Accepted: December 22, 2007
Published online: December 28, 2007
AIM: To investigate the expression of vimentin in pancreatic cancer and its significance.
METHODS: Vimentin expression was examined in 99 cases of pancreatic carcinoma with immunohistochemistry, and the relationship between vimentin expression and clinicopathology were analyzed. Vimentin expression was investigated by immunofluorescence and Western blot in three pancreatic cancer cells lines: Panc-1, AsPC-1 and BxPc-3. Transwell migration assay was used to analyze the migratory ability of different cells.
RESULTS: Vimentin was detected in 16 cases (16%) of pancreatic cancer. Significant correlation was detected between the expression of vimentin and lymph node metastasis (P = 0.02), distant metastasis (P < 0.001) and poor dedifferentiation (P = 0.002). Vimentin was highly expressed in poorly differentiated pancreatic cancer cells, Panc-1. Besides, vimentin expression was correlated with in vitro cell migration.
CONCLUSION: Vimentin expression in pancreatic cancer cells has been identified. The histopathogenesis of pancreatic cancer may be correlated with stem cells. Vimentin may be a marker for predicting the malignancy of pancreatic cancer.
- Citation: Yin T, Wang CY, Xiong JX, Tao J, Zhao G. Vimentin expression in pancreatic cancer and its clinical significance. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3822-3825
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3822.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3822
胰腺癌是一种高度恶性的消化系统肿瘤, 具有极差的预后: 其5年生存率仅有3%-4%, 术后2年复发率高达95%. 虽然经过多年的艰苦探索, 胰腺癌的临床治疗效果并不令人满意, 提示有必要从新的角度认识胰腺癌的起源. 大量的研究表明: 胰腺癌的发生和胰管上皮细胞关系密切, 90%的胰腺癌和胰腺导管内皮瘤变(胰腺癌癌前病变)来源于胰管上皮, 同时胰腺癌细胞还表达导管细胞的表面标记[1]. 我们前期的研究发现: 胰腺新生过程中, 增殖的胰管上皮通过去分化表现出类似于干细胞的特性, 从而在胰腺修复过程中发挥作用[2]. 我们推测, 胰腺癌的发生可能和胰腺干细胞之间存在联系.
由于肿瘤组织具有较大的异质性以及分化不成熟的特性, 一些较为原始的干细胞标记分子有可能在肿瘤组织中得到重新表达. 胚胎发育和胰腺新生过程中, 增殖的胰管上皮可以高表达vimentin, vimentin有可能是一种处于增殖状态胰腺祖细胞的标记[3]. 为了进一步明确胰腺癌的发生和胰腺干细胞之间的关系, 我们通过免疫组化检测vimentin在胰腺癌组织中的表达情况, 同时分析vimentin在不同分化程度胰腺癌细胞中的表达, 以期为胰腺癌的起源提供线索.
取自1998-03/2004-06武汉协和医院接受胰十二指肠切除住院患者术后的胰腺癌石蜡块标本. 99例均经常规病理检查证实为胰腺癌, 其中有42例经病理证实有淋巴结转移, 57例无淋巴结转移; 19例发生远处转移; 高分化27例, 中分化30例, 低分化42例. 男性42例, 女性57例. 年龄从34-76(中位年龄58)岁. 低分化胰腺癌细胞Panc-1、中分化胰腺癌细胞AsPC-1、高分化胰腺癌细胞BxPc-3购自ATCC(American Type Culture Collection). 三种细胞分别用含有100 mL/L新生牛血清(Gibco)的DMEM培养基(Gibco)、置于37℃, 50 mL/L CO2的细胞培养箱中培养.
1.2.1 免疫组化: 手术标本经5 mm厚连续切片. vimentin的免疫组化染色行链霉素亲和素-过氧化酶复合物法(SP法). vimentin mAb(Sigma)工作液浓度为1:100, SP免疫组化试剂盒为Zymed公司产品, 实验程序严格按照说明书进行. TBS代替一抗作为阴性对照. vimentin阳性判断标准以肿瘤细胞的胞质内出现棕黄色染色为阳性, 在显微镜下随机选取10个高倍视野, 每个视野计数50个细胞, 结果以阳性细胞数所占百分比来表示. 考虑到vimentin阳性染色的肿瘤细胞非常少, 只要在肿瘤细胞中发现vimentin的阳性染色则判断为vimentin的阳性[4].
1.2.2 免疫荧光: 将细胞制成单细胞悬液, 接种于放有盖玻片的培养皿中, 待细胞铺满盖玻片时取出, PBS洗涤之后用40 g/L的多聚甲醛固定, 含有10 mL/L TritonX-100的PBS预处理15 min后, 1 g/L BSA封闭, vimentin(1:80)37℃孵育1 h, PBS洗3次每次5 min, FITC标记的羊抗兔IgG (Pierce)(1:200稀释)37℃孵育1 h, PBS洗涤之后在荧光显微镜(Olympas)下进行观察.
1.2.3 Western blot: 蛋白的提取按文献[5]所提供的方法进行. 用含有相同蛋白的样本进行聚丙烯酰胺凝胶电泳, 然后采用半干法转到硝酸纤维素膜上. NC膜用含有50 g/L奶粉的TBS封闭过夜, vimentin一抗37℃孵育1 h(1:600稀释), TBS冲洗之后辣根过氧化物酶标记的二抗37℃封闭1 h, TBS洗涤之后ECL法显色, 洗片. 选用β-actin(Santa Cruz)作为内参, 1:400稀释.
1.2.4 细胞迁移能力测定: 不同细胞迁移能力采用Transwell侵袭小室检测(6.5 mm直径, 8 μm孔径的聚碳酸酯膜, Costar), 无血清DMEM调整细胞浓度为1×109/L, 在上室中加入100 μL细胞悬液, 在下室中加入无血清培养基培养的NIH3T3细胞上清600 μL, 然后在37℃的培养箱中孵育8 h, 取出滤膜, 用预冷的甲醇固定, 棉签擦去滤膜上室未穿透的细胞, 4 g/L的台盼蓝溶液染色, 在200倍光镜下取6个视野计数穿透到细胞背面的细胞数, 每组重复3次, 结果求平均数.
统计学处理 vimentin阳性表达率和临床病理资料之间的相关性分析采用χ2检验, 细胞之间迁移能力差异的比较采用ANOVA检验. P<0.05被认为有统计学意义. 应用SPSS11.5统计软件包进行分析.
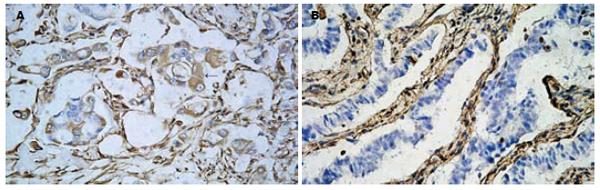
vimentin在胰腺癌组织中主要表达于肿瘤细胞周围的间质, 有一小部分肿瘤细胞可以表达vimentin(图1, 箭头所标记的细胞). 在99例肿瘤组织中有16例呈vimentin阳性, 阳性率达16%. 在正常胰腺组织的上皮成分内未发现有vimentin阳性染色. vimentin的表达和胰腺癌的淋巴结转移(P = 0.02)、远处转移(P<0.001)、组织学分级(P = 0.002)都存在相关性. 在发现有淋巴结转移、远处转移和分化程度较低的病例中vimentin的阳性率较高(表1).
| vimentin | |||
| 阳性(n = 16) | 阴性(n = 83) | P值 | |
| 年龄 | 0.387 | ||
| ≤60岁 | 9 | 56 | |
| >60岁 | 7 | 27 | |
| 性别 | 0.222 | ||
| 男性 | 9 | 33 | |
| 女性 | 7 | 50 | |
| 肿瘤部位 | 0.272 | ||
| 胰头 | 13 | 56 | |
| 胰体尾 | 3 | 27 | |
| 肿瘤大小 | 0.642 | ||
| <4 cm | 11 | 52 | |
| ≥4 cm | 5 | 31 | |
| 肿瘤范围 | 0.294 | ||
| T1-2 | 4 | 12 | |
| T3-4 | 12 | 71 | |
| 淋巴结转移 | 0.020 | ||
| N0 | 5 | 52 | |
| N1 | 11 | 31 | |
| 远处转移 | <0.001 | ||
| M0 | 6 | 74 | |
| M1 | 10 | 9 | |
| 病理分级 | 0.002 | ||
| 高 | 0 | 27 | |
| 中 | 3 | 27 | |
| 低 | 13 | 29 | |
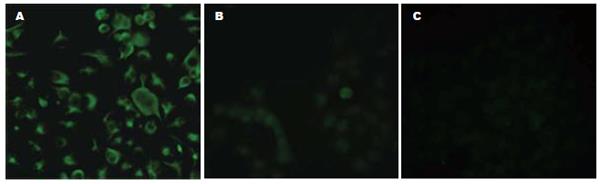
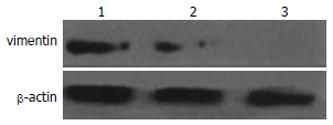
在低分化的胰腺癌细胞系Panc-1细胞中, vimentin的荧光较强, 而中分化和高分化的胰腺癌细胞AsPC-1和BxPc-3只表达出微弱的荧光(图2). Western blot同样标明: Panc-1细胞中vimentin呈强表达, 而AsPC-1和BxPc-3中表达较弱(图3).
Panc-1细胞的穿透数为(101±9)个, AsPC-1的穿透数为(81±5)个, BxPc-3的穿透数为(43±7)个, 三组相比差别具有显著意义(P<0.001).
肿瘤的发生是机体干细胞在修复损伤的过程中, 由于受到内源或外源的各种刺激, 发生基因突变, 导致其增殖调控通路中某些信号分子发生改变, 具有无限增殖、自我更新及分化的能力, 即形成肿瘤干细胞. 肿瘤干细胞在启动肿瘤形成和生长过程中起决定作用, 因而成为肿瘤恶性生长的源泉[6]. 肿瘤干细胞理论已经在包括乳腺癌、白血病、肝癌等多种肿瘤中得到证实[7-9]. 作为一种高度恶性的消化系统肿瘤, 胰腺癌的发生和干细胞是否有关系尚待阐明.
我们的前期研究表明胰腺大部分切除后, 胰腺再生过程中出现了胰腺导管上皮细胞的增殖与分化, 增殖的导管上皮细胞通过去分化表现出干细胞的特性, 进而参与胰腺的新生[2]. Ko et al[3]学者发现增殖的胰管上皮细胞高表达vimentin, vimentin可以作为一种胰腺祖细胞的标记物. 而vimentin是一种Ⅲ型中间纤维, 正常情况下只在间叶组织中表达, 而上皮细胞则不表达, 所以vimentin经常被用作一种肿瘤标志物来诊断黑色素瘤.
为了进一步阐明胰腺癌的发生, 我们通过免疫组化的方法检测了vimentin在胰腺癌细胞中的表达情况. 结果发现: 在99例胰腺癌标本中, 有16例(16%)检测到vimentin的表达. 胰腺癌的发生过程中可能有干细胞的参与. 此外我们还发现vimentin的表达和淋巴结转移、远处转移、以及肿瘤的病理学分级都存在显著的相关性. 在发现有转移以及低分化的肿瘤组织中, vimentin的阳性表达率较高. vimentin在胰腺癌组织中的表达参与肿瘤的恶性生物学行为, 通过检测术后组织标本中vimentin的表达有可能对胰腺癌的恶性程度作出预测.
关于vimentin阳性肿瘤细胞的来源有多种解释: (1)肿瘤组织中的肌上皮细胞; (2)发生去分化的肿瘤细胞; (3)具有多种分化潜能的肿瘤祖细胞[10]. 考虑到vimentin阳性肿瘤细胞所占的比例较少, 为了更好的反应vimentin阳性肿瘤细胞的来源、及其在胰腺癌组织中表达的意义, 在本研究中我们采用任何数量肿瘤细胞的vimentin阳性染色, 则为阳性表达的判定标准.
通过Western blot和免疫荧光技术检测vimentin在不同胰腺癌细胞系中的表达时发现: 低分化的胰腺癌细胞Panc-1高表达vimentin, 而中分化、高分化的胰腺癌细胞系AsPC-1、BxPc-3中vimentin的表达水平较低, 细胞系中vimentin的表达情况与胰腺癌组织相符. Lang et al[4]认为vimentin的表达参与调控上皮细胞的运动, 在需要细胞移动的生理(如修复)或者病理过程(如肿瘤转移)中上皮细胞往往表达vimentin. 而我们也发现vimentin表达量高的细胞Panc-1在体外的迁移能力较强, 而vimentin表达水平低的细胞BxPc-3在体外运动能力较弱, 两者之间存在显著的差异(P<0.001). 实际上胰腺癌细胞vimentin表达和临床转移之间的相关性也反映了肿瘤细胞具有较强的运动能力, vimentin在胰腺癌细胞中的表达参与了胰腺癌的侵袭过程. 总之, 我们验证了胰腺祖细胞标志物vimentin在胰腺癌细胞中存在表达, 胰腺癌的发生可能和胰腺干细胞存在一定的联系. 此外vimentin的表达参与胰腺癌的恶性侵袭性生物学过程, 他反映了高侵袭性胰腺癌的一种去分化状态, 有可能作为一种标志物而预测胰腺癌的恶性程度.
胰腺癌是一种高度恶性的消化系统肿瘤, 临床治疗效果非常差, 探索胰腺癌的细胞起源可能具有重要意义. 本文希望通过探讨胰腺祖细胞标记物vimentin在胰腺癌组织中的表达情况, 从而为胰腺癌的干细胞起源提供线索.
干细胞在修复机体损伤的过程中, 受到各种刺激发生基因突变, 获得无限增殖的能力, 在启动肿瘤形成和生长过程中起决定作用. 由于肿瘤组织具有较大的异质性以及分化不成熟的特性, 一些较为原始的干细胞标记分子有可能在肿瘤组织中得到重新表达, 探讨这些干细胞标志物在肿瘤组织中的表达情况可能对肿瘤的诊治具有重要意义.
Vimentin是一种间叶细胞的标记分子, 在正常的上皮细胞中不表达, 然而有学者发现增殖的胰管上皮细胞中表达vimentin, vimentin可能是一种胰腺祖细胞的标记, 还有研究认为vimentin的表达可能参与了细胞的运动过程.
vimentin在胰腺癌细胞中的表达提示胰腺癌的发生可能和胰腺干细胞存在内在的联系, 通过检测vimentin在胰腺癌中的表达可能对胰腺癌的恶性生物学行为进行预测.
本文选题符合该领域的研究热点, 设计科学, 合理, 统计处理符合统计学方法, 结论可靠, 建议完善讨论.
编辑: 程剑侠 电编: 何基才
| 1. | Grapin-Botton A. Ductal cells of the pancreas. Int J Biochem Cell Biol. 2005;37:504-510. [PubMed] [DOI] |
| 3. | Ko SH, Suh SH, Kim BJ, Ahn YB, Song KH, Yoo SJ, Son HS, Cha BY, Lee KW, Son HY. Expression of the intermediate filament vimentin in proliferating duct cells as a marker of pancreatic precursor cells. Pancreas. 2004;28:121-128. [PubMed] [DOI] |
| 4. | Lang SH, Hyde C, Reid IN, Hitchcock IS, Hart CA, Bryden AA, Villette JM, Stower MJ, Maitland NJ. Enhanced expression of vimentin in motile prostate cell lines and in poorly differentiated and metastatic prostate carcinoma. Prostate. 2002;52:253-263. [PubMed] [DOI] |
| 5. | Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: a laboratory manual. 2rd ed. New York: Cold Spring Harbor Laboratory Press 1989; 870-877. |
| 6. | Beachy PA, Karhadkar SS, Berman DM. Tissue repair and stem cell renewal in carcinogenesis. Nature. 2004;432:324-331. [PubMed] [DOI] |
| 7. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 8. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 10. | Korsching E, Packeisen J, Liedtke C, Hungermann D, Wülfing P, van Diest PJ, Brandt B, Boecker W, Buerger H. The origin of vimentin expression in invasive breast cancer: epithelial-mesenchymal transition, myoepithelial histogenesis or histogenesis from progenitor cells with bilinear differentiation potential? J Pathol. 2005;206:451-457. [PubMed] [DOI] |