修回日期: 2007-10-17
接受日期: 2007-11-11
在线出版日期: 2007-12-28
目的: 检测胃癌组织中P27的表达及其与cyclin D1、cyclin E表达的相关性, 并探讨其意义.
方法: 临床病理资料齐全的胃癌蜡块标本54例, 正常胃黏膜标本15例, 采用SP免疫组化方法检测P27、cyclin D和cyclin E在其中的表达.
结果: 胃癌组织54例中有20例P27表达阳性(37.0%), 正常胃组织中15例有11例P27呈阳性表达(73.3%), 胃癌组织与正常胃组织相比, P27的表达有明显差异(P<0.05), 胃癌组织中P27的表达与患者的性别、年龄及肿瘤大小, 浸润深度, 分化程度无相关性(P>0.05), 而与TNM分期及有无淋巴结转移明显相关(P<0.05), P27的表达与cyclin D1的表达呈负相关(r = -0.332), 而与cyclin E的表达无明显相关性(P>0.05).
结论: 胃癌组织中P27表达与正常胃组织有显著差异, 胃癌组织中P27蛋白表达与淋巴结转移及临床分期密切相关, 与cyclin E的表达呈负相关.
引文著录: 张广建, 寇有为, 王强. 胃癌组织中P27表达与cyclin D1、cyclin E表达的相关性. 世界华人消化杂志 2007; 15(36): 3809-3814
Revised: October 17, 2007
Accepted: November 11, 2007
Published online: December 28, 2007
AIM: To detect the expression of P27 and cyclin D1 and E expression in gastric cancer, and to provide a new way to diagnose and treat gastric cancer.
METHODS: Immunohistochemistry was used to examine the expression of P27, cyclin D1 and cyclin E proteins in gastric carcinoma (n = 54) and normal gastric mucosa (n = 15).
RESULTS: Positive immunohistochemistry was seen in 20 of 54 gastric cancer cases and in 11 of 15 normal gastric tissues. P27 expression differed significantly between gastric cancer and normal gastric tissue (P < 0.05), had no relation with sex, age, tumor size, invasive depth and differentiation, but had a significant relationship with TNM staging and lymph node metastasis (P < 0.05). P27 expression had a negative correlation with cyclin D1 (r = -0.332) and no relationship with cyclin E.
CONCLUSION: The difference in P27 expression in gastric cancer and normal gastric tissue is remarkable. The expression has a significant relationship with TNM staging and lymph node metastasis. P27 expression has a negative correlation with cyclin D1 and no relationship with cyclin E expression.
- Citation: Zhang GJ, Kou YW, Wang Q. Expression of P27 and cyclin D1 and E expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3809-3814
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3809
细胞周期是细胞生命活动的基本过程, 其运行受细胞周期调控机制控制. 细胞周期抑制蛋白异常表达将导致细胞周期的失控, 使细胞获得以增殖过多、凋亡过少为主要形式的失控性生长特征. 细胞周期异常可导致肿瘤的发生, 肿瘤对细胞周期的影响, 一方面表现为对细胞周期监控机制的破坏, 另一方面表现为对细胞周期驱动机制的破坏. P27是新近发现的细胞周期抑制蛋白, 在细胞周期调控中起重要作用. 他能够抑制多种cyclin-CDK复合物(cyclinE-CDK2、cyclinA-CDK2、cyclinD-CDK4 等)的激酶活性, 使细胞阻滞于G1期, 从而抑制细胞增殖. cyclin D1和cyclin E是目前研究较为成熟的细胞周期调控因子, 研究P27与其二者的相关性是目前细胞周期调控方面的热点. 胃癌是较常见的消化系统恶性肿瘤之一, 早期诊断困难, 临床患者多为进展期或晚期, 故其预后差, 目前胃癌的发病机制仍不十分清楚. 我们检测P27在胃癌中的表达及其与cyclin D1、cyclin E表达的相关性, 并探讨其意义, 从而为胃癌的诊断和治疗提供一种新的思路.
选择临床及病理资料齐全的中国医科大学第二附属医院普外科2001-2003年手术切除并经病理证实为胃癌的蜡块标本54例, 全部病例术前均未行放化疗, 病理均为腺癌. 男37例, 女17例; 年龄38-78(平均60.4)岁; 肿瘤的原发灶大小、深度(T)、淋巴结转移(N)由病理学确定, 远处转移(M)由病理学和临床确定. 组织学分化: 高分化19例, 中分化17例, 低分化18例; 局部淋巴结转移: 有25例, 无29例; 根据1997年国际抗癌联盟(UICC)制定的TNM分期标准进行临床分期:Ⅰ期12例, Ⅱ期14例, Ⅲ期16例, Ⅳ期12例. 另取正常胃黏膜组15例, 标本取自胃溃疡或十二指肠溃疡手术标本中正常胃黏膜组织, 并经病理观察证实且排除重度不典型增生. 男10例, 女5例, 年龄44-77(平均58)岁. 将蜡块制成5 μm厚的切片, 贴于涂有多聚赖氨酸的载玻片上, 置于60℃的烤箱内烤片72 h以上. 即用型P27兔抗人mAb、cyclin D1鼠抗人mAb、cyclin E鼠抗人mAb全部购于北京中山生物制品有限公司, S-P试剂盒及DAB显色试剂盒均购自福州市迈新生物技术开发公司.
常规HE染色, 确定标本的组织分化程度. 检测P27、cyclin D1、cyclin E在胃癌组织中表达, 采用链霉菌抗生物素蛋白-过氧化酶连接(S-P)免疫组织化学方法, 具体操作步骤: 石蜡切片常规脱蜡至水: 抗原修复(高温高压法): 冲洗, 0.01 mol/L pH 6.0枸橼酸盐缓冲液浸泡5 min, 高温高压 1.5 min, 静置自然冷却至室温; 阻断内源性过氧化物酶活性: 冲洗, 30 mL/L H2O2 37℃温箱内孵育30 min; 封闭非特异性位点: 冲洗, 滴加100 mL/L非免疫血清, 37℃温箱内孵育30 min, 静置自然冷却至室温; 滴加一抗, 4℃过夜; 升至室温, 冲洗, 滴加生物素标记的二抗, 37℃温箱内孵育35 min; 冲洗, 滴加SP复合物, 37℃温箱孵育35 min; 冲洗, DAB显色5 min; 自来水冲洗; 苏木素复染10 min; 自来水充分冲洗, 10 mL/L盐酸酒精分化2-3 s; 自来水冲洗, 温水浸泡返蓝30 min; 脱水: 梯度酒精冲洗; 二甲苯Ⅰ、Ⅱ各浸泡5 min; 中性树胶封片. 对照: 用已知阳性的乳腺癌切片作为阳性对照, PBS缓冲液代替一抗作阴性对照. 结果判定: 细胞胞核内出现棕黄色或棕褐色颗粒为阳性细胞, 以阳性细胞密度最高的区域计数5个高倍视野(×400), 计数阳性细胞的百分率. 规定阳性细胞比例超过5%为阳性组, 小于5%为阴性组.
统计学处理 应用SPSS11.5软件进行统计学处理, 各项指标间差别检验均应用χ2检验, 组间相关性采用Spearmann相关分析, P<0.05有统计学意义.
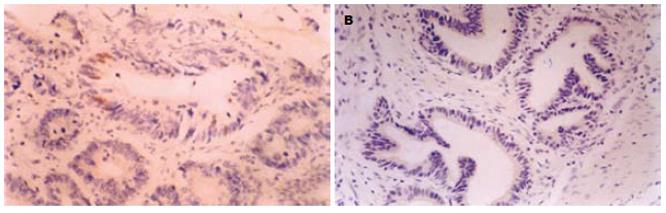
P27表达阳性染色主要定位于胃癌及正常胃组织细胞胞核中, 为棕黄色颗粒. 在54例胃癌组织中有20例P27表达阳性(37.0%, 图1A). 15例正常胃组织中有11例P27呈阳性表达(73.3%, 图1B). 胃癌组织与正常胃组织相比, P27的表达有明显差异(P<0.05). 胃癌组织中P27的表达与患者的性别、年龄及肿瘤大小, 浸润深度, 分化程度无相关性(P>0.05), 而与TNM分期及有无淋巴结转移明显相关. TNMⅠ、Ⅱ期病例组, P27表达的阳性率为57.7%, TNM分期Ⅲ、Ⅳ期胃癌中的阳性表达率为17.9%, 二者之间有显著的差异(P<0.05). 在有淋巴结转移和无淋巴结转移的胃癌组织中P27表达的阳性率分别为16.0%和55.2%, 二者之间有显著的差异(P<0.05). 说明P27的表达与胃癌的临床分期及淋巴转移有关, 恶性程度越高, TNM分期越晚, P27的表达水平越低(表1).
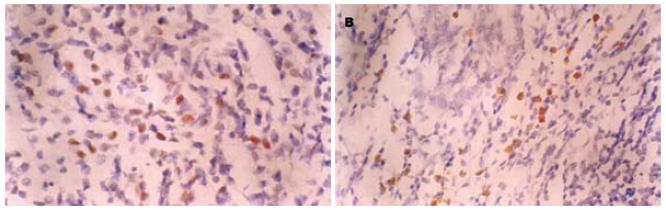
P27和cyclin E蛋白表达呈负相关, cyclin E阳性(图2A)的33例胃癌中P27蛋白阳性8例(24.2%), 显著低于cyclin E阴性而P27蛋白阳性者(57.1%, P<0.05, r = -0.332), 二者之间有显著的相关性, 且呈负相关. P27表达与cyclin Dl蛋白的表达无相关性, cyclin D1阳性(图2B)的31例胃癌中P27蛋白阳性9例(32.1%), cyclin D1阴性的23例胃癌中P27蛋白阴性11例(47.8%, P>0.05), 二者之间无相关性.
1994年由美国两个研究小组Polyak et al[1]和Toyoshima et al[2]分别分离得到P27蛋白. P27是分子质量为27 kDa的热稳定蛋白质, 为长约594 bp, 编码198个氨基酸的蛋白质[3]. Pietenpol et al[4]发现P27基因定位于人染色体12P13, 包括两个外显子和一个内显子. P27作为一个细胞周期负性调控因子, 其水平随着细胞周期进程的改变而改变. 在细胞周期G1期P27水平最高, 此时P27主要是与cyclin E-CDK2结合, 抑制CDK2的蛋白激酶活性, 进而引起细胞周期停滞在G1期. 随着细胞进入S期DNA合成达到最高时P27的水平降到最低点[5]. P27作为CDK抑制因子参与细胞周期的调控一这是P27的主要功能. 其活性的改变直接影响着细胞周期的进程. 对P27活性的调控可分为转录水平和转录后水平. 在转录水平上的调控, 通过研究发现: (1)Forkhead转录因子可以上调P27的转录水平[6], 进而引起P27蛋白水平的升高, 导致G1期的停滞; (2)在黑色素瘤中, P27启动子区域内存在着高度的甲基化, 并且这种甲基化抑制了P27的转录[7], 但是这种现象是否出现在别的肿瘤中仍有待证实; (3)c-myc可以在转录水平上抑制P27的表达, 并且他的抑制区域被定位在P27基因的-20 bp和+20 bp之间[8]. 对P27活性的调控主要是在转录后水平上进行的. P27转录后水平的调节途径包括对P27蛋白的水解、对P27在细胞中的定位以及对P27被扣留的调控. P27蛋白的水解主要是通过泛素化-蛋白水解体途径完成的[9], 并且此途径是在细胞周期G0-G1期以及G1期-S期转化时对P27蛋白水平进行调控的. 进一步的研究表明: P27自身特异位点的磷酸化对于P27从核内转运至胞质、以及蛋白水解都是必要的[10]. 调控P27活性的另外一条途径是P27与不同物质的结合会对其活性造成不同的影响. 因此P27的表达水平及活性与肿瘤的发生有密切的关系.
近年来研究发现, P27在肿瘤细胞中的改变主要表现为瘤细胞中游离的P27蛋白量远远低于正常细胞的水平. Kawamata et al[11]报道在早期乳腺癌中P27蛋白水平与预后相关, P27蛋白低表达组的平均生存期为139 mo(死亡率17%), P27蛋白高表达组平均生存期为174 mo(死亡率9%), 他们认为在微小浸润性乳腺癌, P27蛋白表达水平可作为判断患者预后的指标. Ronald et al对86例根治性切除的Ⅰ期-Ⅱ期前列腺癌作P27蛋白表达水平检测, 结果在P27蛋白低表达组中, 50%的病例肿瘤复发, 而P27蛋白高表达组中仅22.2%的患者有肿瘤复发[12]. Margarit et al对淋巴组织及不同类型的淋巴瘤中P27蛋白表达状况作了研究, 结果表明: 淋巴组织中静止的细胞群表达P27蛋白, 而增生的细胞群P27蛋白阴性. 无论淋巴瘤的组织学类型如何, 小的静止细胞P27蛋白阳性, 大的增生细胞P27蛋白阴性[13]. 所有P27表达水平较高的肿瘤是具有"静止临床行为"的淋巴瘤, 而P27表达低或缺乏者则是具有高度侵袭性的肿瘤. Singh et al[14-15]在研究与Barrett相关的食管腺癌(BAA)时发现, P27蛋白水平下降与腺癌淋巴结转移, 深部浸润、生存率低下有关, 与肿瘤细胞分化程度呈负相关.
在恶性肿瘤的研究中发现, 癌细胞中P27蛋白表达下降与肿瘤的进展、浸润深度、淋巴结转移显著相关[16-18]. 与肿瘤浸润深度, 大小, 年龄, 性别无明显关系. 本研究结果与之相似, 胃癌组织中P27蛋白阳性率37.0%明显低于正常胃组织73.3%(P<0.05). 说明P27表达水平下调可能促进胃癌的发生. 他在胃癌组织中的表达与淋巴结转移, TNM分期有关, 在无淋巴结转移组P27蛋白阳性率(55.2%)有淋巴结转移组阳性率为16.0%(P<0.05). 表明P27蛋白在胃癌的进展过程中逐渐丧失了作为细胞周期负调控因子的抑癌作用, 使得癌细胞具有更高的恶性程度和侵袭力. 另外P27蛋白缺乏还可导致细胞间黏附力下降, 使肿瘤容易转移. P27蛋白在TNM分期Ⅲ, Ⅳ期中的表达水平显著下降, 提示其在胃癌中的低表达是一个有价值的预后因素. 本组P27蛋白的表达与胃癌的淋巴结转移及临床分期呈显著相关, 呈现出低表达与高恶性明显相关, 提示P27蛋白表达水平可能作为反映胃癌恶性程度和预测胃癌预后的重要指标.
cyclin E是一种核蛋白, 最初是从酿酒酵母菌中提取出来的[19-20]. cyclin E的表达受细胞周期调节, 并在G1期末达到高峰. 在cyclin D1和cyclin D2表达增加后, 与CDK2联系, 并将其激活, cyclin E/CDK复合物在细胞进入S期前显示出短暂而强烈的酶活性, 并引起RB蛋白的进一步磷酸化, cyclin E/CDK2复合物的活性被P2l, P27ketalCDls系列中的成员所调节[21-22]. 因为细胞周期素在调控细胞周期程序变化中起着非常重要的作用, 控制着细胞周期及细胞增殖, 并有证据证明细胞周期素及与其相关的基因在癌症中的作用[23-24]. cyclin E的过度表达可引起P27 kipl基因的减少. 本实验中cyclin E蛋白阳性的33例胃癌组织中P27表达阳性8例(24.2%). cyclin E蛋白阴性的21例胃癌组织中P27表达阳性12例(57.1%, P<0.05, r = -0.332), 说明二者之间呈显著的负相关. P27蛋白表达越低cyclin E表达越高, P27蛋白表达下调和cyclin E表达上调共同促进肿瘤进展.
cyclin Dl是由位于11q13的CCNDl基因编码的蛋白, 由259个氨基酸组成, 其相对分子质量为34 kDa. cyclin D1与细胞周期蛋白依赖性激酶(CDK)结合, 使视网膜母细胞瘤易感因子(Rb)发生磷酸化, 其构象发生改变而与转录活化因子(E2F)分离, E2F被释放而发挥转录因子效应, 促进细胞增殖, 抑制细胞凋亡而癌变[25]. 本实验中cyclin D1蛋白阳性的31例胃癌组织中P27表达阳性9例(32.1%). cyclin D1蛋白阴性的23例胃癌组织中P27表达阳性11例(47.8%, P>0.05), 说明cyclin Dl表达与P27蛋白的表达无相关性.
目前对P27的研究表明, P27蛋白在静止期细胞高表达, 一旦细胞受增殖原刺激, 细胞内P27蛋白快速下调, 因而认为P27介导了细胞外负性增殖信号向细胞内传导[26-27]. P27在某些恶性肿瘤中表达降低[28], 其蛋白表达与反映肿瘤转移恶性生物学行为的指标呈负相关, 说明P27不但可作为反映肿瘤恶性表型的一个指标, 而且可作为恶性肿瘤的重要预后因素, 帮助临床选择易于复发、转移的高危患者, 提高治疗率和生存率. 外源性P27基因可作为目的基因用于肿瘤的基因治疗, 在这方面也有相关报道, 如将外源性P27基因导入星形胶质瘤细胞, 可使外源性P27基因在这些肿瘤细胞内高表达[29], 明显抑制肿瘤的生长. P27可以抑制细胞增殖, 促进细胞凋亡及分化成熟, 并且其对细胞增殖的抑制作用强于其家庭成员P21. 因此, 对于肿瘤及其他一些以增殖为病理基础的疾病, P27基因有可能作为一个目的基因[30], 用于对这些疾病的基因治疗. 然而P27基因及蛋白除具有目前已知的作用外, 他是否还有其他生物作用? 他又是通过何种途径发挥其生物学作用? 各途径间的相互关系如何? P27在胃癌发生发展过程中是如何作用的? 胃癌中P27失活机制如何? 以上问题的解决, 将使P27的作用机制及失活机制更加明了, 从而使人工调节P27表达水平及外部干涉P27作用通路成为可能, 这将为胃癌的基因治疗特别是联合多项基因治疗提供广阔的前景.
P27是新近发现的细胞周期抑制蛋白, 在细胞周期调控中起重要作用, 他能够抑制多种cyclin-CDK复合物的激酶活性, 使细胞阻滞于G1期,从而抑制细胞增殖, 而胃癌是较常见的消化系恶性肿瘤之一, 本文检测P27在胃癌中的表达及其与cyclin D1, cyclin E表达的相关性.
P27是最近发现的一种细胞周期抑制蛋白, 很多文献对此进行了报道, 其中与胃癌相关性的研究最多见. 但缺乏大宗癌症病例和广泛癌系的研究.
本研究结果P27在胃癌组织中的表达与肿瘤分化程度, 浸润深度, cyclin D1表达无相关性, 与大多发表的文献不一致.
研究P27在胃癌组织中的表达对胃癌的诊断和治疗有重要的现实意义, 已提高P27表达的基因治疗技术可加速细胞周期进程, 抑制肿瘤细胞增殖, 从而为胃癌的辅助治疗提供新的依据.
本文设计合理, 结果可信, 有一定的参考价值.
编辑: 何燕 电编: 刘勇
| 1. | Polyak K, Lee MH, Erdjument-Bromage H, Koff A, Roberts JM, Tempst P, Massagué J. Cloning of p27Kip1, a cyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals. Cell. 1994;78:59-66. [PubMed] [DOI] |
| 2. | Toyoshima H, Hunter T. p27, a novel inhibitor of G1 cyclin-Cdk protein kinase activity, is related to p21. Cell. 1994;78:67-74. [PubMed] [DOI] |
| 3. | Polyak K, Kato JY, Solomon MJ, Sherr CJ, Massague J, Roberts JM, Koff A. p27Kip1, a cyclin-Cdk inhibitor, links transforming growth factor-beta and contact inhibition to cell cycle arrest. Genes Dev. 1994;8:9-22. [PubMed] [DOI] |
| 4. | Pietenpol JA, Bohlander SK, Sato Y, Papadopoulos N, Liu B, Friedman C, Trask BJ, Roberts JM, Kinzler KW, Rowley JD. Assignment of the human p27Kip1 gene to 12p13 and its analysis in leukemias. Cancer Res. 1995;55:1206-1210. [PubMed] |
| 5. | Halevy O, Novitch BG, Spicer DB, Skapek SX, Rhee J, Hannon GJ, Beach D, Lassar AB. Correlation of terminal cell cycle arrest of skeletal muscle with induction of p21 by MyoD. Science. 1995;267:1018-1021. [PubMed] [DOI] |
| 6. | Dijkers PF, Medema RH, Pals C, Banerji L, Thomas NS, Lam EW, Burgering BM, Raaijmakers JA, Lammers JW, Koenderman L. Forkhead transcription factor FKHR-L1 modulates cytokine-dependent transcriptional regulation of p27(KIP1). Mol Cell Biol. 2000;20:9138-9148. [PubMed] [DOI] |
| 7. | Worm J, Bartkova J, Kirkin AF, Straten P, Zeuthen J, Bartek J, Guldberg P. Aberrant p27Kip1 promoter methylation in malignant melanoma. Oncogene. 2000;19:5111-5115. [PubMed] [DOI] |
| 8. | Yang W, Shen J, Wu M, Arsura M, FitzGerald M, Suldan Z, Kim DW, Hofmann CS, Pianetti S, Romieu-Mourez R. Repression of transcription of the p27(Kip1) cyclin-dependent kinase inhibitor gene by c-Myc. Oncogene. 2001;20:1688-1702. [PubMed] [DOI] |
| 9. | Pagano M, Tam SW, Theodoras AM, Beer-Romero P, Del Sal G, Chau V, Yew PR, Draetta GF, Rolfe M. Role of the ubiquitin-proteasome pathway in regulating abundance of the cyclin-dependent kinase inhibitor p27. Science. 1995;269:682-685. [PubMed] [DOI] |
| 10. | Vlach J, Hennecke S, Amati B. Phosphorylation-dependent degradation of the cyclin-dependent kinase inhibitor p27. EMBO J. 1997;16:5334-5344. [PubMed] [DOI] |
| 11. | Kawamata N, Morosetti R, Miller CW, Park D, Spirin KS, Nakamaki T, Takeuchi S, Hatta Y, Simpson J, Wilcyznski S. Molecular analysis of the cyclin-dependent kinase inhibitor gene p27/Kip1 in human malignancies. Cancer Res. 1995;55:2266-2269. [PubMed] |
| 12. | Tan P, Cady B, Wanner M, Worland P, Cukor B, Magi-Galluzzi C, Lavin P, Draetta G, Pagano M, Loda M. The cell cycle inhibitor p27 is an independent prognostic marker in small (T1a,b) invasive breast carcinomas. Cancer Res. 1997;57:1259-1263. [PubMed] |
| 13. | Qian X, Jin L, Grande JP, Lloyd RV. Transforming growth factor-beta and p27 expression in pituitary cells. Endocrinology. 1996;137:3051-3060. [PubMed] |
| 14. | Singh SP, Lipman J, Goldman H, Ellis FH, Aizenman L, Cangi MG, Signoretti S, Chiaur DS, Pagano M, Loda M. Loss or altered subcellular localization of p27 in Barrett's associated adenocarcinoma. Cancer Res. 1998;58:1730-1735. [PubMed] |
| 15. | Lechpammer M, Xu X, Ellis FH, Bhattacharaya N, Shapiro GI, Loda M. Flavopiridol reduces malignant transformation of the esophageal mucosa in p27 knockout mice. Oncogene. 2005;24:1683-1688. [PubMed] [DOI] |
| 16. | Kaiser AM, Saluja AK, Lu L, Yamanaka K, Yamaguchi Y, Steer ML. Effects of cycloheximide on pancreatic endonuclease activity, apoptosis, and severity of acute pancreatitis. Am J Physiol. 1996;271:C982-C993. [PubMed] |
| 17. | Koff A, Cross F, Fisher A, Schumacher J, Leguellec K, Philippe M, Roberts JM. Human cyclin E, a new cyclin that interacts with two members of the CDC2 gene family. Cell. 1991;66:1217-1228. [PubMed] [DOI] |
| 18. | Ge JR, Ren GP, Yao HP. [Expression of cyclin D1 and p27kip1 in renal cell carcinoma and its significance]. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2007;36:483-487. [PubMed] |
| 19. | Nowee ME, Dorsman JC, Piek JM, Kosma VM, Hämäläinen K, Verheijen RH, van Diest PJ. HER-2/neu and p27Kip1 in progression of Fallopian tube carcinoma: an immunohistochemical and array comparative genomic hybridization study. Histopathology. 2007;51:666-673. [PubMed] [DOI] |
| 20. | Geisen C, Moroy T. The oncogenic activity of cyclin E is not confined to Cdk2 activation alone but relies on several other, distinct functions of the protein. J Biol Chem. 2002;277:39909-39918. [PubMed] [DOI] |
| 21. | Fujita M, Takeshita H, Sawa H. Cyclin E and CDK2 repress the terminal differentiation of quiescent cells after asymmetric division in C. elegans. PLoS One. 2007;2:e407. [PubMed] [DOI] |
| 22. | Iacovelli J, Lopera J, Bott M, Baldwin E, Khaled A, Uddin N, Fernandez-Valle C. Serum and forskolin cooperate to promote G1 progression in Schwann cells by differentially regulating cyclin D1, cyclin E1, and p27Kip expression. Glia. 2007;55:1638-1647. [PubMed] [DOI] |
| 23. | Nauman A, Turowska O, Poplawski P, Master A, Tanski Z, Puzianowska-Kuznicka M. Elevated cyclin E level in human clear cell renal cell carcinoma: possible causes and consequences. Acta Biochim Pol. 2007;54:595-602. [PubMed] |
| 24. | Keck JM, Summers MK, Tedesco D, Ekholm-Reed S, Chuang LC, Jackson PK, Reed SI. Cyclin E overexpression impairs progression through mitosis by inhibiting APC(Cdh1). J Cell Biol. 2007;178:371-385. [PubMed] [DOI] |
| 25. | Takasu S, Tsukamoto T, Ushijima T, Yamashita S, Ogasawara N, Ban H, Yanai T, Masegi T, Tatematsu M. Cyclin D1 overexpression in N-methyl-N'-nitro-N-nitrosoguanidine-induced rat gastric adenocarcinomas. Exp Toxicol Pathol. 2007;59:171-175. [PubMed] [DOI] |
| 26. | Denicourt C, Saenz CC, Datnow B, Cui XS, Dowdy SF. Relocalized p27Kip1 tumor suppressor functions as a cytoplasmic metastatic oncogene in melanoma. Cancer Res. 2007;67:9238-9243. [PubMed] [DOI] |
| 27. | Besson A, Hwang HC, Cicero S, Donovan SL, Gurian-West M, Johnson D, Clurman BE, Dyer MA, Roberts JM. Discovery of an oncogenic activity in p27Kip1 that causes stem cell expansion and a multiple tumor phenotype. Genes Dev. 2007;21:1731-1746. [PubMed] [DOI] |
| 28. | Cianga C, Cianga P, Cozma L, Diaconu C, Carasevici E. Low p27(Kip1)expression is associated with poor prognostic factors in breast carcinomas. J BUON. 2002;7:117-120. [PubMed] |
| 29. | Chen J, Willingham T, Shuford M, Nisen PD. Tumor suppression and inhibition of aneuploid cell accumulation in human brain tumor cells by ectopic overexpression of the cyclin-dependent kinase inhibitor p27KIP1. J Clin Invest. 1996;97:1983-1988. [PubMed] [DOI] |