修回日期: 2007-12-11
接受日期: 2007-12-12
在线出版日期: 2007-12-28
肝病及肝外肿瘤患者血γ-谷氨酰移换酶(GGT, EC 2.3.2.2)总活性均异常, 肝癌患者血清经聚丙烯酰胺梯度凝胶电泳, 可将GGT分出十多种亚组分(Ⅰ, Ⅰ', Ⅱ, Ⅱ', β, δ, ε, φA, ⅦB, φC, γA, γB), 而其中Ⅰ', Ⅱ, Ⅱ'为肝癌所特有, 被称为肝癌特异性GGT(HS-GGT). 肝GGT基因表达与肝癌发展密切相关, 其基因亚型有胎肝型(F)、胎盘型(P)和肝癌细胞型(H), 基因型H主要见于肝癌组织. 众多的基础及临床研究证实HS-GGT和基因H亚型为肝癌特异标志, 具有较高的特异性和敏感性, 其分析有助于肝癌诊断与鉴别.
引文著录: 姚登福, 董志珍, 顾青青, 姚敏. GGT亚组分及基因亚型与肝癌的特异性诊断. 世界华人消化杂志 2007; 15(36): 3775-3781
Revised: December 11, 2007
Accepted: December 12, 2007
Published online: December 28, 2007
Abnormal expression of total γ-glutamyl transferase (GGT, EC 2.3.2.2) activity can be found in patients with different liver diseases and extrahepatic tumors. Circulating GGT from hepatocellular carcinoma (HCC) patients can be divided into different isoforms (Ⅰ, Ⅰ', Ⅱ, Ⅱ', β, δ, ε, φA, ⅦB, φC, γA, γB) by using PAGE. Some of these isoforms (Ⅰ', Ⅱ and Ⅱ', and hepatoma-specific GGT, HS-GGT) can be detected in sera of HCC patients. Hepatic GGT gene expression may be closely related to the development of HCC. The human cDNA sequences from fetal liver, placenta and HepG2 cells (H) were investigated. The genotype H was predominant in cancerous tissues of HCC. Both HS-GGT and genotype H were confirmed as useful specific HCC markers, with higher specificity and sensitivity, and their analysis may be useful for HCC diagnosis and differentiation.
- Citation: Yao DF, Dong ZZ, Gu QQ, Yao M. Specific diagnosis of gamma-glutamyl transferase subfraction and its genotyping for hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3775-3781
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3775
肝癌(HCC)是由病毒、化学致癌物等多病因作用, 因癌基因或癌相关基因激活、抗癌基因失活或胚胎期某些癌基因重新复活等诸多因素引起肝细胞生长失控而致癌变[1], 经启动、促进、演变多阶段的发病过程[2], 其中数百种基因调控和表达与肝癌发生、发展密切相关[3], 患癌背景绝大多数与肝炎病毒(HBV、HCV)的慢性持续性感染有关, 并伴有肝硬化基础[4-5]. 临床上, 肝癌在确诊时已多属中、晚期, 缺乏有效治疗, 术后易复发及远处转移, 预后较差, 早期诊断至关重要. 肝癌研究的主要成就之一是早诊早治, 今后仍应作为主攻方向. 基因组学、蛋白组学、分子诊断技术已用于肝癌的早期发现、术后复发、转移监测, 正向高度灵敏、特异诊断方向发展[6-7]. 临床应用证明除肝癌特异性甲胎蛋白(HS-AFP)外, 总γ-谷氨酰转移酶(γ-glutamyl transferase, GGT)分子中的肝癌特异性亚型(HS-GGT)及其GGT基因型对肝癌的诊断最具有特异性[8-9]. GGT基因表达、HS-GGT及GGT基因型对肝癌发病机制研究及临床诊断具有应用前景.
人GGT基因属于一个多基因家族(至少7种基因), 以适应高度生理变异及不同生理状态下的表达[10]. GGT基因位于22号染色体上, 存在着一个q11-qter的BCR基因相关区域, 编码有效的GGT. 通过对人肝癌组织克隆的GGT cDNA研究显示, 全长约2326 bp, 由1707个核苷酸组成, 可编码569个氨基酸组成的肽链; 5'-末端非编码区域(5'-NC区)有774个核苷酸; 3'-末端(3'-NC区)由132个核苷酸组成并含有AATAAA结构. 人GGT基因至少编码以下几种mRNA: GGT-Ⅰ mRNA主要编码人体正常组织的GGT, 并且具有组织特异性; 去除了顶端结构的GGT-Ⅰ mRNA主要编码GGT轻链; GGT-Ⅱ mRNA主要在肝脏中表达; GGT-Ⅲ mRNA是另外一个去除了顶端的基因转录产物, 其结构尚不清楚[11]. GGT-Ⅰ mRNA主要存在于胰腺、胎盘、胎肝、肺以及肝癌组织细胞中, 不同组织中的GGT-Ⅰ mRNA可读框架(ORF)相同, 主要区别在于其5'-NC区. 在5'-NC区至少存在8种外显子, 他们的可变剪接调控着GGT-Ⅰ mRNA在不同组织中的表达. 在肝胚胎细胞分化的不同阶段, GGT-Ⅰ基因的表达受到不同启动子的驱使和调控, 并产生不同的mRNA[12].
肝癌的发生与DNA合成及核酸代谢旺盛密切相关[13-14]. 肝癌模型研究显示, 在肝细胞发生癌变过程中, 从肝细胞变性、癌前病变和癌变各个阶段, 肝总RNA呈梯度进行性增加, 肝GGT mRNA变化与总RNA相平行[15-16]. 但在人肝癌的癌灶组织、癌周组织和远癌组织中, 总RNA浓度在各组间差异显著[17], 人肝癌发生经过不同程度肝炎、肝硬化到肝癌长达数十年的发病过程, 其中包括肝细胞坏死、结节样增生、假小叶形成、大量的纤维结缔组织代替正常肝细胞使肿瘤组织残存肝细胞减少, 同时伴肿瘤组织出血、坏死, 则表现为有形细胞成分减少, 组织总RNA减少, 其复杂机制有待阐明[18-19].
体内GGT既与生物转化、核酸代谢及肿瘤发生有密切关系, 又反映肝细胞恶性病变[20]. 体内GGT催化谷胱甘肽及其结合物的降解, 为γ-谷氨酰循环中的关键酶, 其功能与解毒和蛋白合成有关[15]. 肝细胞癌变过程中, 总基因组DNA甲基化水平、部分癌基因及癌相关基因如c-fos等呈低甲基化状态, DNA胞嘧啶残基的甲基化, 特别是CCGG序列内位C甲基化状态与基因的调控和表达有密切关系[21-22]. 胚胎期肝内GGT活性最高, 出生后逐步降至较低水平; 肝细胞发生癌变时, 肝GGT重新大量表达, 并且出现较明显的异质性改变. 在致癌剂(2-FAA)诱发肝癌形成过程中, GGT表达与肝细胞癌变呈正相关[23-24], 以癌变组织GGT水平最高, GGT在癌变过程中呈动态改变, 动物实验中GGT变化特点表现为8 wk最高峰, 然后仍维持较高水平; 肝癌模型发现癌组织GGT表达接近胎肝GGT水平[25], 肝癌组织GGT基因所编译的肽链与胎肝GGT酶蛋白相一致[26]. 人肝癌形成多伴有肝炎或/和肝硬化, 且多数伴有HBV感染, 往往是从慢性肝炎到肝硬化到肝癌的多阶段过程, GGT表达为癌组织高于病变为肝硬化和/或慢性肝炎的癌周组织(多数伴不典型增生). 肝癌形成过程中GGT活性变化, 随肝病理学呈平行关系, 为肝细胞恶性病变的灵敏标志酶[27-29].
GGT基因5'-NC区含6个CCGG位点, 以RT-PCR扩增GGT基因片段, 利用HapⅡ能识别并切断未甲基化CCGG序列, 可推测扩增片段中M3位点甲基化程度. 癌组织GGT基因扩增片段检出率为100%, 癌周和远癌组分别为85%和75%[30]. 对M3位点的酶切分析, 发现在肝癌、癌周和远癌组织中M3位点甲基化程度均低于30%, 呈广泛的低甲基化状态, 各组内未甲基化例与甲基化例的差别非常显著, 提示GGT表达受基因甲基化程度的调节[31]. 癌变过程中GGT基因去甲基化, 使已关闭的GGT基因重新活化, 过量表达GGT引起肝组织和血中酶活性的大幅度升高, 提示GGT基因低甲基化诱导GGT表达, 导致肝组织和血中GGT活性升高. 对LEC大鼠使用低甲基化5-杂氮胞嘧啶(5-aza), 使LEC大鼠5-甲基胞嘧啶含量明显的减少, 同时鼠GGT大量表达, 最终使该组大鼠发生肝肿瘤, 而对照组未发生这种变化, 说明肝细胞对低甲基化药物高度敏感, 且DNA甲基化减少在其发展为肝炎或肝肿瘤中起一定的作用. 以5-aza作用于高度甲基化的Fao细胞, 在引起脱甲基化作用同时, 出现GGT强烈而稳定的表达, 认为去甲基化增加GGT基因表达[32-34].
GGT分子由大小两个亚基组成, 重链由351个氨基酸残基组成, 轻链由189个氨基酸残基组成[35]. 重链前有一单一肽链(信号肽), 由27个氨基酸残基组成, 该链为脂溶性的, 将GGT固定在细胞膜上. GGT分子上分别有糖基化位点和酶活性中心, 在重链上有6个N-糖基化位点, 轻链有一个糖化位点. GGT有非磷酸依赖性谷氨酰酶活性, 表明该酶有谷氨酰胺结合位点[12,36]. 肝细胞癌变过程中能合成和分泌多种与肝癌相关的蛋白质、多肽或同工酶. GGT亚型的区别在由于糖链结构的异常, 造成电泳上迁移率不同, 而蛋白质一级结构相同, 酶分子间糖基化作用有明显异质性, GGT在本质上是一种含天冬氨酰的N-连接糖蛋白, 正常肝脏含有完整的Gall-4GlcNAc外型糖链, 但在肝细胞癌变时, 表达的GGT却有一种独特的糖链结构, 表现为合成的糖链不全, 往往含有缺乏半乳糖(Gal)的外型糖链[37-38].
正常肝内GGT以细胞膜上的膜结合型和存在于胞质中的可溶型两种形式存在, 以前者为主, 后者仅占10%左右[39]. 人、鼠肝癌形成过程中, 不同分子形式可溶型和膜结合型GGT亦呈同步升高趋势, 但可溶型GGT与总GGT比值恒定于0.51-0.65, 提示可溶型GGT相对更明显的增加可能通过酶促反应使肝脏解毒及生物转化功能加强, 以解除病毒、化学致癌剂等毒性作用, 保护正常肝脏免受启动因素及促癌因素影响, 同时造成肝组织病理性损害[40]. 且组织GGT以可溶性GGT和膜结合性GGT两种形式存在. 癌组织总GGT和不同分子形式的GGT, 均非常明显地高于癌周和远癌组[41].
肝癌GGT等电点为3.8, 应用阶段梯度聚丙烯酰胺凝胶电泳[42]可将GGT分成1-12条区带(Ⅰ,Ⅰ',Ⅱ,Ⅱ', β, δ, ε, φA, ⅦB, φC, γA, γB), 其中Ⅱ、Ⅰ'、Ⅱ'被称为HS-GGT, 国外报道阳性率为27%-54%[43]. 国内首先建立并报道以阶段梯度聚丙烯酰胺凝胶电泳分离HS-GGT方法, 并加以改进使HS-GGT诊断HCC阳性率提高到85%左右[44]; 多项肝癌标志比较, HS-GGT阳性率为85.1%, AFP(76.2%); AFP假阴性肝癌(<50 µg/L)为84.0%; 小肝癌为78.6%(AFP仅为50%); 与AFP浓度或肿瘤大小无明显相关; 中晚期肝癌中的阳性率, 两者间无显著性差异, 但在AFP低浓度或小肝癌中, 其临床价值优于AFP. 对肝癌行TAE术后HS-GGT阴性, 病情较稳定, 也是监测肝癌是否被切除或复发的有用指标[45-46]. HS-GGT表达与AFP浓度无关, 对AFP高浓度或低浓度肝癌的诊断都具较高临床价值. HS-GGT在诊断肝癌方面优于AFP, 随着对GGT基因的深入研究, 可望成为监测肝细胞早期癌变的灵敏方法.
另一研究说明HS-GGT是AFP以外的最佳肝癌标记, 诊断HCC的阳性率在80%左右, 特异性97.1%. 对低浓度AFP(<200 µg/L)和假阴性HCC的诊断率分别为80.0%和77.8%[47]. 随访HS-GGT阳性但无肝癌证据的病例, 在2-20 mo内24.2%发生肝癌, 其中73.3%为小肝癌. 使用HS-GGT和AFP两项指标, 可使诊断HCC的阳性率提高到94.4%[48]. 通过筛选亦认为HS-GGT、异常凝血酶原(DCP)、AFP异质体可作为AFP以外的第二线最佳肝癌标志物, 与AFP联合检测会大大提高HCC的阳性检出率[49-50].
Yao et al[51-52]在国内外首先建立并报道了HS-GGT定量诊断HCC方法, 定量诊断阳性率为85.3%, 在AFP阴性HCC78.3%, 小肝癌为75%, 并可动态观察HS-GGT活性变化; 对HCC患者血清肝癌特异性区带(HSB)进行定量分析, 与慢性肝炎和肝外肿瘤组比较有显著性差异. 而非肝癌患者全部阴性, 表明检测HSB对HCC诊断有较高的敏感性和特异性[53-54]. HSB在健康人几乎测不出, 急性肝炎、慢性肝炎、肝硬化、恶性胆道梗阻及其他肿瘤仅有极低水平的表达, 都在5.5 IU/L以下, 提示肝癌组织表达的GGT与正常GGT有差别.
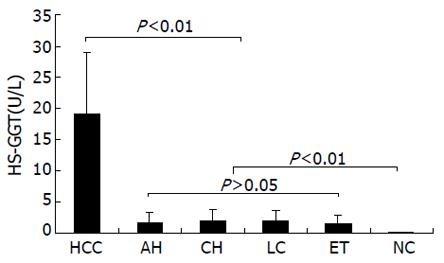
对HS-GGT的定量分析, 发现肝癌组HS-GGT活性明显升高; 除极少数肝硬化或慢性肝炎患者轻度升高外, 其余肝病及肝外肿瘤均在正常范围内; 对肝癌诊断特异性为87%(图1), 且对总GGT明显升高的肝外肿瘤鉴别也具有临床价值; 肝癌术后HS-GGT活性明显下降, 说明HS-GGT来源于肝癌组织, 他的表达水平反映肝细胞癌变. HSB与AFP浓度或肿瘤大小无相关性; 在中晚期肝癌患者中的阳性率, 二者比较无显著性差异, 但在AFP低浓度肝癌或小肝癌中, 其临床价值优于AFP. 对肝癌行TAE术后, HSB活性均降至5.5 IU/L以下, HSB是监测肝癌被切除或复发的有用指标. 在AFP浓度高于50 mg/L的肝癌中, HS-GGT异常率为89.7%; 在AFP低于50 mg/L的肝癌中, 异常率占79.6%. 说明HS-GGT的表达与AFP浓度无关, 对肝癌诊断具有较高的临床价值[55].
以梯度聚丙烯酰胺凝胶电泳分离HS-GGT, 方法繁琐. 免疫学检测方法有多克隆抗体和单克隆抗体的检测法. 多克隆抗体以提取和纯化的人HS-GGT酶蛋白免疫新西兰兔, 制备得抗血清[56-57]. 建立HS-GGT火箭电泳测定法, 对原发性肝癌及其他非癌性肝病等患者检测. 此法对HCC诊断的敏感性和特异性分别为86.9%和92.1%, 肝外肿瘤、孕妇、正常人全都阴性,而在急性肝炎、慢性肝炎和肝硬化标本中分别有15%、5%和10%表现为弱阳性. 在早期和AFP阴性的HCC中, 亦具有较高的阳性率, 表明该法有助于肝癌的诊断, 包括早期和AFP阴性HCC具有定性诊断和开发推广价值[58].
单克隆抗体的检测法纯化HS-GGT免疫BALB/C小鼠, 利用杂交瘤技术制备单克隆抗体[59]. 采用免疫酶斑点法与电泳法同步检测肝癌和良性肝病患者血清HS-GGT. 单克隆抗体免疫酶斑点法检测HS-GGT对肝细胞癌的诊断阳性率71.5%与电泳法76.4%相比无明显差异. 但免疫酶斑点法假阳性率(肝硬化23.7%, 慢性肝炎27.1%)高于电泳法(肝硬化10%, 慢性肝炎8.4%). 单克隆抗体免疫酶斑点法检测HS-GGT对肝细胞肝癌诊断有一定价值, 但诊断特异性有待提高. 电泳法相比单抗免疫酶斑点检测法检测HS-GGT, 操作简便、无需特殊试剂和设备、易于推广, 但存在良性肝病假阳性率过高的不足, 如何提高免疫法检测HS-GGT特异性有待研究.
早期诊断和术后复发仍是肝癌研究的重点[60-62], 在肝癌发生过程中的早期监测及随肝癌细胞进入外周血的基因标志, 有助于两大问题解决. HS-GGT和AFP mRNA联合分析在肝癌诊断和术后复发监测中具有重要临床价值. 从肝癌患者外周血有核细胞中提取总RNA, 以逆转录聚合酶链反应(RT-PCR)扩增分析AFP mRNA, 同时定量分析患者血HS-GGT水平, 比较他们在肝癌诊断中的临床价值. 所设计RT-PCR扩增AFP基因片段大小为159 bp, 肝癌患者外周血AFP mRNA阳性率为60.3%, 显著高于急性肝炎、慢性肝炎、肝硬化、肝外肿瘤及正常对照组[63]. 另外AFP-mRNA阳性率, 在AFP浓度低于50 mg/L肝癌组中为57.1%, 在伴肝外转移的肝癌组中全数阳性. AFP mRNA阳性与肿瘤大小间无明显相关性, 与HS-GGT联合诊断肝癌阳性率达93.6%[64]. HS-GGT定量有助于肝癌早期诊断[26,65], 而外周血AFP mRNA分析, 有助于肝癌远处转移或术后复发的监测[66-68].
肝GGT基因可分为三种亚型: 即胎肝(F)、胎盘(P)和肝癌细胞型(H)亚型[69]. 正常肝、良性肝病及肝转移癌癌周组织, 以F亚型为主; 肝癌、癌旁及远癌组织中H亚型阳性率显著高于正常及良性肝病肝组织; 肝癌组织F亚型阳性率明显低于正常及良性肝病肝组织. GGT mRNA亚型转化与肝癌发生有密切关系[70]. 应用PCR特异性引物检测, 证实在正常肝脏主要为F亚型, 多数标本为单基因型(F亚型), 部分标本为复合基因型, 复合基因型一般为F与P亚型组合. 良性肝病肝组织的GGT mRNA亚型与正常肝组织相似, 主要为F亚型. 肝癌组织中主要为H亚型, 癌旁组织及远癌组织中主要为F和H亚型. 肝癌癌组织及癌旁、远癌组织H亚型的阳性率明显高于正常肝组织及良性肝病组织, 而肝癌组织F亚型的阳性率则显著低于正常及良性肝病肝组织, 远癌及癌旁肝组织的F亚型阳性率与正常及良性肝病肝组织相似. 肝细胞癌变过程中存在着GGT mRNA由F亚型向H亚型的转换. 癌旁及远癌组织中H亚型阳性率与癌组织相似, 说明F亚型向H亚型的转化可能发生于癌前期病变. 良性肝病患者, H亚型阳性可能为肝细胞的癌前期病变, 须观察[71-73].
肝癌组织中端粒酶逆转录酶(hTERT)基因及GGT mRNA H亚型表达, 与肝癌发生关系密切. 应用RT-PCR法检测肝癌组织及癌周组织、良性肝组织、对照肝组织的hTERT与GGT mRNA H亚型, 肝癌组织hTERT阳性率为86.2%, GGT mRNA H亚型阳性率为93.8%, AFP阳性率为61.5%; hTERT在小肝癌癌组织阳性表达率80.0%, GGT mRNA H亚型阳性表达率为90.0%, 显著高于对照组. 急慢性肝炎组、肝硬化组与对照组比较, hTERT、GGT mRNA H亚型阳性表达率虽高, 但差异无显著性. 肝癌组织hTERT、GGT mRNA H亚型联合分析可弥补AFP的不足, 对肝癌具有早期诊断价值. 而在GGT升高的酒精性肝病, 肝组织hTERT呈阴性、GGT mRNA H亚型分布与正常肝组织相似, 绝大多数呈阴性, 与癌组织GGT mRNA H基因亚型分布不同. 端粒酶异常在癌形成中扮演重要角色, hTERT基因检测比AFP敏感、特异性高, 可望成为肝癌早期诊断的理想指标[74-75].
肝癌发生的分子机制复杂, 根本原因在于肝炎病毒的慢性感染、癌基因及癌相关基因的激活及抑癌基因的失活, 引起细胞生长失控, 肝细胞出现持续增殖, 最后导致癌变[76-78]. 与肝癌诊断相关的标志物很多, 但具特异性诊断价值的不多[79]. HS-GGT及基因型分析, 对长期慢性肝病患者有癌变倾向, 有助于肝癌早期发现与良恶性肝病的鉴别; 均为肝癌细胞产生, 如持续性升高, 应高度警惕癌变之可能; 作为肝癌特异性强、敏感性高标志, 对AFP阴性或低浓度肝癌及亚临床肝癌, 动态检测有助于肝癌早期诊断; 术后的动态检测, 可作为疗效判断及复发跟踪指标; GGT基因低甲基化倾向对肝细胞癌变可能起促进作用, 有助于探讨肝细胞癌变机制. 但HS-GGT异常表达机制、基因构成和肽链组成尚待研究. 总之, 对GGT基因表达、HS-GGT及GGT基因型分析, 对肝癌早期诊断具有应用前景, 并有助于肝癌发病机制探讨.
肝癌是由病毒、化学致癌物等多病因作用, 经启动、促进、演变多阶段的发病过程, 发癌背景绝大多数与HBV、HCV的慢性持续性感染有关. 肝癌在确诊时已多属中、晚期, 缺乏有效治疗, 预后较差, 早期诊断至关重要. 肝癌的早诊早治, 今后仍应作为主攻方向.
肝癌诊断相关的标志物很多, 但具特异性诊断价值的不多. 甲胎蛋白(AFP)诊断肝癌存在较高的假阳性和假阴性, 总γ-谷氨酰转移酶(GGT)分子中的肝癌特异性亚组分(HS-GGT)及GGT基因型对肝癌的诊断最具有特异性, 对肝癌早期诊断具有应用前景.
有研究资料显示HS-GGT除是AFP以外的最佳肝癌标记, 诊断HCC的阳性率在80%左右, 特异性97.1%. 对低浓度和假阴性AFP HCC的诊断率分别为80.0%和77.8%. HS-GGT分析与AFP联合检查可使诊断HCC的阳性率提高到94.4%.
HS-GGT及GGT基因H型, 均为肝癌细胞产生, 是肝癌诊断的特异标志, 如持续性升高, 应高度警惕癌变之可能; 对长期慢性肝病患者, 有助于肝癌早期发现与良恶性肝病的鉴别; 对AFP阴性或低浓度肝癌及亚临床肝癌, 动态检测有助于肝癌早期诊断; 术后的动态检测, 可作为疗效判断及复发跟踪指标, 并有助于探讨肝细胞癌变机制.
HS-GGT诊断肝癌具有应用前景, 主要有电泳法(定性和定量法)和免疫学(多克隆抗体和单克隆抗体)方法. 电泳法相比单抗免疫酶斑点检测法检测HS-GGT, 操作简便、无需特殊试剂和设备、易于推广, 但存在良性肝病假阳性率过高的不足, 如何提高免疫法检测HS-GGT特异性有待研究.
1 HS-GGT: 肝癌患者血清GGT经阶段梯度聚丙烯酰胺梯度凝胶电泳, 可分出十多种亚组分(Ⅰ, Ⅰ',Ⅱ,Ⅱ', β, δ, ε, φA, ⅦB, φC, γA, γB), 而其中Ⅰ', Ⅱ, Ⅱ'组分对肝癌诊断具有特异性, 被称为肝癌特异性GGT(HS-GGT).
2 肝GGT基因型: 可分为胎肝(F)、胎盘(P)和肝癌细胞(H)型. 正常肝、良性肝病及肝转移癌癌周组织, 以F亚型为主,肝癌组织以H亚型为主.
本文引用参考文献充分并适当, 文字表达准确, 流畅, 可读性强, 所得结论具有一定的科学性, 新颖性, 对进一步进行肝癌的基础, 临床研究和临床实际应用具有较好的指导作用.
编辑: 程剑侠 电编: 何基才
| 1. | Srivatanakul P, Sriplung H, Deerasamee S. Epidemiology of liver cancer: an overview. Asian Pac J Cancer Prev. 2004;5:118-125. [PubMed] |
| 2. | Yu AS, Keeffe EB. Management of hepatocellular carcinoma. Rev Gastroenterol Disord. 2003;3:8-24. [PubMed] |
| 3. | Lee JS, Thorgeirsson SS. Genetic profiling of human hepatocellular carcinoma. Semin Liver Dis. 2005;25:125-132. [PubMed] [DOI] |
| 4. | Raza SA, Clifford GM, Franceschi S. Worldwide variation in the relative importance of hepatitis B and hepatitis C viruses in hepatocellular carcinoma: a systematic review. Br J Cancer. 2007;96:1127-1134. [PubMed] [DOI] |
| 5. | Chan DW, Ng IO. Knock-down of hepatitis B virus X protein reduces the tumorigenicity of hepatocellular carcinoma cells. J Pathol. 2006;208:372-380. [PubMed] [DOI] |
| 6. | Peto J. Cancer epidemiology in the last century and the next decade. Nature. 2001;411:390-395. [PubMed] [DOI] |
| 7. | Zhou L, Liu J, Luo F. Serum tumor markers for detection of hepatocellular carcinoma. World J Gastroenterol. 2006;12:1175-1181. [PubMed] [DOI] |
| 8. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 9. | Giannini EG, Testa R, Savarino V. Liver enzyme alteration: a guide for clinicians. CMAJ. 2005;172:367-379. [PubMed] [DOI] |
| 10. | Whitfield JB. Gamma glutamyl transferase. Crit Rev Clin Lab Sci. 2001;38:263-355. [PubMed] [DOI] |
| 11. | Ikeda Y, Taniguchi N. Gene expression of gamma-glutamyltranspeptidase. Methods Enzymol. 2005;401:408-425. [PubMed] [DOI] |
| 12. | Pettersen I, Andersen JH, Bjornland K, Mathisen Ø, Bremnes R, Wellman M, Visvikis A, Huseby NE. Heterogeneity in gamma-glutamyltransferase mRNA expression and glycan structures. Search for tumor-specific variants in human liver metastases and colon carcinoma cells. Biochim Biophys Acta. 2003;1648:210-218. [PubMed] [DOI] |
| 13. | Kitten O, Ferry N. Mature hepatocytes actively divide and express gamma-glutamyl transpeptidase after D-galactosamine liver injury. Liver. 1998;18:398-404. [PubMed] [DOI] |
| 14. | Yao DF, Dong ZZ. Hepatoma-related gamma-glutamyl transferase in laboratory or clinical diagnosis of hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2007;6:9-11. [PubMed] |
| 15. | Yao DF, Dong ZZ, Yao DB, Wu XH, Wu W, Qiu LW, Wang HM, Meng XY. Abnormal expression of hepatoma-derived gamma-glutamyltransferase subtyping and its early alteration for carcinogenesis of hepatocytes. Hepatobiliary Pancreat Dis Int. 2004;3:564-570. [PubMed] |
| 16. | Tang QY, Yao DF, Lu JX, Wu XH, Meng XY. Expression and alterations of different molecular form gamma-glutamyl trans ferase and total RNA concentration during the carcinogenesis of rat hepatoma. World J Gastroenterol. 1999;5:356-358. [PubMed] [DOI] |
| 17. | 刘 艳华, 姚 登福, 汤 琪云, 吴 信华, 吴 玮, 陆 建新, 邱 历伟, 孟 宪镛. 人肝癌组织中总RNA浓度和GGT异常表达关系的研究. 临床肝胆病杂志. 1999;15:215-218. |
| 18. | Coleman WB. Mechanisms of human hepatocarcinogenesis. Curr Mol Med. 2003;3:573-588. [PubMed] [DOI] |
| 19. | Izumi M. Isolation, characterization and clinical evaluation of the gamma-glutamyltransferase associated with hepatocellular carcinoma. Acta Med Okayama. 1985;39:19-33. [PubMed] |
| 20. | Pastore A, Federici G, Bertini E, Piemonte F. Analysis of glutathione: implication in redox and detoxification. Clin Chim Acta. 2003;333:19-39. [PubMed] [DOI] |
| 21. | Kovalszky Z, Lapis K, Jeney A. Marker Enzymes of Rat Chemical Hepatocarcinogenesis in Human Liver Tumors. Pathol Oncol Res. 1996;2:56-58. [PubMed] [DOI] |
| 22. | Kojiro M, Roskams T. Early hepatocellular carcinoma and dysplastic nodules. Semin Liver Dis. 2005;25:133-142. [PubMed] [DOI] |
| 24. | Sidransky D. Emerging molecular markers of cancer. Nat Rev Cancer. 2002;2:210-219. [PubMed] [DOI] |
| 25. | Leoni S, Piscaglia F, Righini R, Bolondi L. Management of small hepatocellular carcinoma. Acta Gastroenterol Belg. 2006;69:230-235. [PubMed] |
| 26. | Yao D, Jiang D, Huang Z, Lu J, Tao Q, Yu Z, Meng X. Abnormal expression of hepatoma specific gamma-glutamyl transferase and alteration of gamma-glutamyl transferase gene methylation status in patients with hepatocellular carcinoma. Cancer. 2000;88:761-769. [PubMed] [DOI] |
| 27. | Thorgeirsson SS, Grisham JW. Molecular pathogenesis of human hepatocellular carcinoma. Nat Genet. 2002;31:339-346. [PubMed] [DOI] |
| 28. | 汤 琪云, 姚 登福, 刘 艳华. DNA甲基化水平与肝癌发生关系的研究进展. 胃肠病学和肝病学杂志. 1999;8:166-169. |
| 29. | Thorgeirsson SS, Lee JS, Grisham JW. Molecular prognostication of liver cancer: end of the beginning. J Hepatol. 2006;44:798-805. [PubMed] [DOI] |
| 30. | Yao D, Tang Q, Meng X. [Relationship between methylation status of gamma-glutamyl transpeptidase (GGT) genes and abnormal expression of its enzyme proteins in tissues of human hepatomas]. Zhonghua Gan Zang Bing Za Zhi. 1999;7:132-134. [PubMed] |
| 31. | 汤 琪云, 姚 登福, 刘 艳华, 孟 宪镛, 杨 树成, 吴 信华, 吴 玮, 陆 建新. 人肝癌组织中g-谷氨酰转移酶异常表达及其基因甲基化程度的研究. 中华消化杂志. 1999;19:168-171. |
| 32. | Chan AO, Rashid A. CpG island methylation in precursors of gastrointestinal malignancies. Curr Mol Med. 2006;6:401-408. [PubMed] [DOI] |
| 33. | Zhang C, Li Z, Cheng Y, Jia F, Li R, Wu M, Li K, Wei L. CpG island methylator phenotype association with elevated serum alpha-fetoprotein level in hepatocellular carcinoma. Clin Cancer Res. 2007;13:944-952. [PubMed] [DOI] |
| 34. | Sawaki M, Enomoto K, Takahashi H, Nakajima Y, Mori M. Phenotype of preneoplastic and neoplastic liver lesions during spontaneous liver carcinogenesis of LEC rats. Carcinogenesis. 1990;11:1857-1861. [PubMed] [DOI] |
| 36. | Yao DF, Zhu Y, Wu XH, Wu W, Qiu LW. [Clinical values of vascular endothelial growth factor expression and microvascular density analysis in liver cancer specimens]. Zhonghua Gan Zang Bing Za Zhi. 2004;12:92-94. [PubMed] |
| 37. | Kang HJ, Kim BC, Park EH, Ahn K, Lim CJ. The gene encoding gamma-glutamyl transpeptidase II in the fission yeast is regulated by oxidative and metabolic stress. J Biochem Mol Biol. 2005;38:609-618. [PubMed] [DOI] |
| 38. | Niida S, Kawahara M, Ishizuka Y, Ikeda Y, Kondo T, Hibi T, Suzuki Y, Ikeda K, Taniguchi N. Gamma-glutamyltranspeptidase stimulates receptor activator of nuclear factor-kappaB ligand expression independent of its enzymatic activity and serves as a pathological bone-resorbing factor. J Biol Chem. 2004;279:5752-5756. [PubMed] [DOI] |
| 39. | Yao D, Jiang D, Wu X. [Experimental study on value of carcino-embryonic gama-glutamyl transferase isoenzymes for monitoring carcinogenesis of hepatocytes]. Zhonghua Gan Zang Bing Za Zhi. 2000;8:30-32. [PubMed] |
| 40. | 姚 登福, 卜 召祥, 孟 宪镛. 外周血基因标志监测肝癌微小转移的临床价值. 胃肠病学和肝病学杂志. 2004;13:551-555. |
| 41. | Cohen MB, Beckstead JH, Ferrell LD, Yen TS. Enzyme histochemistry of hepatocellular neoplasms. Am J Surg Pathol. 1986;10:789-794. [PubMed] [DOI] |
| 42. | Sawabu N, Nakagen M, Yoneda M, Makino H, Kameda S, Kobayashi K, Hattori N, Ishii M. Novel gamma-glutamyl transpeptidase isoenzyme specifically found in sera of patients with hepatocellular carcinoma. Gan. 1978;69:601-605. [PubMed] |
| 43. | Suzuki H. Clinical significance of appearance of serum gamma-glutamyl transpeptidase isozyme. Gastroenterol Jpn. 1981;16:122-128. [PubMed] |
| 46. | Tang ZY. Hepatocellular carcinoma surgery--review of the past and prospects for the 21st century. J Surg Oncol. 2005;91:95-96. [PubMed] [DOI] |
| 47. | Xu K, Meng XY, Wu JW, Shen B, Shi YC, Wei Q. Diagnostic value of serum gamma-glutamyl transferase isoenzyme for hepatocellular carcinoma: a 10-year study. Am J Gastroenterol. 1992;87:991-995. [PubMed] |
| 48. | Yu ZJ, Yu JW, Cai W, Yuan HX, Li XY, Yuan Y, Chen JP, Wu XY, Yao DF. Evaluation of HCPTd1,d14-double passaged intervening chemotherapy protocol for hepatocellular carcinoma. World J Gastroenterol. 2005;11:5221-5225. [PubMed] |
| 49. | Cui R, He J, Zhang F, Wang B, Ding H, Shen H, Li Y, Chen X. Diagnostic value of protein induced by vitamin K absence (PIVKAII) and hepatoma-specific band of serum gamma-glutamyl transferase (GGTII) as hepatocellular carcinoma markers complementary to alpha-fetoprotein. Br J Cancer. 2003;88:1878-1882. [PubMed] [DOI] |
| 50. | Morsi MI, Hussein AE, Mostafa M, El-Abd E, El-Moneim NA. Evaluation of tumour necrosis factor-alpha, soluble P-selectin, gamma-glutamyl transferase, glutathione S-transferase-pi and alpha-fetoprotein in patients with hepatocellular carcinoma before and during chemotherapy. Br J Biomed Sci. 2006;63:74-78. [PubMed] [DOI] |
| 52. | Yao DF, Huang ZW, Chen SZ, Huang JF, Lu JX, Xiao MB, Meng XY. Diagnosis of hepatocellular carcinoma by quantitative detection of hepatoma-specific bands of serum gamma-glutamyltransferase. Am J Clin Pathol. 1998;110:743-749. [PubMed] [DOI] |
| 54. | 姚 登福, 黄 介飞, 陈 澍周, 黄 中伟, 孟 宪镛. 肝癌特异性GGT的发生及其定量分析的临床价值. 胃肠病学和肝脏病学杂志. 1997;6:78-81. |
| 55. | 董 志珍, 姚 登福, 邱 历伟, 吴 玮, 吴 信华, 孟 宪镛. 定量分析肝癌特异性GGT对肝癌诊断和鉴别价值的比较研究. 胃肠病学和肝病学杂志. 2000;9:54-56. |
| 60. | Tang ZY. Hepatocellular carcinoma--cause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [PubMed] [DOI] |
| 61. | Ijichi M, Takayama T, Matsumura M, Shiratori Y, Omata M, Makuuchi M. alpha-Fetoprotein mRNA in the circulation as a predictor of postsurgical recurrence of hepatocellular carcinoma: a prospective study. Hepatology. 2002;35:853-860. [PubMed] [DOI] |
| 62. | Funaki NO, Tanaka J, Seto SI, Kasamatsu T, Kaido T, Imamura M. Hematogenous spreading of hepatocellular carcinoma cells: possible participation in recurrence in the liver. Hepatology. 1997;25:564-568. [PubMed] [DOI] |
| 64. | Yao DF, Yao M, Qiu LW, Dong ZZ, Zong L, Meng XY. Comprehensive assessment of circulating AFP mRNA and HS-GGT for diagnosis of hepatocellular carcinoma and monitoring of its metastasis. Progress on Post-Genome Technologies. 2006;456-460. |
| 65. | Pavesi F, Lotzniker M, Scarabelli M, Garbagnoli P, Moratti R. Efficiency of composite laboratory tests in the diagnosis of liver malignancies. Int J Biol Markers. 1989;4:163-169. [PubMed] |
| 66. | 董 志珍, 姚 登福, 杨 大明, 于 志坚, 吴 信华, 吴 玮, 邱 历伟. HS-GGT和AFP-mRNA联合分析在肝癌诊断中的临床价值. 胃肠病学和肝病学杂志. 2003;12:263-266. |
| 67. | Chen XP, Zhao H, Zhao XP. Alternation of AFP-mRNA level detected in blood circulation during liver resection for HCC and its significance. World J Gastroenterol. 2002;8:818-821. [PubMed] |
| 68. | Yao F, Guo JM, Xu CF, Lou YL, Xiao BX, Zhou WH, Chen J, Hu YR, Liu Z, Hong GF. Detecting AFP mRNA in peripheral blood of the patients with hepatocellular carcinoma, liver cirrhosis and hepatitis. Clin Chim Acta. 2005;361:119-127. [PubMed] [DOI] |
| 69. | Han GQ, Qin CY, Shu RH. The analysis of gamma-glutamyl transpeptidase gene in different type liver tissues. World J Gastroenterol. 2003;9:276-280. [PubMed] [DOI] |
| 70. | Tsutsumi M, Sakamuro D, Takada A, Zang SC, Furukawa T, Taniguchi N. Detection of a unique gamma-glutamyl transpeptidase messenger RNA species closely related to the development of hepatocellular carcinoma in humans: a new candidate for early diagnosis of hepatocellular carcinoma. Hepatology. 1996;23:1093-1097. [PubMed] [DOI] |
| 74. | 姚 敏, 姚 登福, 吴 玮, 邱 历伟, 吴 信华, 苏 小琴, 邹 黎. 肝癌组织及外周血单核细胞端粒酶异常对肝癌诊断价值的研究. 胃肠病学和肝病学杂志. 2005;14; 564-567. |
| 75. | 秦 成坤, 张 启华, 徐 健, 刘 素侠, 韩 国庆. 肝癌组织端粒酶逆转录酶hTERT基因及GGT-mRNA-H亚型表达与肝癌早期诊断的研究. 中国现代普通外科进展. 2005;8:151-153. |
| 76. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 77. | Kim DG. Differentially expressed genes associated with hepatitis B virus HBx and MHBs protein function in hepatocellular carcinoma. Methods Mol Biol. 2006;317:141-155. [PubMed] |
| 78. | Jia HL, Ye QH, Qin LX, Budhu A, Forgues M, Chen Y, Liu YK, Sun HC, Wang L, Lu HZ. Gene expression profiling reveals potential biomarkers of human hepatocellular carcinoma. Clin Cancer Res. 2007;13:1133-1139. [PubMed] [DOI] |