修回日期: 2007-11-02
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 探讨全身热休克预处理对肠缺血-再灌注(ischemia/reperfusion, IR)损伤的保护作用.
方法: 将40只SD♂大鼠随机分为4组: 正常体温+假手术对照组(CTRL, n = 10), 正常体温+肠IR组(IR, n = 10), 41.5℃-42℃热休克+假手术组(42C, n = 10), 41.5℃- 42℃热休克+肠IR组(42IR, n = 10). Western blot检测肠黏膜HSP72蛋白表达, 原位末端缺口标记法(TUNEL)检测肠黏膜上皮细胞凋亡, 比色法检测肠黏膜caspase-3活性, Annexin-V/PI法流式细胞仪检测外周血白细胞凋亡比例.
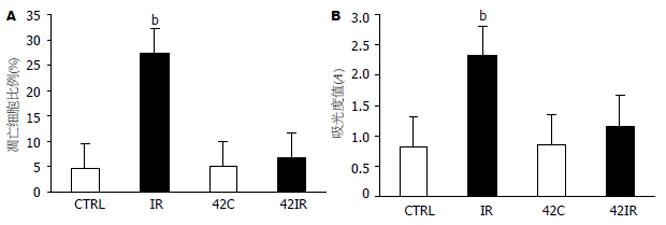
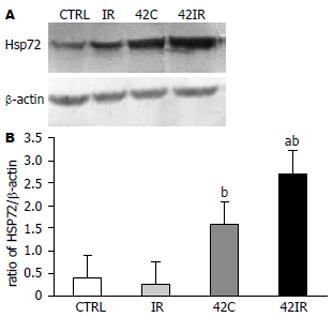
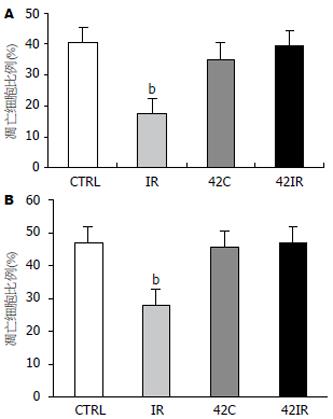
结果: 42C、42IR组HSP72蛋白表达水平比CTRL、IR组显著增高(1.59±0.32、2.71±0.64 vs 0.41±0.1、0.30±0.04, P<0.01). 42IR组caspase-3活性, 白细胞凋亡比例比IR组相比有显著性差异(1.16±0.31 vs 2.32±0.54; 39.65% vs 16.94%; P<0.01), 且42IR组肠黏膜上皮细胞凋亡指数比IR组明显减少. 42IR组与42C、CTRL组之间, caspase-3活性, 肠黏膜上皮细胞凋亡指数, 白细胞凋亡比例均无明显差异.
结论: 全身热休克预处理对肠缺血-再灌注损伤有保护作用, 其机制可能与增加热休克诱导HSP72的表达和抑制外周血白细胞激活有关.
引文著录: 莫燕娜, 王丹妹, 吉丽敏, 翁阳, 何佟, 陈世民. 热休克预处理对大鼠肠缺血-再灌注损伤的保护效应. 世界华人消化杂志 2007; 15(35): 3703-3709
Revised: November 2, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To investigate the protective effect of previous heat shock treatment on intestinal injury following mesenteric ischemia/reperfusion (I/R).
METHODS: Forty adult male Sprague-Dawley rats were divided into 4 groups (10 in each group): control group (CTRL), ischemia/reperfusion group (IR), previous heat shock treatment group (42C) and ischemia reperfusion group (42IR). The expression of HSP72 was examined in the small intestinal mucosa using Western blotting, and pathological changes in the ileal mucosal tissue were evaluated by microscopy. The apoptosis of intestinal mucosal epithelial cells was examined by terminal deoxylnucleotidyl transferase mediated-dUTP nick end labeling (TUNEL). The enzymatic activity of caspase-3 in mucosal cells was assayed colorimetrically. The percentage of peripheral blood leukocytes undergoing apoptosis was measured by flow cytometry using an annexin-V/PI double staining assay.
RESULTS: The expression of heat-shock protein 72 was significantly increased in 42C and 42IR rats compared with CTRL and IR rats (1.59 ± 0.32, 2.71 ± 0.64 vs 0.41 ± 0.1, 0.30 ± 0.04, P < 0.01). The enzymatic activity of caspase-3 decreased significantly in the 42IR group compared with the IR group (1.16 ± 0.31 vs 2.32 ± 0.54, P < 0.01). The percentage of peripheral blood leukocytes undergoing apoptosis was significantly higher in the 42IR group than in the IR group (39.65% vs 16.94%, P < 0.01). The number of mucosal epithelia cells undergoing apoptosis was decreased in the 42IR the compared with the IR group. There were no significant differences in the enzymatic activity of caspase-3, in the percentage of peripheral blood leukocytes undergoing apoptosis and in the number of mucosal epithelial cells undergoing apoptosis among 42IR, 42C and CTRL rats.
CONCLUSION: Whole body hyperthermia pretreatment can protect against subsequent mesenteric ischemia reperfusion injury by increased induction of heat shock protein 72 and inhibition of peripheral blood leukocyte activation in rats.
- Citation: Mo YN, Wang DM, Ji LM, Weng Y, He T, Chen SM. Protective effect of previous heat shock treatment on intestinal injury following mesenteric ischemia/reperfusion in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3703-3709
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3703.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3703
肠缺血-再灌注损伤(ischemia/reperfusion injury, IRI)是肠移植、严重创伤后常见的病理生理过程. 由于肠IRI不仅会引起肠组织的局部损伤, 还会由于肠屏障功能的受损, 渗透性增加, 而导致肠内细菌和毒素移位到体循环, 引起网状内皮系统发生系列反应, 诱发全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能不全综合征(multiple organ dysfunction syndrome, MODS)[1-2]. 白细胞在IRI的病理生理改变中起重要作用[3-5]. 白细胞激活是肠IRI过程中引起急性炎症反应的基础. 研究表明, 热休克预处理对包括小肠在内的器官缺血-再灌注损伤有保护作用[6-13], 但机制尚未阐明. 热休克预处理对肠IRI外周血白细胞的作用尚未清楚. 本研究在热休克预处理大鼠肠IRI模型上观察肠黏膜细胞凋亡, 以及外周血白细胞和中性粒细胞凋亡比例, 探讨热休克预处理对肠IRI白细胞变化的作用机制, 为临床防治肠IRI提供理论依据.
40只健康SD♂大鼠, 体质量200-230 g, 由中山大学实验动物中心提供. 随机分为4组: 正常体温+假手术对照组(CTRL, n = 10), 正常体温+肠IR组(IR, n = 10), 41.5-42℃热休克+假手术组(42C, n = 10), 41.5℃-42℃热休克+肠IR组(42IR, n = 10). 鼠抗诱导型HSP70(HSP72)mAb(SPA-810)购自美国Stressgen公司, 鼠抗β-actin mAb购自南京建成生物工程研究所, DAB显色试剂购自武汉博士得生物工程公司, caspase-3 Colorimetric Assay购自美国R&D公司, Annexin V-FITC细胞凋亡检测试剂盒购自美国ACTGene公司, 细胞凋亡原位末端标记法(TUNEL)试剂盒购自北京中杉金桥生物技术有限公司, 流式细胞仪: EPICSXL型, 美国库尔特公司, 酶标仪: Stat Fax-2100型, 美国Awareness; 低温高速台式离心机: 美国ICE公司; 光学显微镜: Olympus B×41型.
1.2.1 整体动物热休克反应模型和肠缺血-再灌注(IR)损伤模型的复制: 整体动物热休克反应模型的复制: 大鼠用30 g/L戊巴比妥钠(1.5 mL/kg体质量)麻醉后, 置55℃-58℃恒温水浴箱中, 使其肛温在20 min内升至41.5℃-42℃后, 转至42℃水浴箱中维持10 min, 然后置室温恢复24 h后, 进行下一步实验. IR损伤模型的复制: 大鼠实验前禁食12 h, 自由饮水. 手术前ip 30 g/L戊巴比妥钠(1.5 mL/kg体质量)麻醉, 经腹正中切口, 分离肠系膜上动脉(superior mesenteric. artery, SMA). 10 min后用微动脉夹夹闭SMA, 30 min后取出动脉夹, 恢复血液灌流. 假手术组只分离不夹闭SMA.
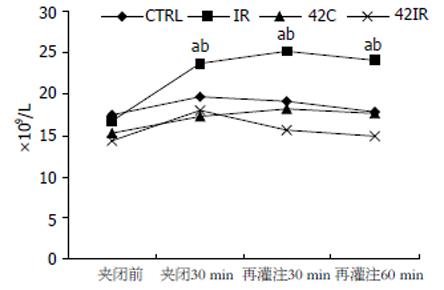
1.2.2 外周血样本采集, 白细胞悬液制备及白细胞计数: 于再灌注60 min及相应时点, 抽取颈总动脉血2 mL于肝素试管中, 2000 r/min离心10 min. 吸取中间的白细胞层, 先后加入18 g/L生理盐水和预冷PBS缓冲液, 离心收集白细胞. 于SMA夹闭前, 夹闭30 min、再灌注30 min、再灌注60 min, 分别取鼠尾血20 µL计算白细胞数.
1.2.3 肠组织样本及肠黏膜的采集: 再灌注60 min及相应时点, 自回盲部近端距回盲瓣10 cm处截取2 cm长度的小肠, 100 g/L甲醛溶液中固定后常规病理切片, HE染色观察肠组织形态学变化. 距回盲瓣12 cm处截取足够长度的小肠, 置预冷的生理盐水中, 纵向剖开, 轻柔漂洗2-3次, 刮取肠黏膜, 置-80℃冰箱贮存备用.
1.2.4 HSP72, 肠黏膜上皮细胞凋亡, 肠黏膜caspase-3活性和外周血白细胞凋亡和中性粒细胞凋亡比例检测: Western blot检测HSP72表达, 提取肠黏膜蛋白, 考马斯亮蓝(Bradford)法进行蛋白定量. 将样品的蛋白浓度调整一致, 取30 μL上样, 100 g/L Tris-甘氨酸SDS聚丙烯酰胺凝胶电泳. 电泳后转至PVDF膜上, 以20 g/L牛血清白蛋白封闭后, 一抗封闭4 h, 辣根过氧化物酶标记的二抗封闭1 h, β-actin为内对照, DAB显色. 用Scion Image软件计算HSP72的灰度值和β-actin的灰度值, 检测样本HSP72表达水平即HSP72灰度值/β-actin灰度值. TUNEL检测肠黏膜上皮细胞凋亡. 石蜡切片常规脱蜡至水, 3 mL/L H2O2封闭30 min, 切片滴加蛋白酶K(20 mg/L), 37℃ 15 min, 修复抗原. PBS洗3 min×3次, 滴加50 g/L小牛血清白蛋白, 37℃, 15 min, 封闭非特异性反应. 滴加TUNEL反应液20 μL(terminal deoxynucleotidyltransferaseTdT 2 μL, 荧光素连接的核苷酸混合缓冲液18 μL)置湿盒内, 37℃孵60 min, PBS洗3次, 加ConverterPOD于37℃ 30 min, PBS洗3次, 镜控下DAB显色. 胞核呈棕褐色即用自来水流水冲洗, 苏木精复染, 梯度乙醇脱水, 二甲苯透明, 树胶封片[14-15]. 高倍镜下见胞核呈棕褐色的细胞为凋亡细胞. 选5个高倍视野分别计数其凋亡细胞数和总细胞数, 以凋亡细胞数/总细胞数×100%作为凋亡指数. 肠黏膜caspase-3活性检测按试剂盒说明书进行操作, 用Stat Fax-2100型酶标仪, 波长 = 405 nm, 读取各孔吸光度值. 检测样本的caspase-3活性值即样本孔的吸光度值-对照孔的吸光度值. 外周血白细胞凋亡和中性粒细胞凋亡比例检测按试剂盒说明书操作. 收集1×106个外周血白细胞, 用100 μL染色液重悬细胞, 混匀后置15℃-25℃避光孵育10-15 min, 加入AnnexinV结合缓冲液, 通过流式细胞仪(Ex = 488 nm, Em = 530 nm)FL1通道检测AnnexinV-FITC荧光信号. FL2通道检测PI荧光信号. 计算右下角+右上角细胞比例为样本总的凋亡比例.
统计学处理 实验结果以mean±SD表示. 采用SPSS10.0统计软件对数据进行分析, 计量资料采用析因设计方差分析进行统计学分析, 白细胞计数变化采用重复测量方差分析. 以P<0.05判断为有统计学意义.
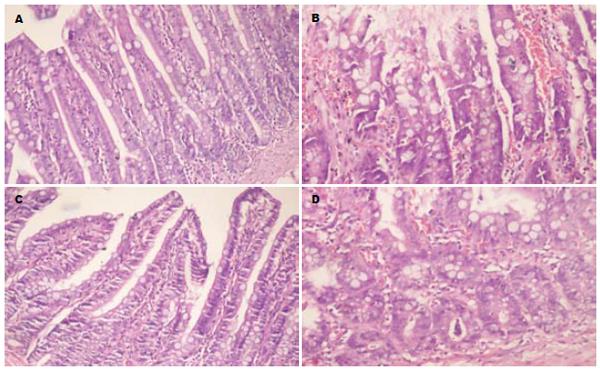
IR组和42IR组在夹闭SMA后, 见肠系膜血管搏动消失且肠壁由红润变为苍白. 松夹开放血管恢复血液再灌注后, 血管搏动恢复, 肠壁迅速充血. 再灌60 min时发现IR组肠明显淤血水肿, 部分肠段见点状出血, 腹腔可见大量积液. 而42IR组未见明显损伤表现, 少见轻度淤血, 偶见腹腔有少量液体. CTRL组和42C组未见损伤表现. 病理检测发现4组中IR组损伤最重, 镜下可见大量上皮细胞脱落, 绒毛水肿明显, 腺体明显受损, 有出血, 上皮下间隙明显增大, 固有层水肿、充血. 42IR组损伤明显减轻, 腺体轻度受损、少量脱落, 绒毛轻度水肿, 少见上皮下间隙扩大. CTRL组与42C组未见损伤表现(图1).
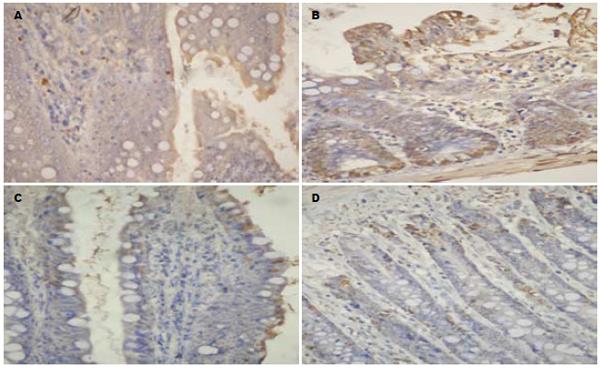
TUNEL法检测发现IR组见较密集的染色为棕褐色的凋亡上皮细胞, 42IR组只见较为稀疏的凋亡上皮细胞, CTRL组与42C组见到个别凋亡上皮细胞(图2). 4组大鼠肠黏膜上皮细胞凋亡指数比较见图3A, caspase-3活性值比较见图3B.
再灌注60 min及相应时点, 分别刮取各组大鼠回肠肠黏膜, Western blot检测肠黏膜HSP72蛋白的表达. 如图4所示, 热休克预处理组(42C、42IR)HSP72蛋白的表达较未经热休克处理组(CTRL、IR)显著增高. 该结果显示热休克反应模型的复制是成功的.
2.4.1 外周血白细胞数量的改变: IR组缺血30 min外周血白细胞数量就明显增高, 再灌注30 min增高更明显, 与缺血前相比有显著差异(P<0.05). 再灌注60 min时外周血白细胞数量维持在高水平, 与42IR组有显著差异(P<0.05). 42IR、42C、CTRL组各时相点外周血白细胞数量无差异(图5).
2.4.2 外周血白细胞和中性粒细胞凋亡比例(Anexin-V/PI法): 采用Anexin-V/PI法, 流式细胞仪检测4组大鼠外周血白细胞凋亡比例, 结果显示, IR组外周血白细胞和中性粒细胞凋亡比例显著降低. 42IR组与42C组、CTRL组无明显差别(图6).
直线相关分析显示, 肠黏膜上皮细胞凋亡指数、肠黏膜caspase-3活性值与肠黏膜HSP72蛋白的表达水平无相关(r = -0.278, r = -0.393, P>0.05).
从原核生物到人类, 所有的生物机体都能在多种应激原的作用下产生一系列细胞应激反应, 快速表达多种热休克蛋白(heat shock proteins, HSPs)[16-17]. 研究表明, 应激诱导机体表达HSPs, 可以耐受其他不利因素对机体细胞的损伤[18]. 诱导型HSP70(HSP72)可以作为应激反应的标志, 是HSPs中最受关注的一种[19]. 全身热处理(41.5-42℃)是经典的热休克反应模型, 能诱导HSPs表达, 尤以HSP70表达最丰富, 细胞应激后生成最显著[19].
我们给部分大鼠进行全身热休克处理后检测肠黏膜HSP72的表达, 结果热休克处理组HSP72表达水平较未经热处理组显著增加. 因此, 本实验中整体动物热休克模型的复制是成功的. 同时实验结果还显示, 42IR组肠黏膜HSP72蛋白的表达水平较42C组明显增加, 提示肠黏膜细胞在热诱导HSP72蛋白表达的基础上, 不仅能够耐受IR所致的损伤, 且IR作为一新的应激原可以增强热休克处理的作用, 诱导细胞表达更多的HSP72. 其确切机制有待阐明.
为探讨全身热休克预处理对肠IRI的作用, 我们对经热休克预处理的大鼠复制IRI模型, 同时观察肠黏膜形态学变化、检测肠黏膜上皮细胞凋亡指数、肠黏膜细胞caspase-3活性、外周血白细胞计数及外周血白细胞和中性粒细胞凋亡比例的变化.
实验结果显示, 经热休克预处理的大鼠在IR后肠黏膜病理形态学的改变较未经热处理组明显减轻, 肠黏膜上皮细胞凋亡指数和肠黏膜细胞caspase-3活性明显下降, 与42C和CTRL组无差异. 表明全身热休克预处理对肠IRI有保护作用, 这种保护效应与热休克诱导HSP72表达增加有关. 以往的研究发现, 热应激后细胞产生的HSPs, 能对其他应激原产生交叉耐受而发挥细胞保护效应[20], 可诱导性HSP的表达增加和增强细胞抗凋亡作用[21]. HSP70能抑制通过Fas传导通路诱导的caspase-8/3的活化而防止细胞凋亡[22]. Baba et al[23]的研究却发现, 绵羊心肌HSP72表达增加与TUNEL指数呈正相关, 同时发现表达HSP72的细胞个体并不能预防其本身发生凋亡. 本试验结果显示, 肠黏膜HSP72蛋白的表达水平与肠黏膜上皮细胞凋亡指数没有显著的相关(r = -0.278, P = 0.05), 与caspase-3活性值也没有显著的相关(r = -0.393, P = 0.05), 这与以往在其他组织中的研究结果不一致. 说明HSP72表达与细胞凋亡指数的关系非常复杂, HSP72可能不是直接起抗凋亡作用, 而是通过抑制白细胞或其他途径间接起作用.
同时检测外周血白细胞计数、外周血白细胞和中性粒细胞凋亡比例, 发现热休克预处理组外周血白细胞计数、外周血白细胞和中性粒细胞凋亡比例与IR组有显著差异. 热休克预处理组外周血白细胞计数比IR组低, 但外周血白细胞和中性粒细胞凋亡比例比IR组高, 说明全身热休克预处理能抑制体内外周血白细胞的活化. 正常情况下, 白细胞以及中性粒细胞会自动启动凋亡程序而发生凋亡. 这一过程不释放蛋白酶和炎症介质, 是机体炎症消散的主要途径. 目前已知, 创伤感染等情况下, 白细胞以及中性粒细胞凋亡障碍是导致SIRS或MODS的重要原因[24]. 激活的白细胞特别是中性粒细胞一方面通过释放趋化因子和上调炎性细胞因子的表达, 参与介导SIRS和MODS的发生发展; 另一方面通过释放氧自由基和蛋白酶等物质, 直接损伤血管内皮细胞和脏器实质细胞. 导致活性氧类介质产生的氧化酶机制被认为是中性粒细胞引起组织损伤的主要因素[25]. 本实验结果提示, 全身热休克预处理对肠IRI的保护作用可能通过抑制外周血白细胞的激活, 从而减少氧自由基、细胞因子释放, 抑制炎症反应, 或通过某种途径抑制肠黏膜细胞凋亡保护肠黏膜.
总之, 全身热休克预处理能抑制大鼠体内外周血白细胞的活化, 抑制肠黏膜caspase-3的活性, 显示对肠IRI有保护作用. 这种保护效应可能与增加热休克诱导HSP72的表达和抑制外周血白细胞的激活有关. 全身热休克预处理及肠IRI过程中, HSP72的增高与肠黏膜上皮细胞凋亡和caspase-3活性之间的关系, 还有待进一步研究.
衷心感谢中南大学湘雅医学院病生教研室肖献忠教授和王慷慨副教授在实验条件、实验技术上给予的支持和帮助.
肠缺血-再灌注损伤(IRI)是临床常见的病理生理过程. 肠IRI不仅会引起肠组织的局部损伤, 还会诱发SIRS和MODS. 白细胞激活是肠IRI过程中引起急性炎症反应的基础. 研究表明热休克预处理对包括小肠在内的器官缺血-再灌注损伤有保护作用, 但机制尚未阐明.
肠道是对缺血-再灌注损伤最为敏感的器官, 肠缺血-再灌注损伤是肠移植、严重创伤后常见的病理生理过程, 肠缺血-再灌注损伤的发生机制以及如何防止、减轻肠缺血-再灌注损伤一直是基础和临床研究的热点.
以往研究发现HSPs通过多种途径对肠IRI发挥效应. 小肠移植大鼠供体预先诱导HSP72的表达, 可减少肠黏膜细胞凋亡. 热应激诱导HSP70表达保护肠IRI黏膜结构和功能与其降低IRI对Ach作用的抑制有关.
本文发现全身热休克预处理对肠IRI的保护作用机制可能与其抑制外周血白细胞的凋亡障碍有关. 肠黏膜细胞在热诱导HSP72蛋白表达的基础上, 不仅能够耐受肠缺血-再灌注所致的损伤, 且缺血-再灌注作为一新的应激原可以增强热休克处理的作用, 诱导细胞表达更多的HSP72.
本研究提示, 全身热休克预处理对肠IRI的保护作用机制可能与增加热休克诱导HSP72的表达和抑制外周血白细胞激活有关, 为临床正确诱导HSPs以防治肠IRI提供新的治疗思路和策略.
热休克蛋白(HS- Ps): 高温环境可以诱发基因转录合成HSPs. 目前已发现HSPs有30余种, 按分子量大小将其分为HSP90, HSP70, HSP60及小分子量HSP等4个家族. HSP70是HSPs中最受关注的一种, HSP70家族主要包括结构型HSP70(HSP73)和诱导型HSP70(HSP72). 在非应激状态下, HSP73就有表达而HSP72几乎不表达.
本文实验设计合理, 选择的指标及检测方法科学, 有一定的创新性, 具有较强的学术价值.
编辑: 程剑侠 电编: 何基才
| 2. | Deitch EA, Xu D, Kaise VL. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review. Front Biosci. 2006;11:520-528. [PubMed] [DOI] |
| 3. | Cooper D, Russell J, Chitman KD, Williams MC, Wolf RE, Granger DN. Leukocyte dependence of platelet adhesion in postcapillary venules. Am J Physiol Heart Circ Physiol. 2004;286:H1895-H1900. [PubMed] [DOI] |
| 4. | Mbachu EM, Klein LV, Rubin BB, Lindsay TF. A monoclonal antibody against cytokine-induced neutrophil chemoattractant attenuates injury in the small intestine in a model of ruptured abdominal aortic aneurysm. J Vasc Surg. 2004;39:1104-1111. [PubMed] [DOI] |
| 5. | Sisley AC, Desai T, Harig JM, Gewertz BL. Neutrophil depletion attenuates human intestinal reperfusion injury. J Surg Res. 1994;57:192-196. [PubMed] [DOI] |
| 6. | Okada M, Hasebe N, Aizawa Y, Izawa K, Kawabe J, Kikuchi K. Thermal treatment attenuates neointimal thickening with enhanced expression of heat-shock protein 72 and suppression of oxidative stress. Circulation. 2004;109:1763-1768. [PubMed] [DOI] |
| 7. | Attuwaybi BO, Hassoun HT, Zou L, Kozar RA, Kone BC, Weisbrodt NW, Moore FA. Hypothermia protects against gut ischemia/reperfusion-induced impaired intestinal transit by inducing heme oxygenase-1. J Surg Res. 2003;115:48-55. [PubMed] [DOI] |
| 8. | Uchinami H, Yamamoto Y, Kume M, Yonezawa K, Ishikawa Y, Taura K, Nakajima A, Hata K, Yamaoka Y. Effect of heat shock preconditioning on NF-kappaB/I-kappaB pathway during I/R injury of the rat liver. Am J Physiol Gastrointest Liver Physiol. 2002;282:G962-G971. [PubMed] [DOI] |
| 9. | Hiratsuka M, Yano M, Mora BN, Nagahiro I, Cooper JD, Patterson GA. Heat shock pretreatment protects pulmonary isografts from subsequent ischemia-reperfusion injury. J Heart Lung Transplant. 1998;17:1238-1246. [PubMed] |
| 10. | Sugiura M, Kuwabara Y, Mitani M, Sato A, Shinoda N, Kimura M, Yano M, Mitsui A, Suzuki T, Fujii Y. Effect of whole body hyperthermia on ischemia and reperfusion injury of rat intestine: real-time ATP change studied using (31)P-MRS. Eur Surg Res. 2002;34:306-312. [PubMed] [DOI] |
| 11. | Sakamoto N, Kokura S, Okuda T, Hattori T, Katada K, Isozaki Y, Nakabe N, Handa O, Takagi T, Ishikawa T. Heme oxygenase-1 (Hsp32) is involved in the protection of small intestine by whole body mild hyperthermia from ischemia/reperfusion injury in rat. Int J Hyperthermia. 2005;21:603-614. [PubMed] [DOI] |
| 12. | Fleming SD, Starnes BW, Kiang JG, Stojadinovic A, Tsokos GC, Shea-Donohue T. Heat stress protection against mesenteric I/R-induced alterations in intestinal mucosa in rats. J Appl Physiol (1985). 2002;92:2600-2607. [PubMed] [DOI] |
| 13. | Stojadinovic A, Kiang J, Smallridge R, Galloway R, Shea-Donohue T. Induction of heat-shock protein 72 protects against ischemia/reperfusion in rat small intestine. Gastroenterology. 1995;109:505-515. [PubMed] [DOI] |
| 15. | Vyas D, Robertson CM, Stromberg PE, Martin JR, Dunne WM, Houchen CW, Barrett TA, Ayala A, Perl M, Buchman TG. Epithelial apoptosis in mechanistically distinct methods of injury in the murine small intestine. Histol Histopathol. 2007;22:623-630. [PubMed] |
| 16. | Putics A, Végh EM, Csermely P, Soti C. Resveratrol induces the heat-shock response and protects human cells from severe heat stress. Antioxid Redox Signal. 2008;10:65-75. [PubMed] [DOI] |
| 17. | Graner MW, Cumming RI, Bigner DD. The heat shock response and chaperones/heat shock proteins in brain tumors: surface expression, release, and possible immune consequences. J Neurosci. 2007;27:11214-11227. [PubMed] [DOI] |
| 18. | Otaka M, Okuyama A, Otani S, Jin M, Itoh S, Itoh H, Iwabuchi A, Sasahara H, Odashima M, Tashima Y. Differential induction of HSP60 and HSP72 by different stress situations in rats. Correlation with cerulein-induced pancreatitis. Dig Dis Sci. 1997;42:1473-1479. [PubMed] [DOI] |
| 19. | Gilby KL, Armstrong JN, Currie RW, Robertson HA. The effects of hypoxia-ischemia on expression of c-Fos, c-Jun and Hsp70 in the young rat hippocampus. Brain Res Mol Brain Res. 1997;48:87-96. [PubMed] [DOI] |
| 20. | Callahan TE, Marins J, Welch WJ, Horn JK. Heat shock attenuates oxidation and accelerates apoptosis in human neutrophils. J Surg Res. 1999;85:317-322. [PubMed] [DOI] |
| 21. | Arya R, Mallik M, Lakhotia SC. Heat shock genes - integrating cell survival and death. J Biosci. 2007;32:595-610. [PubMed] [DOI] |
| 22. | Zhao Y, Wang W, Qian L. Hsp70 may protect cardiomyocytes from stress-induced injury by inhibiting Fas-mediated apoptosis. Cell Stress Chaperones. 2007;12:83-95. [PubMed] [DOI] |
| 23. | Baba HA, Wohlschlaeger J, Stubbe HD, Grabellus F, Aken HV, Schmitz KJ, Otterbach F, Schmid KW, August C, Levkau B. Heat shock protein 72 and apoptosis indicate cardiac decompensation during early multiple organ failure in sheep. Intensive Care Med. 2004;30:1405-1413. [PubMed] [DOI] |
| 24. | 赵 钢, 江 伟, 王 学敏, 杭 燕南. 热应激反应对IL-6所致中性粒细胞凋亡障碍的影响. 上海第二医科大学学报. 2004;24:891-893. |