修回日期: 2007-10-23
接受日期: 2007-12-05
在线出版日期: 2007-12-18
目的: 检测胰腺癌细胞中5-脂氧合酶(5-lipoxygenase, 5-LOX)及其代谢产物的表达情况, 分析高表达5-LOX及LTB4对胰腺癌细胞生长凋亡的影响.
方法: 体外培养人胰腺癌细胞株ASPC-1, PANC-1和SW1990, 并构建5-LOX基因稳定转染细胞株. 用RT-PCR和Western blot检测细胞5-LOX mRNA和蛋白的表达, ELISA检测细胞培养上清中LTB4的含量, 采用流式细胞仪、Annexin V/PI双染法检测TNF-α诱导细胞的细胞凋亡.
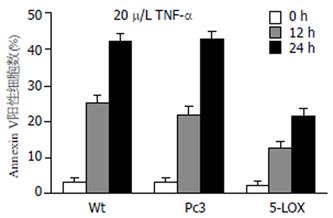
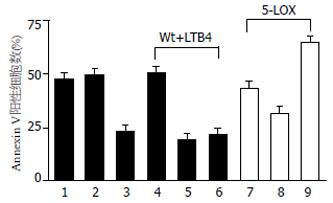
结果: 三种胰腺癌细胞株均表达5-LOX mRNA和蛋白, 细胞上清中也都检测到一定量LTB4分泌. 5-LOX基因稳定转染细胞株表达5-LOX和LTB4的水平上升. TNF-α(20 μg/L)处理野生型SW1990细胞, 12和24 h后凋亡率分别为25.4%±3.65%和43.5%±5.23%, 但该效应在高表达5-LOX的细胞株中明显减弱, 分别为13.2%±2.01%和21.7%±3.65%. 在野生型SW1990细胞培养中加入外源性LTB4(10 nmol/L)能抑制TNF-α诱导的细胞凋亡, 野生型与处理组细胞24 h后凋亡率有显著性差异(47.6%±5.32% vs 18.5%±5.69%, P<0.01). 用LTB4受体阻断剂处理5-LOX高表达细胞株, 能恢复其对凋亡诱导的敏感性.
结论: 胰腺癌细胞均能表达5-LOX并产生LTB4, 高表达5-LOX能抑制TNF-α诱导的胰腺癌细胞凋亡.
引文著录: 丁晓凌, 周国雄, 黄介飞. 5-脂氧合酶抑制TNF-α诱导的胰腺癌细胞凋亡. 世界华人消化杂志 2007; 15(35): 3685-3689
Revised: October 23, 2007
Accepted: December 5, 2007
Published online: December 18, 2007
AIM: To investigate the effects of 5-lipoxygenase and LTB4 on the proliferation and apoptosis of pancreatic cancer cells in vitro.
METHODS: The human pancreatic cancer cell lines ASPC-1, PANC-1 and SW1990 were cultured and the levels of 5-LOX and the supernatant product LTB4 were examined by Western blot and ELISA. TNF-α-induced cell apoptosis was analyzed by annexin V/PI double staining with flow cytometry. 5-LOX cDNA stably transfected SW1990 cell lines were established and treated with TNF-α. Their sensitivity to apoptosis induction was examined.
RESULTS: The pancreatic cell lines tested in this study all expressed substitute levels of 5-LOX and LTB4. The percentages of apoptotic wild-type SW1990 cells were 25.4% ± 3.65% and 43.5% ± 5.23% after 12 h and 24 h treatment with 20 μg/L TNF-α, respectively. However, these effects were significantly decreased (P < 0.01) in 5-LOX over-expressing cells. The percentages of these cells undergoing apoptosis were 13.2% ± 2.01% and 21.7% ± 3.65% after 12 h and 24 h treatment, respectively. Furthermore, the addition of exogenous LTB4 (10 nmol/L) significantly suppressed the percentage of wild-type cells undergoing apoptosis from 47.6% ± 5.32% to 18.5% ± 5.69%. Blocking LTB4 signals with specific receptor antagonists reversed the sensitivity of 5-LOX transfected cells to apoptosis.
CONCLUSION: High levels of expression of 5-LOX and LTB4 make pancreatic cell lines more resistant to TNF-α-induced apoptosis, suggesting that the 5-LOX pathway plays an important role in the pathogenesis of pancreatic cancer.
- Citation: Ding XL, Zhou GX, Huang JF. 5-lipoxygenase suppresses TNF-α-induced apoptosis in pancreatic tumor cell lines. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3685-3689
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3685.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3685
胰腺癌是常见的恶性肿瘤之一, 5年生存率小于2%[1-2]. 受胰腺解剖学和胰腺癌生物学特征等因素的影响, 胰腺癌容易侵犯周围组织器官并发生远处转移, 加之缺乏特异的临床表现和简便可靠的诊断方法, 早期诊断十分困难, 确诊时多已属晚期, 丧失了根治性手术的机会[3-4]. 因此, 深入探讨发病机制, 寻找新的诊治手段是当前胰腺癌研究的热点[5-11]. 流行病学资料和动物研究表明, 高脂饮食, 特别是花生四稀酸(arachidonic acid, AA)和亚油酸等多不饱和脂肪酸的摄入增加与胰腺癌关系密切[12-13]. 5-脂氧合酶(5-lipoxygenase, 5-LOX)是催化AA转化为白三烯(leukotriene, LT)和5-羟基二十碳四烯酸(5-HETE)的关键酶[14]. 近年来有文献报道, 在胰腺癌组织中5-LOX基因表达上调[15-16]. 我们实验室前期的研究也在胰腺癌细胞株SW1990中检测到5-LOX mRNA和蛋白的表达[17]. 然而到目前为止, 5-LOX高表达究竟对胰腺癌细胞的生长有什么影响还不十分清楚. 我们发现, 多种胰腺癌细胞普遍能表达5-LOX蛋白, 而且无论是细胞内过表达5-LOX还是其代谢产物LTB4, 均能抑制胰腺癌细胞的凋亡. 该结果不仅初步揭示了5-LOX在胰腺癌病理形成中的作用, 而且提示, 抑制5-LOX代谢通路可能成为一个治疗胰腺癌的有效途径.
人胰腺癌细胞株SW1990细胞由上海交通大学附属第一人民医院消化内科王兴鹏教授惠赠, 人胰腺癌细胞株ASPC-1购自上海中科院细胞库, 人胰腺癌细胞株PANC-1由上海市免疫学研究所周芸惠赠. 细胞在含100 mL/L胎牛血清的DMED培养液常规培养. 部分实验在细胞培养过程中加入不同浓度的LTB4(Cayman), 或加入选择性的LTB4受体1、2阻断剂U75302(1 μmol/L, Cayman)或/和LY255283(1 μmol/L, Cayman).
细胞培养对数期加入TNF-α(20 μg/L, R&D)作用细胞12, 24 h, 收集细胞. 凋亡检测采用BD公司提供的ApoAlert Annexin-V kit. 2×105细胞用PBS洗1遍, 加入结合溶液200 μL悬浮细胞, 再加Annexin V 5 μL和PI 5 μL置于室温避光15 min, 上流式细胞仪检测, Annexin V阳性代表凋亡细胞. TRIzol提取总RNA, 逆转录定量PCR试剂盒购自TaKaRa公司, 按说明书操作. PCR扩增5-LOX采用的上游引物: 5'-TCATCGTGGACTTTGAGCTG-3', 下游引物: 5'-AGAAGGTGGGTGATGGTCTG-3'. 从SW1990细胞克隆5-LOX cDNA, 合成上游引物: 5'-CGCCATGCCCTCCTACACGGTCAC-3'和下游引物: 5'- CTGCTCGAGTGCTCAGATGGCCACACTGTT- 3'. 下游引物含XhoⅠ内切酶识别位点. PCR条件: 94℃ 4 min, 94℃ 1 min, 58℃ 1 min, 72℃ 4 min, 28个循环后72℃ 10 min中止. 将5-LOX基因克隆到pGEMT-easy(Promega)载体中, 测序确认, 用EcoR和XhoⅠ双酶切, 将5-LOX cDNA插入表达质粒pcDNA3.1中(pcDNA3.1/5-LOX), 细胞转染用FuGENE 6转染试剂(Roche), 同时设pcDNA3.1空质粒转染组. 用1 g/L G418(Calbiochem)筛选稳定转染的细胞株, 并以0.5 g/L G418维持培养. ELISA检测LTB4含量, 试剂盒购自R&D公司, 按说明书操作. 提取总蛋白, 100 g/L聚丙烯酰胺凝胶, 含50 g/L脱脂奶粉TBS封闭, 1:1000加入抗5-LOX一抗(Cayman), 4℃过夜, 1:5000加入HRP标记二抗, 作用2 h, 曝光洗片.
统计学处理 采用STATA 7.0统计软件分析, 两组计量资料用t检验. 多组计量资料用单因素方差分析. P<0.05为显著性判断水准.
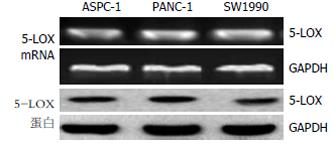
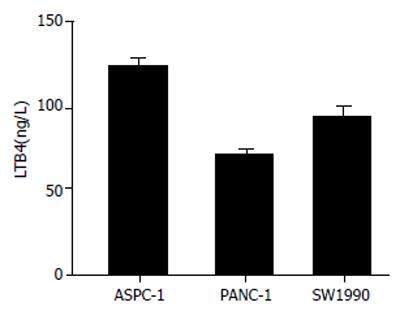
我们在ASPC-1, PANC-1和SW1990三种胰腺癌细胞株中均检测到5-LOX mRNA和蛋白的表达(图1). 5-LOX在3种细胞中表达水平无显著差异. 此外, LTB4是5-LOX代谢途径的主要产物. 我们收集对数生长期细胞上清, ELISA检测到3种细胞都能分泌一定量的LTB4(图2).
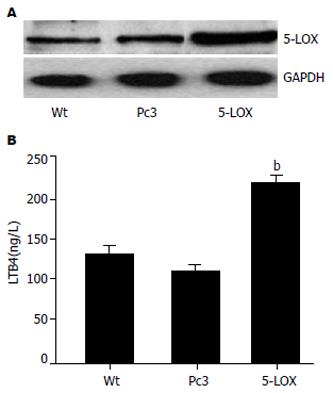
选择SW1990细胞株, 通过筛选得到稳定转染5-LOX表达质粒的细胞株(SW1990/5-LOX). Western blot结果显示, 在稳定转染的细胞株中, 5-LOX表达量是野生型SW1990的4倍左右(图3A). ELISA分析结果显示, 与野生型SW1990细胞相比, SW1990/5-LOX分泌更高水平的LTB4(图3B).
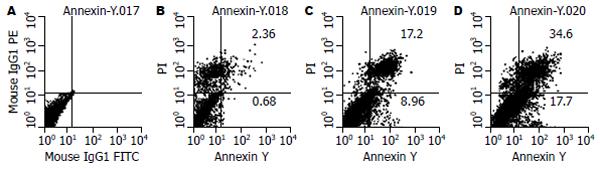
20 μg/L TNF-α作用12和24 h, 能诱导一定数量的野生型SW1990细胞发生凋亡(图4). 然而, 高表达5-LOX的胰腺癌细胞在TNF-α处理后, Annexin V阳性细胞的百分比(凋亡率)明显减少, 24 h差异更明显. 与野生型细胞(Wt)相比, P<0.01(图5), 提示SW1990/5-LOX抵抗TNF-α诱导的凋亡能力增强.
在野生型SW1990细胞培养体系中加入不同浓度的LTB4, 结果发现, 10 nmol/L LTB4就可以使细胞对TNF-α的杀伤产生明显的抵抗作用(P<0.01, 图6, Wt+LTB4). 在诱导细胞凋亡前用选择性的LTB4受体1、2阻断剂U75302或/和LY255283对SW1990/5-LOX细胞预处理30 min, 发现能增强细胞对TNF-α的敏感性(图6, P<0.05). 其中单独处理时, 发挥主要作用的是U75302, 凋亡率恢复到接近野生型细胞的水平. 联合使用U75302和LY255283获得更强的效果, 凋亡率甚至超过野生型细胞的水平(P<0.05), 说明, 高水平的LTB4与SW1990/5-LOX细胞凋亡抵抗有直接的关系.
近年来大量资料表明, AA代谢产物与肿瘤的病理形成与发展密切相关[18-21]. 在胰腺癌及其癌早期病变中均能检测到5-LOX表达上调[15]. 人胰腺癌组织免疫组化研究也证实, 5-LOX表达上调, 但在正常胰导管细胞中不表达5-LOX, 胰导管细胞分化越好, 5-LOX蛋白的表达越强. 此外, 5-LOX下游主要产物LTB4也在胰腺癌组织, 而不是正常导管细胞中有高水平表达[16]. 我们分析多种胰腺癌细胞系, 证实这些细胞均能表达5-LOX mRNA, 蛋白以及5-LOX主要下游代谢产物LTB4. 我们还发现, 5-LOX高表达能明显抑制TNF-α诱导的胰腺癌细胞凋亡, 而且这种对凋亡的抵抗性可能与细胞分泌LTB4水平增加有关. 体内TNF-α多由杀伤性T细胞分泌, 是机体抗肿瘤免疫的重要因子[22], 由此我们推测, 高表达5-LOX对胰腺癌可能的作用之一是能降低机体免疫系统对肿瘤的攻击效率, 从而促进肿瘤的生长. 此外, 临床上胰腺癌患者常常表现为对多种化疗药物不敏感[23]. 许多化疗药物是通过诱导肿瘤细胞凋亡来发挥作用的. 那么是否除了TNF-α以外, 高表达5-LOX还能抑制其他因子, 包括常用的化疗药物诱导的细胞凋亡还有待进一步体内外实验来证实.
在胰腺癌中, 过度激活的LOX代谢通路使其成为令人注目的潜在治疗靶点[24]. 我们曾报道, 5-LOX特异性抑制剂齐留通可显著抑制胰腺癌细胞增殖[25], 进一步说明, 5-LOX在胰腺癌病理机制中可能具有关键地位. 齐留通主要通过抑制5-LOX活性而阻断AA转化过程, 包括LTB4的产生. 我们研究发现, 如果在野生型胰腺癌细胞培养过程中加入外源性LTB4, 能明显抑制TNF-α诱导的细胞凋亡. 其次, 高表达5-LOX的胰腺癌细胞(SW1990/5-LOX)在经过LTB4受体阻断剂作用后, 对凋亡诱导的敏感性恢复到接近正常细胞水平. 最后, 我们观察到, 高表达5-LOX的胰腺癌细胞(SW1990/5-LOX)分泌LTB4也增加. 总的看来, 虽然LTB4如何在体内外影响胰腺癌细胞凋亡的分子机制尚不清楚, 但这些结果充分提示我们, LTB4可能是5-LOX发挥抗凋亡作用的直接因素, 而抑制LTB4介导的信号可能具有抗胰腺癌的治疗作用.
抑制LTB4的手段之一是应用特异性或非特异性5-LOX抑制剂, 包括齐留通. 他们能通过抑制5-LOX的酶活性来减少LTB4产生. 目前具有代表性的5-LOX抑制剂大约有20余个, 有些已用于哮喘的临床研究, 未发现明显的不良反应[26]. 第二种方法是直接阻断LTB4信号传导. 我们采用LTB4受体阻断剂有效增强了高表达5-LOX的胰腺癌细胞对凋亡诱导的敏感性. 他们以及其类似物是否能在体外和体内发挥抗胰腺癌的作用有待深入研究[27-28]. 最后, 直接抑制胰腺癌细胞5-LOX基因表达水平也将是一种有效的策略, 但关于细胞5-LOX基因表达调节方面的研究较少[29-30]. 我们曾报道, 中药成分雷公藤内酯醇可以抑制胰腺癌细胞增殖, 诱导细胞凋亡, 其抗肿瘤活性与抑制细胞5-LOX基因表达和LTB4生成有关[31]. 总之, 检验单独或协同使用这些手段对肿瘤细胞5-LOX代谢通路和生长、凋亡的影响, 可能为胰腺癌的临床治疗提供更多的证据.
有研究表明, 花生四烯酸(AA)代谢产物与肿瘤的病理形成和发展密切相关. 在胰腺癌的研究中观察到LOX代谢途径异常. 5-脂氧合酶(5-LOX)是催化AA转化成5-羟二十碳四烯酸(5-HETE)和白三烯(LTs)的关键酶.
胰腺癌预后差, 早期诊断困难, 传统治疗效果不理想. 深入研究胰腺癌的发病机制对探索更有效的预防和治疗方法具有重要意义. 近年来, 5-LOX代谢途径与胰腺癌的关系受到关注.
据报道, 在胰腺癌中检测到5-LOX mRNA 和蛋白表达上调, 5-LOX下游主要产物LTB4也在胰腺癌中有高水平表达, 进一步提示5-LOX在胰腺癌病理机制中可能具有关键地位.
目前国内外关于5-LOX在胰腺癌中异常表达的报道较多, 而关于5-LOX代谢通路对肿瘤细胞的增殖或凋亡的影响还不十分清楚. 本文通过高表达5-LOX的胰腺癌细胞株, 体外研究5-LOX及主要代谢产物LTB4对TNF-α诱导的细胞凋亡的影响.
LOXs: 一组具有加氧酶和过氧化氢酶双重活性的同功酶, 根据其作用底物位置特异性分别命名为5-, 8-, 12-, 15-LOX. AA经过这四个酶的催化形成5-, 8-, 12-, 15-羟基花生四烯酸, 并进一步转化成LTs.
本文设计合理, 实验方法先进, 技术路线可行, 内容丰富, 具有一定的参考价值.
编辑: 何燕 电编: 郭海丽
| 1. | Jemal A, Murray T, Samuels A, Ghafoor A, Ward E, Thun MJ. Cancer statistics, 2003. CA Cancer J Clin. 2003;53:5-26. [PubMed] [DOI] |
| 2. | Howard TJ. Pancreatic adenocarcinoma. Curr Probl Cancer. 1996;20:281-328. [PubMed] [DOI] |
| 4. | Mangray S, King TC. Molecular pathobiology of pancreatic adenocarcinoma. Front Biosci. 1998;3:D1148-D1160. [PubMed] [DOI] |
| 5. | Van Cutsem E, Aerts R, Haustermans K, Topal B, Van Steenbergen W, Verslype C. Systemic treatment of pancreatic cancer. Eur J Gastroenterol Hepatol. 2004;16:265-274. [PubMed] [DOI] |
| 6. | Ducreux M, Boige V, Malka D. Emerging drugs in pancreatic cancer. Expert Opin Emerg Drugs. 2004;9:73-89. [PubMed] [DOI] |
| 7. | Ducreux M, Boige V, Malka D. Treatment of advanced pancreatic cancer. Semin Oncol. 2007;34:S25-S30. [PubMed] [DOI] |
| 8. | Welsch T, Kleeff J, Friess H. Molecular pathogenesis of pancreatic cancer: advances and challenges. Curr Mol Med. 2007;7:504-521. [PubMed] [DOI] |
| 9. | Canto MI. Strategies for screening for pancreatic adenocarcinoma in high-risk patients. Semin Oncol. 2007;34:295-302. [PubMed] [DOI] |
| 10. | Farrell JJ, van Rijnsoever M, Elsaleh H. Early detection markers in Pancreas Cancer. Cancer Biomark. 2005;1:157-175. [PubMed] |
| 11. | Goggins M. Identifying molecular markers for the early detection of pancreatic neoplasia. Semin Oncol. 2007;34:303-310. [PubMed] [DOI] |
| 12. | Heukamp I, Kilian M, Gregor JI, Kiewert C, Schimke I, Kristiansen G, Walz MK, Jacobi CA, Wenger FA. Impact of polyunsaturated fatty acids on hepato-pancreatic prostaglandin and leukotriene concentration in ductal pancreatic cancer -- is there a correlation to tumour growth and liver metastasis? Prostaglandins Leukot Essent Fatty Acids. 2006;74:223-233. [PubMed] [DOI] |
| 14. | Dixon RA, Diehl RE, Opas E, Rands E, Vickers PJ, Evans JF, Gillard JW, Miller DK. Requirement of a 5-lipoxygenase-activating protein for leukotriene synthesis. Nature. 1990;343:282-284. [PubMed] [DOI] |
| 15. | Hennig R, Ding XZ, Tong WG, Schneider MB, Standop J, Friess H, Büchler MW, Pour PM, Adrian TE. 5-Lipoxygenase and leukotriene B(4) receptor are expressed in human pancreatic cancers but not in pancreatic ducts in normal tissue. Am J Pathol. 2002;161:421-428. [PubMed] [DOI] |
| 16. | Ding XZ, Iversen P, Cluck MW, Knezetic JA, Adrian TE. Lipoxygenase inhibitors abolish proliferation of human pancreatic cancer cells. Biochem Biophys Res Commun. 1999;261:218-223. [PubMed] [DOI] |
| 20. | Gupta S, Srivastava M, Ahmad N, Sakamoto K, Bostwick DG, Mukhtar H. Lipoxygenase-5 is overexpressed in prostate adenocarcinoma. Cancer. 2001;91:737-743. [PubMed] [DOI] |
| 21. | Chen X, Wang S, Wu N, Sood S, Wang P, Jin Z, Beer DG, Giordano TJ, Lin Y, Shih WC. Overexpression of 5-lipoxygenase in rat and human esophageal adenocarcinoma and inhibitory effects of zileuton and celecoxib on carcinogenesis. Clin Cancer Res. 2004;10:6703-6709. [PubMed] [DOI] |
| 22. | van Horssen R, Ten Hagen TL, Eggermont AM. TNF-alpha in cancer treatment: molecular insights, antitumor effects, and clinical utility. Oncologist. 2006;11:397-408. [PubMed] [DOI] |
| 23. | Boeck S, Hinke A, Wilkowski R, Heinemann V. Importance of performance status for treatment outcome in advanced pancreatic cancer. World J Gastroenterol. 2007;13:224-227. [PubMed] [DOI] |
| 24. | Hennig R, Grippo P, Ding XZ, Rao SM, Buchler MW, Friess H, Talamonti MS, Bell RH, Adrian TE. 5-Lipoxygenase, a marker for early pancreatic intraepithelial neoplastic lesions. Cancer Res. 2005;65:6011-6016. [PubMed] [DOI] |
| 26. | Chen X, Sood S, Yang CS, Li N, Sun Z. Five-lipoxygenase pathway of arachidonic acid metabolism in carcino-genesis and cancer chemoprevention. Curr Cancer Drug Targets. 2006;6:613-622. [PubMed] [DOI] |
| 27. | Ihara A, Wada K, Yoneda M, Fujisawa N, Takahashi H, Nakajima A. Blockade of leukotriene B4 signaling pathway induces apoptosis and suppresses cell proliferation in colon cancer. J Pharmacol Sci. 2007;103:24-32. [PubMed] [DOI] |
| 28. | Hennig R, Ventura J, Segersvard R, Ward E, Ding XZ, Rao SM, Jovanovic BD, Iwamura T, Talamonti MS, Bell RH. LY293111 improves efficacy of gemcitabine therapy on pancreatic cancer in a fluorescent orthotopic model in athymic mice. Neoplasia. 2005;7:417-425. [PubMed] [DOI] |
| 29. | Brungs M, Rådmark O, Samuelsson B, Steinhilber D. On the induction of 5-lipoxygenase expression and activity in HL-60 cells: effects of vitamin D3, retinoic acid, DMSO and TGF beta. Biochem Biophys Res Commun. 1994;205:1572-1580. [PubMed] [DOI] |
| 30. | Brungs M, Rådmark O, Samuelsson B, Steinhilber D. Sequential induction of 5-lipoxygenase gene expression and activity in Mono Mac 6 cells by transforming growth factor beta and 1,25-dihydroxyvitamin D3. Proc Natl Acad Sci U S A. 1995;92:107-111. [PubMed] [DOI] |
| 31. | Zhou GX, Ding XL, Huang JF, Zhang H, Wu SB. Suppression of 5-lipoxygenase gene is involved in triptolide-induced apoptosis in pancreatic tumor cell lines. Biochim Biophys Acta. 2007;1770:1021-1027. [PubMed] [DOI] |