修回日期: 2007-10-24
接受日期: 2007-10-28
在线出版日期: 2007-12-08
目的: 探讨MIC-1作为新的肿瘤标志物在胰腺癌临床血清学诊断中的应用价值.
方法: 采用酶联免疫方法检测101例胰腺癌、10例胰腺良性病变患者及50例正常人血清中的MIC-1表达水平, 并与肿瘤标记物CA199进行比较.
结果: 胰腺癌患者血清中MIC-1表达水平(1427±1056 ng/L)显著高于胰腺良性肿瘤(362±177 ng/L)和正常人血清水平(299±159 ng/L)(P<0.001). MIC-1检测胰腺癌的敏感性、特异性、阳性预测值、阴性预测值和AUC分别为81.2%、94%、96.5%、71.2%和0.92, 分别高于CA199的相应对应值72.4%、89.6%、93.4%、61.4%和0.86. 与CA199联合检测时, 敏感性可提高至91.1%.
结论: MIC-1有可能成为用于胰腺癌临床诊断的新肿瘤标记物.
引文著录: 邵长君, 王小兵, 汪毅, 李茉, 田海梅, 单毅, 赵平, 张伟. 血清巨噬细胞抑制因子-1在胰腺癌临床检测诊断中的应用价值. 世界华人消化杂志 2007; 15(34): 3644-3648
Revised: October 24, 2007
Accepted: October 28, 2007
Published online: December 8, 2007
AIM: To evaluate the value of serum macrophage inhibitory cytokine-1 (MIC-1) as a novel marker for diagnosing pancreatic cancer.
METHODS: Serum MIC-1 levels were measured by sandwich ELISA assay in 101 patients with pancreatic adenocarcinomas, 10 patients with benign pancreatic tumors, and 50 healthy control subjects. The diagnostic performance of serum MIC-1 as a marker of pancreatic cancer was compared with that of serum CA199.
RESULTS: MIC-1 levels were significantly higher in patients with pancreatic adenocarcinoma than in those with benign pancreatic neoplasms or in healthy controls (1427 ± 1056 ng/L vs 362 ± 177 ng/L, 299 ± 159 ng/L). The diagnostic accuracy of MIC-1 (sensitivity 81.2%, specificity 94%, positive predictive value 96.5%, negative predictive value 71.2%; AUC 0.92) at detecting pancreatic adenocarcinomas was higher than that of CA199 (sensitivity, 72.4% specificity 89.6%, positive predictive value 93.4%, negative predictive value 61.4%; AUC 0.86), and the combination of MIC-1 and CA199 significantly improved diagnostic sensitivity (91.1%).
CONCLUSION: MIC-1 can become a novel tumor marker and aid in the diagnosis of pancreatic adenocarcinoma.
- Citation: Shao CJ, Wang XB, Wang Y, Li M, Tian HM, Shan Y, Zhao P, Zhang W. Value of macrophage inhibitory cytokine-1 as a novel marker for detecting and diagnosing pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3644-3648
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3644.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3644
胰腺癌是一种高度恶性肿瘤, 具有发病隐匿、恶性度高、预后差、生存率低等特点, 其发病率呈上升趋势, 死亡率与发病率之比接近于1. 由于胰腺癌早期缺乏特异的临床表现, 80%以上的胰腺癌患者在确诊时已有局部扩散和远处转移而不能进行手术治疗, 中位生存期只有3-6 mo, 5年生存率小于5%. 早期胰腺癌手术治疗是目前唯一提高胰腺癌疗效的有效方法, 术后5年生存率可提高到19%-41%. 因此胰腺癌的早期诊断对其手术治疗及预后至关重要[1-2]. 目前广泛使用的胰腺癌标志物CA199的敏感性只有70%左右, 对早期胰腺癌的检出价值较低. 因此临床急需开发新的肿瘤标记物以提高早期胰腺癌的诊断率. 巨噬细胞抑制因子-1(MIC-1)是近期发现的肿瘤标志物[3-4], 作为TGF-β家族的成员, 广泛参与细胞凋亡、侵袭及转移等生物学过程. 正常人血清中的MIC-1是经剪切成熟的含有TGF-β家族保守的7-半胱氨酸结构域同源二聚体蛋白(约为25 kDa), 呈低水平稳定的表达. Koopmann et al[5]发现, 在胰腺癌患者血清中MIC-1的表达水平显著升高, 具有用于临床诊断胰腺癌的价值.
本文通过检测胰腺癌、良性胰腺肿瘤患者和正常人血清中MIC-1表达水平, 进一步探讨MIC-1作为胰腺癌临床诊断新标志物的可行性.
收集中国医学科学院肿瘤医院2003-12/2006-12期间经细胞或病理学诊断的胰腺癌患者术前血清样本101例, 男68例, 女33例, 平均年龄为58.77岁. 按UICC 2002年胰腺癌TNM分期标准分为Ⅰ期4例, Ⅱ期8例, Ⅲ期52例, Ⅳ期37例; 按肿瘤位置分为胰头49例, 胰尾37例, 胰体部13例, 全胰2例. 另外还收集良性胰腺实性假乳头状瘤10例, 正常人50例(男26例, 女24例, 平均年龄为40.89岁). 采集正常人及患者术前静脉血, 所有血清样本均无溶血、脂血, 收集血清后立即置于-70℃冰箱中保存. MIC-1检测试剂盒为美国R&D公司生产(Lot4301), 高吸附酶标板为Biomat公司生产, TMB显色剂(LotFL001)及浓缩洗涤剂(LotFL017)为晶美公司生产, 伯乐450酶免疫分析仪为美国伯乐公司生产, 水浴箱为天津泰斯特仪器有限公司生产, CA199试剂盒为美国Roche生产.
CA199测定按照试剂盒说明书进行. MIC-1浓度测定采用生物素-亲和素放大系统的ELISA双抗体夹心两步法, 每个样品均设有平行孔. 实验步骤如下: (1)标准品的制备: 以10 g/L BSA-VI(20 mmol/L、pH7.4 PBS)为稀释液将标准抗原从浓度500 ng/L开始倍比稀释7次. (2)包被: 50 mmol/L、pH9.6的碳酸盐缓冲液将包被抗体稀释至2 mg/L, 然后以100 μL/孔加入96孔微孔板中, 4℃过夜, 弃包被液并洗涤2次, 以300 μL/孔加入封闭液(10 g/L BSA-VI、20 mmol/L PBS), 室温2 h, 弃封闭液并洗涤2次后备用. (3)加样: 将血清按1:10稀释, 按100 μL/每孔加入孔中, 室温2 h. 洗涤3次后每孔加入100 μL生物素化兔多抗(50 μg/L), 室温2 h, 洗涤3次, 再以50 μL/孔加入亲和素化辣根过氧化物酶, 室温40 min, 洗涤4次. (4)显色: 每孔分别滴加入A液和B液各50 μL, 室温20 min, 加入1 mol/L H2SO4 50 μL终止反应, 测A450值. (5)参考值和阳性判断值: CA199参考值为0-37 kU/L, CA199>37 kU/L判断为阳性. 以MIC-1浓度(ng/L)为横坐标, A值为纵坐标, Log-Log拟合曲线, MIC-1的cutoff值设定为正常人浓度值的mean±2SD. 大于cutoff值判断为阳性.
统计学处理 数据以mean±SD表示, 应用SPSS12.0统计软件, 进行t检验、方差分析及相关性分析等统计分析.
胰腺癌患者101例和正常对照组血清MIC-1浓度分别为1427±1056 ng/L、299±159 ng/L, 两者差异显著(P<0.001). 胰腺良性肿瘤病变患者10例血清MIC-1浓度为362±177 ng/L, 与胰腺癌相比差异性显著(P<0.001). 此外, 分析胰腺癌临床各期患者血清MIC-1表达水平, 结果显示与正常组相比均具有显著性差异, 而各期之间无明显差异(表1).
| 分组 | MIC-1(ng/L) | CA199 (kU/L) | ||||
| n | P值 | n | P值 | |||
| 正常 | 50 | 299±159 | 48 | 10.0±13.8 | ||
| 胰腺癌 | 101 | 1427±1056 | 0.000 | 98 | 1621.0±4570.1 | 0.016 |
| Ⅰ+Ⅱ期 | 12 | 1107±1139 | 0.005 | 12 | 276.3±324.2 | 0.000 |
| Ⅲ期 | 52 | 1366±986 | 0.000 | 49 | 987.3±3243.4 | 0.002 |
| Ⅳ期 | 37 | 1057±1021 | 0.000 | 37 | 3037.2±6412.7 | 0.040 |
| 胰腺假乳头状瘤 | 10 | 362±177 | 0.001 | 10 | 168.6±478.9 | 0.021 |
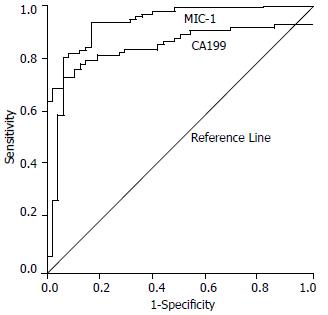
MIC-1的阈值为617 ng/L, MIC-1检测胰腺癌的敏感性、特异性、阳性预测值、阴性预测值依次为81.2%、94%、96.5%和71.2%, 高于CA199的72.4%、89.6%、93.4%和61.4%(表2). ROC曲线分析MIC-1、CA199的曲线下面积(AUC)分别为0.92和0.86(图1). MIC-1与CA199联合检测胰腺癌的敏感性可以提高至91.1%. 在区分胰腺良性与恶性肿瘤方面, MIC-1的鉴别能力优于CA199. 10例胰腺实性假乳头状瘤患者只有1例MIC-1检测呈弱阳性, 与正常对照组无明显差异(P = 0.891), 而CA199呈阴性例数为7例.
| MIC-1 | CA199 | MIC-1+CA199 | |
| 敏感性 | 81.2%(82/101) | 72.4%(71/98) | 91.1%(92/101) |
| 特异性 | 94%(47/50) | 89.6%(43/48) | 88%(44/50) |
| 阳性预测率 | 96.5%(82/85) | 93.4%(71/76) | 93.9%(92/98) |
| 阴性预测率 | 71.2%(47/66) | 61.4%(43/70) | 83.0%(44/53) |
胰腺癌患者血清中的MIC-1表达水平与肿瘤大小、分期、转移等因素无相关性. 在肿瘤体积小于2 cm的4例胰腺癌早期患者中, 2例患者血清MIC-1含量大于1400 ng/L, 呈现强阳性. 在12例Ⅰ-Ⅱ期胰腺癌患者中, 有5例患者血清MIC-1含量大于617 ng/L, 11例患者血清MIC-1表达水平高于正常组平均值, 差异显著(P = 0.005).
MIC-1是bootcov于1997年从人髓系白血病细胞系U937中的cDNA文库中分离出来的新基因[6], 又称为GDF-15、NAG-1、PDF、PLAB、PTGFB. 辐射、缺氧、多种抗癌药物如维甲酸(RA)、非甾类抗炎药物(NASID)以及细胞因子TNF-α、IL-1α、IL-6都能够增加MIC-1的表达. MIC-1是其前肽经furin样蛋白酶剪切后形成的同源二聚体, 作为分泌型细胞因子分泌到细胞外[7]. 在生理状态下, MIC-1高表达于胎盘组织和中枢神经系统上皮组织, 如脉络丛、室管膜, 在前列腺、结肠、肾、脑、肝、胰腺等组织中呈低表达. 然而在病理状态下如肿瘤、急性损伤及炎症, MIC-1表达水平可显著升高[8]. MIC-1具有促进细胞凋亡[9-10]、抑制上皮细胞生长、降低细胞黏附[11]及增强肿瘤细胞的侵袭与转移[12-13]等生物学功能, 在调节肿瘤细胞与生长环境相互作用中发挥重要功能.
Koopmann et al[14]率先报道了血清中MIC-1表达水平对诊断胰腺癌的价值, 结果表明胰腺癌患者血清中MIC-1表达水平显著高于正常人, 检测的敏感性、特异性分别为90%和94%[14]. 本研究表明, MIC-1在胰腺癌患者血清中的表达水平显著高于正常人, 诊断胰腺癌的敏感性、特异性、阳性预测值、阴性预测值、AUC依次为81.2%、94%、96.5%、71.2%和0.92, 高于CA199的72.4%、89.6%、93.4%、61.4%和0.86, 其中敏感性略低于Koopmann et al的报道. 值得关注的是, MIC-1与CA199联合检测胰腺癌敏感性可提高至91.1%, 说明两者具有很好的联合诊断胰腺癌的价值. MIC-1可以有效的区分胰腺良性肿瘤与恶性肿瘤(P<0.001). 10例胰腺实性假乳头瘤中只有1例检出呈现弱阳性. 在早期胰腺癌诊断方面, 4例肿瘤最大径小于2 cm的早期胰腺癌患者, MIC-1和CA199的检出率同为50%, 与Koopmann et al[14]报道的检出率(6/8)相一致. 在12例Ⅰ期和Ⅱ期患者血清中MIC-1显著高于正常组(P = 0.005), 提示连续测定高危人群血清MIC-1, 有可能预警和发现早期癌变, 在评估胰腺癌的早期发病风险方面具有价值. 本文也表明, 血清MIC-1表达水平与胰腺癌TNM分期、转移、肿瘤大小无相关性. 除胰腺癌外, MIC-1在其他一些肿瘤患者血清中如前列腺癌和结肠癌表达水平也显著升高, 但检测敏感性较胰腺癌低[3-4].
目前研究表明, MIC-1在肿瘤发展进程中具有抑制与促进的双重作用. 一方面高表达的MIC-1具有抑制肿瘤生长的作用, 例如高表达的MIC-1能够抑制化学和遗传等因素诱发小鼠消化道肿瘤的发生[15]. 转染MIC-1基因可以使某些肿瘤细胞系丧失了体内致瘤能力[16]. 另一方面高表达的MIC-1也具有促进肿瘤侵袭、转移的作用, 例如转染MIC-1基因的胃癌细胞侵袭能力有明显增强[12]. MIC-1参与调控肿瘤发生的机制十分复杂. MIC-1受P53、NF-κB、EGR-1和AKT/GSK-3β等基因的调控, 也是PKC下游的靶基因[17]. MIC-1被P53诱导表达后, 能够抑制cyclin D1的表达, 介导细胞凋亡. 高表达的MIC-1能够通过ERK1/2通路上调uPA和uPA受体, 使肿瘤细胞黏附性降低、侵袭性增强[11-12]. 高表达的MIC-1还能够抑制巨噬细胞的活性, 降低炎性与免疫反应, 利于肿瘤细胞的生存. 因此, 可以推测MIC-1在肿瘤发生的早期中起正常机体抵抗肿瘤的抑瘤作用, 而在肿瘤进展晚期中起促进肿瘤侵袭和转移的作用.
本文表明, 在临床血清学诊断胰腺癌中, MIC-1敏感性高于CA199, 与CA199联合检测可以有效提高检出率, 并可以有效地鉴别胰腺癌和胰腺良性肿瘤. 此外, MIC-1能否用于早期胰腺癌临床检测及高危人群的筛查, 还需扩大样本进一步的研究.
胰腺癌一种发病隐匿的高度恶性肿瘤, 死亡率极高. 建立对早期胰腺癌的有效诊断方法是目前提高胰腺癌疗效的唯一有效的方法. 目前广泛使用的胰腺癌标志物CA199的敏感性只有70%左右, 对早期胰腺癌的检出价值较低. 因此临床急需新的肿瘤标记物以提高早期胰腺癌的诊断率. 随蛋白质组学的发展对找寻胰腺癌肿瘤标志物有了很大促进作用, 但有效的肿瘤标记物仍寥寥无几. 目前仅有MIC-1显示出了可以应用于临床以提高对胰腺癌诊断率的潜力. 虽然早在1997年MIC-1即被发现, 但只在近年来才作为肿瘤标记物进行研究.
Koopmann et al研究表明血清MIC-1对胰腺癌检测的敏感性、特异性分别为90%和94%, 在8例T1-T2的早期胰腺癌患者中有6例MIC-1表达水平升高, 而CA199升高的只有3例.
本文研究表明, 在临床血清学诊断胰腺癌中MIC-1敏感性高于CA199, 与CA199联合检测可以有效提高检出率, 进一步表明MIC-1有可能成为用于胰腺癌临床诊断的新肿瘤标记物.
本文设计合理, 数据可信, 有较好的临床应用价值.
编辑: 程剑侠 电编:何基才
| 1. | Michaud DS. Epidemiology of pancreatic cancer. Minerva Chir. 2004;59:99-111. [PubMed] |
| 3. | Brown DA, Ward RL, Buckhaults P, Liu T, Romans KE, Hawkins NJ, Bauskin AR, Kinzler KW, Vogelstein B, Breit SN. MIC-1 serum level and genotype: associations with progress and prognosis of colorectal carcinoma. Clin Cancer Res. 2003;9:2642-2650. [PubMed] |
| 4. | Brown DA, Stephan C, Ward RL, Law M, Hunter M, Bauskin AR, Amin J, Jung K, Diamandis EP, Hampton GM. Measurement of serum levels of macrophage inhibitory cytokine 1 combined with prostate-specific antigen improves prostate cancer diagnosis. Clin Cancer Res. 2006;12:89-96. [PubMed] |
| 5. | Koopmann J, Buckhaults P, Brown DA, Zahurak ML, Sato N, Fukushima N, Sokoll LJ, Chan DW, Yeo CJ, Hruban RH. Serum macrophage inhibitory cytokine 1 as a marker of pancreatic and other periampullary cancers. Clin Cancer Res. 2004;10:2386-2392. [PubMed] |
| 6. | Bootcov MR, Bauskin AR, Valenzuela SM, Moore AG, Bansal M, He XY, Zhang HP, Donnellan M, Mahler S, Pryor K. MIC-1, a novel macrophage inhibitory cytokine, is a divergent member of the TGF-beta superfamily. Proc Natl Acad Sci U S A. 1997;94:11514-11519. [PubMed] |
| 7. | Bauskin AR, Brown DA, Junankar S, Rasiah KK, Eggleton S, Hunter M, Liu T, Smith D, Kuffner T, Pankhurst GJ. The propeptide mediates formation of stromal stores of PROMIC-1: role in determining prostate cancer outcome. Cancer Res. 2005;65:2330-2336. [PubMed] |
| 8. | Bauskin AR, Brown DA, Kuffner T, Johnen H, Luo XW, Hunter M, Breit SN. Role of macrophage inhibitory cytokine-1 in tumorigenesis and diagnosis of cancer. Cancer Res. 2006;66:4983-4986. [PubMed] |
| 9. | Yang H, Filipovic Z, Brown D, Breit SN, Vassilev LT. Macrophage inhibitory cytokine-1: a novel biomarker for p53 pathway activation. Mol Cancer Ther. 2003;2:1023-1029. [PubMed] |
| 10. | Zimmers TA, Jin X, Hsiao EC, Perez EA, Pierce RH, Chavin KD, Koniaris LG. Growth differentiation factor-15: induction in liver injury through p53 and tumor necrosis factor-independent mechanisms. J Surg Res. 2006;130:45-51. [PubMed] |
| 11. | Liu T, Bauskin AR, Zaunders J, Brown DA, Pankhurst S, Russell PJ, Breit SN. Macrophage inhibitory cytokine 1 reduces cell adhesion and induces apoptosis in prostate cancer cells. Cancer Res. 2003;63:5034-5040. [PubMed] |
| 12. | Lee DH, Yang Y, Lee SJ, Kim KY, Koo TH, Shin SM, Song KS, Lee YH, Kim YJ, Lee JJ. Macrophage inhibitory cytokine-1 induces the invasiveness of gastric cancer cells by up-regulating the urokinase-type plasminogen activator system. Cancer Res. 2003;63:4648-4655. [PubMed] |
| 13. | Wollmann W, Goodman ML, Bhat-Nakshatri P, Kishimoto H, Goulet RJ Jr, Mehrotra S, Morimiya A, Badve S, Nakshatri H. The macrophage inhibitory cytokine integrates AKT/PKB and MAP kinase signaling pathways in breast cancer cells. Carcinogenesis. 2005;26:900-907. [PubMed] |
| 14. | Koopmann J, Rosenzweig CN, Zhang Z, Canto MI, Brown DA, Hunter M, Yeo C, Chan DW, Breit SN, Goggins M. Serum markers in patients with resectable pancreatic adenocarcinoma: macrophage inhibitory cytokine 1 versus CA19-9. Clin Cancer Res. 2006;12:442-446. [PubMed] |
| 15. | Baek SJ, Okazaki R, Lee SH, Martinez J, Kim JS, Yamaguchi K, Mishina Y, Martin DW, Shoieb A, McEntee MF. Nonsteroidal anti-inflammatory drug-activated gene-1 over expression in transgenic mice suppresses intestinal neoplasia. Gastroenterology. 2006;131:1553-1560. [PubMed] |
| 16. | Albertoni M, Shaw PH, Nozaki M, Godard S, Tenan M, Hamou MF, Fairlie DW, Breit SN, Paralkar VM, de Tribolet N. Anoxia induces macrophage inhibitory cytokine-1 (MIC-1) in glioblastoma cells independently of p53 and HIF-1. Oncogene. 2002;21:4212-4219. [PubMed] |
| 17. | Shim M, Eling TE. Protein kinase C-dependent regulation of NAG-1/placental bone morphogenic protein/MIC-1 expression in LNCaP prostate carcinoma cells. J Biol Chem. 2005;280:18636-18642. [PubMed] |