修回日期: 2007-10-29
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 研究MT在肝细胞癌(HCC)中的表达和定位及其与临床病理特征.
方法: 对400例外科切除的HCC及相应非癌肝组织标本构建组织芯片, 用EnVision Plus法进行MT, P53和Ki-67免疫组织化学染色.
结果: 与相应的非癌肝组织相比, HCC组织MT的表达显著下调, HBsAg阳性患者MT阳性率显著低于阴性者(P = 0.042), 肿瘤直径≤2 cm的MT阳性率显著高于肿瘤直径>2 cm者(P = 0.007). 随着组织学分级进程, MT表达呈降低趋势(P = 0.004), MT核内表达与低分化HCC密切相关. MT与P53及Ki-67的表达无统计学相关性.
结论: HCC中MT表达下调在肝癌的发生过程中有一定作用, 可能是肝细胞分化的一个标志物, HBsAg与MT表达下调有关, 以核染色为主的MT表达可能反映了低分化HCC的一种侵袭性行为.
引文著录: 张树辉, 徐爱民. 肝细胞癌中金属硫蛋白表达下调及其临床病理学意义. 世界华人消化杂志 2007; 15(32): 3413-3417
Revised: October 29, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To investigate the expression and loca-lization of metallothionein (MT) and their association with clinicopathological characteristics in hepatocellular carcinoma (HCC).
METHODS: Four hundred histological specimens of HCC with corresponding non-cancerous liver tissues were immunohistochemically stained for MT (E9), P53 and Ki-67 by EnVision Plus staining using tissue microarrays.
RESULTS: Down-regulated expression of MT protein was detected in HCC, compared with non-cancerous liver tissues. The frequency of MT positivity was significantly lower in cases positive for hepatitis B surface antigen than in those that were negative (P = 0.042). The positive rate of MT expression was higher in tumors ≤ 2 cm than > 2 cm in diameter (P = 0.007). There was a tendency for MT expression to decrease with the progression of histological grade (P = 0.004). Nuclear expression of MT was closely correlated with poorly differentiated HCC. No statistical correlation was found between P53, Ki-67 and MT expressions.
CONCLUSION: Down-regulated expression of MT in HCC may play a role in hepatocarcinogenesis and be a marker of hepatocellular differentiation. Hepatitis B virus infection may be correlated with down-regulated expression of MT. The mainly nuclear MT immunostaining may reflect aggressive behavior in poorly differentiated HCC.
- Citation: Zhang SH, Xu AM. Down-regulated expression of metallothionein and its clinicopathological significance in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3413-3417
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3413.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3413
金属硫蛋白(Metallothionein, MT)是一组富含半胱氨酸的低分子量胞内蛋白质, 其编码的基因家族位于16q13, 由10个功能亚型(MT-1A、MT-1B、MT-1E、MT-1F、MT-1G、MT-1H、MT-1X、MT-2A、MT-3、MT-4)和7个非功能亚型(MT-1C、MT-1D、MT-1I、MT-1J、MT-1K、MT-1L、MT-2B)组成. 一系列的证据表明MT参与许多病理过程, 包括金属离子稳态和解毒、保护氧化损伤、细胞增殖和凋亡、药物和放射治疗耐受和致癌的某些过程[1-2]. 多项研究显示MT表达与人类多种肿瘤发生和发展的不同阶段密切相关, 在人体多种肿瘤如乳腺、肺、肾、鼻咽、卵巢、唾液腺、睾丸、甲状腺及膀胱癌等表达增加, 但在某些肿瘤如肝细胞癌(HCC), 前列腺癌和大肠癌表达下调[1-2]. 由于以往对HCC中MT表达研究的病例较少, 因此其在HCC中意义仍不明了[3-5]. 王葵 et al[6]对HCC的cDNA微阵列基因表达谱研究显示, 与相应的非癌肝组织相比, HCC组织中MT-2A表达显著下调. 为了评价在HCC中MT作为肿瘤标记物的潜在价值, 我们用组织芯片技术, 对肝癌组织和非癌肝组织中MT表达和定位进行了研究.
400例肝癌切除标本来自第二军医大学东方肝胆外科医院, 所有患者术前未接受任何治疗. 男286例, 女114例, 年龄27-78(中位数为50.7)岁, 305例患者血清HBsAg阳性, 261例患者血清甲胎蛋白(AFP)>20 μg/L, 肿瘤平均直径6.8(1.0-17.5) cm, 57例为直径≤2 cm的单结节肿瘤, 343例肝癌>2 cm. 组织病理诊断根据2000年WHO肝及肝内胆管肿瘤病理学分类, 高分化95例、中分化236例、低分化69例. 321例肿瘤无包膜或包膜不完整, 274例有肝内转移(门静脉浸润和/或肝内扩散), 275例伴有肝硬化, 89例慢性肝炎和36例正常肝组织.
1.2.1 组织芯片制备: 首先在苏木精-伊红(HE)染色切片上进行定位. 选取癌及癌旁组织位点, 应用Instrumedics公司生产的组织芯片制作仪, 取样针直径2 mm, 共制作10个组织芯片蜡块, 以4 μm厚度连续切片, 敷贴于10 g/L多聚赖氨酸处理的载玻片上, 各取1张进行HE染色供形态学观察.
1.2.2 免疫组化染色: 免疫组化采用Dako EnVision Plus法, 鼠抗人MT mAb(E9克隆系, 与MT-1及MT-2反应, Dako, 1:100)、鼠抗人P53 mAb(DO-7, Dako, 1:50)、鼠抗人Ki-67核抗原mAb(MIB-1, Dako, 1:500)均购于基因公司. 抗原修复用0.02 mol/L(pH8.0)乙二铵四乙酸钠液微波处理10 min, 共2次, 用已知的阳性切片作阳性对照, PBS液代替一抗作阴性对照. 染色切片由两名事先未了解患者临床资料的病理医师按以往介绍的方法独立评估[3]. MT阳性细胞包括胞质、胞核或胞质和胞核三种表达模式, 无染色为阴性, <10%为低表达, ≥10%为高表达. P53和Ki-67阳性细胞仅胞核出现棕黄色颗粒, Ki-67标记指数为阳性细胞百分数, P53染色超过10%视为阳性.
统计学处理 所有统计学处理采用SPSS11.0软件. MT表达与HCC临床病理特征关系分析采用χ2检验, MT与Ki-67和P53的相关性分析采用Spearman检验, P<0.05视为差异有显著性.
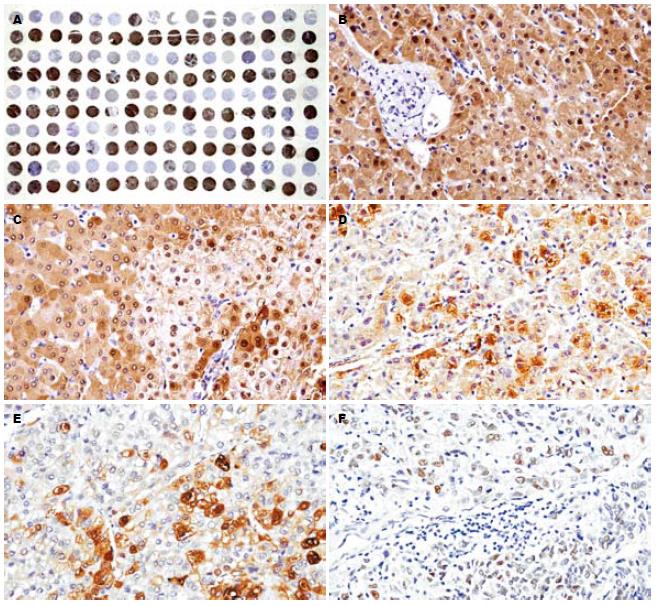
所有阴性对照切片均无MT阳性着色, 表明本实验所用小鼠抗人MT mAb(E9)的特异性. 图1A显示一个肿瘤及相应的非癌肝组织MT表达组织芯片. 在正常肝、肝炎和肝硬化组织的肝细胞中MT呈一致强阳性表达(图1B), 肝硬化组织中透明细胞的胞质和胞核呈弱阳性(图1C), 周围结缔组织、血管和胆管无MT阳性着色.
与相应的非癌肝组织相比, HCC中MT表达显著下调. HCC组织MT呈异质性表达, 弥漫阳性57例(14.3%)、灶性阳性203例(50.8%)和阴性140例(35%). 高、中分化HCC中MT表达以胞质染色为主, 而胞核呈弱阳性或阴性(图1D-E). 低分化HCC中MT染色以胞核为主, 而胞质呈弱阳性或阴性(图1F). 低分化HCC胞核MT染色的频率显著高于高、中分化者(16/36 vs 59/224, P = 0.026).
肝细胞癌MT、P53和Ki-67表达与临床病理特征的相关性HBsAg阳性患者MT阳性率显著低于阴性者(P = 0.042), 肿瘤直径≤2 cm的MT阳性率显著高于肿瘤直径>2 cm者(P = 0.007), MT阳性率与组织学分级进程显著相关(P = 0.004), MT表达与患者年龄、血清甲胎蛋白浓度、肝硬化、包膜及肝内转移无显著差异(表1).
| 参数 | n | 金属硫蛋白 | P53 | Ki67 | ||||||
| - | +(低, 高) | P | -(<10%) | +(≥10%) | P | <50% | ≥50% | P | ||
| 性别 | ||||||||||
| 男 | 286 | 97 | 189(156, 33) | 0.472 | 164 | 122 | 0.826 | 127 | 159 | 0.167 |
| 女 | 114 | 43 | 71(47, 24) | 64 | 50 | 42 | 72 | |||
| 年龄 | ||||||||||
| ≤中位数 | 184 | 62 | 122(94, 28) | 0.614 | 103 | 81 | 0.703 | 80 | 104 | 0.646 |
| >中位数 | 216 | 78 | 138(109, 29) | 125 | 91 | 89 | 127 | |||
| 血清AFP水平(μg/L) | ||||||||||
| <20 | 137 | 56 | 81(61, 20) | 0.075 | 72 | 65 | 0.195 | 62 | 75 | 0.380 |
| ≥20 | 263 | 84 | 179(142, 37) | 156 | 107 | 107 | 156 | |||
| 血清HBsAg | ||||||||||
| 阳性 | 305 | 115 | 190(171, 19) | 0.042 | 179 | 126 | 0.222 | 130 | 175 | 0.787 |
| 阴性 | 95 | 25 | 70(32, 38) | 49 | 46 | 39 | 56 | |||
| 肿瘤直径 | ||||||||||
| ≤2 cm | 57 | 11 | 46(30, 16) | 0.007 | 40 | 17 | 0.030 | 22 | 35 | 0.546 |
| >2 cm | 343 | 129 | 214(173, 41) | 188 | 155 | 147 | 196 | |||
| 组织学分级 | ||||||||||
| 高分化 | 95 | 22 | 73(41, 32) | 0.004 | 68 | 27 | 0.002 | 56 | 39 | <0.001 |
| 中分化 | 236 | 85 | 151(134, 17) | 129 | 107 | 93 | 143 | |||
| 低分化 | 69 | 33 | 36(28, 8) | 31 | 38 | 20 | 49 | |||
| 肝硬化 | ||||||||||
| 无 | 125 | 44 | 81(59, 22) | 0.955 | 70 | 55 | 0.785 | 55 | 70 | 0.633 |
| 有 | 275 | 96 | 179(144, 35) | 158 | 117 | 114 | 161 | |||
| 肿瘤包膜 | ||||||||||
| 完整 | 79 | 21 | 58(38, 20) | 0.08 | 49 | 30 | 0.338 | 36 | 43 | 0.505 |
| 无或不完整 | 321 | 119 | 202(165, 37) | 180 | 141 | 133 | 188 | |||
| 肝内转移 | ||||||||||
| 未发现 | 126 | 35 | 91(65, 26) | 0.125 | 81 | 45 | 0.046 | 57 | 69 | 0.412 |
| 发现 | 274 | 105 | 169(138, 31) | 147 | 127 | 112 | 162 | |||
| P53 | ||||||||||
| + | 172 | 53 | 119(91, 28) | 0.127 | - | - | 79 | 93 | 0.196 | |
| - | 228 | 87 | 141(112, 29) | - | - | 90 | 138 | |||
| Ki67 | ||||||||||
| ≤50% | 169 | 58 | 111(88, 23) | 0.807 | 90 | 79 | 0.196 | - | - | |
| >50% | 231 | 82 | 149(115, 34) | 138 | 93 | - | - | |||
| 合计 | 400 | 140 | 260(203, 57) | 228 | 172 | 169 | 231 | |||
肝细胞癌P53表达的阳性率为43%(172/400), 肿瘤直径≤2 cm的P53阳性率显著低于肿瘤直径>2 cm者(P = 0.030), P53阳性率与组织学分级进程显著相关(P = 0.002), 肝内转移者P53阳性率明显高于无明显肝内转移者(P = 0.046), P53和MT染色之间无统计学相关性.
肝细胞癌高Ki-67标记指数(≥50%)为57.8%(231/400), 高Ki-67标记指数与HCC的组织学分化进程显著相关(P<0.001), Ki-67和MT染色之间无统计学相关性.
研究表明, MT可参与细胞增殖、发育、肿瘤发生和细胞周期调节. 在正常肝组织中MT含量丰富, 是肝脏参与金属解毒功能的物质基础. MT是细胞内一种重要的自由基清除剂, 在灭活体内自由基等过氧化物方面起重要作用, 因其分子上含有丰富的巯基(SH), 起重要的细胞保护功能. 而哺乳动物细胞内基因突变最重要的原因是内源性氧化损伤, MT表达的下降将导致细胞内氧化物的堆积, 从而引起某些原癌基因的激活或抑癌基因的失活而引发肝细胞癌变[1-2]. 本研究结果显示, 与相应的非癌肝组织相比, HCC中MT表达显著下调, 且与HBsAg、肿瘤大小和肿瘤分化明显相关. 这一结果表明, MT表达下降可能在致癌过程中发挥作用, 并可能是一个相对早期事件和肝细胞分化的标记.
我们的研究结果显示, HBV感染与MT表达下调相关, 其机制尚不清楚. 有文献报道MT能与HBV的多种抗原成分结合, 在致肝细胞损伤过程中可能起重要作用[7]. 因此我们推测, HBV感染后与肝脏内MT结合, 导致肝细胞内MT表达和功能降低, 最终导致HCC的发生, 但确切的机制需要进一步研究.
MT是一种胞质蛋白. 最近的研究表明, 他存在于正常和恶性肿瘤细胞的胞质和胞核内, 且核内表达似乎与对顺铂的耐药有关[8-9]. 我们的结果显示, 在高、中分化HCC中MT阳性细胞位于胞质和胞核, 而低分化HCC则以胞核为主, 提示其可能与其侵袭性行为有关, 但是否与HCC对化疗效果差和预后不良有关, 尚需进一步加以研究. 此外, 研究显示乳腺和鼻咽癌MT表达与细胞增殖活性相关[10-11]. 我们的研究结果显示高Ki-67指数与肿瘤分级进程显著相关, 但与MT表达无明显相关性.
肝细胞癌中MT下调的机制尚不清楚, 可能与MT启动子甲基化或其他基因如P53的突变有关[12-13]. 体外研究显示, P53和雌激素受体影响上皮性肿瘤细胞MT的表达和诱导, 提示MT与P53之间的功能关系[14]. MT和P53阳性的食管鳞状细胞癌对化疗的反应较差, 提示联合MT和P53检测可能有助于寻找治疗中晚期食管鳞状细胞癌术前化疗药物[15]. 我们的研究结果也证实P53表达与较大肿瘤和组织学分级进程密切相关, 支持P53基因突变是HCC一个相对晚期事件, 但MT与P53表达之间无相关性. 因此, MT的生物学功能以及表达下调作为HCC一个潜在的诊断、预后及化疗标记仍需进一步加以研究.
金属硫蛋白(MT)是一组富含半胱氨酸的低分子量胞内蛋白质, 在人体多种肿瘤如乳腺、肺、肾、鼻咽、卵巢、唾液腺、睾丸、甲状腺及膀胱癌等表达增加, 但在肝细胞癌(HCC)、前列腺癌和大肠癌等表达下调.
cDNA微阵列基因表达谱研究显示HCC组织中MT-1X和MT-2A表达显著下调.
HCC组织MT的表达显著下调与肿瘤大小和组织学分级进程密切相关, HBsAg可能与MT表达下调有关, 以核染色为主的MT表达可能反映了低分化HCC的一种侵袭性行为.
HCC中MT表达下调在肝癌的发生过程中可以起一定作用, 可能是HCC一个潜在的诊断、预后及化疗标记.
本文所用方法成熟, 设计合理, 临床标本量大, 有一定的学术价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Theocharis SE, Margeli AP, Klijanienko JT, Kouraklis GP. Metallothionein expression in human neoplasia. Histopathology. 2004;45:103-118. [PubMed] |
| 2. | Cherian MG, Jayasurya A, Bay BH. Metallo-thioneins in human tumors and potential roles in carcinogenesis. Mutat Res. 2003;533:201-209. [PubMed] |
| 3. | Deng DX, Chakrabarti S, Waalkes MP, Cherian MG. Metallothionein and apoptosis in primary human hepatocellular carcinoma and metastatic adenocarcinoma. Histopathology. 1998;32:340-347. [PubMed] |
| 4. | Cai L, Wang GJ, Xu ZL, Deng DX, Chakrabarti S, Cherian MG. Metallothionein and apoptosis in primary human hepatocellular carcinoma (HCC) from northern China. Anticancer Res. 1998;18:4667-4672. [PubMed] |
| 5. | Ebara M, Fukuda H, Hatano R, Saisho H, Nagato Y, Suzuki K, Nakajima K, Yukawa M, Kondo F, Nakayama A. Relationship between copper, zinc and metallothionein in hepatocellular carcinoma and its surrounding liver parenchyma. J Hepatol. 2000;33:415-422. [PubMed] |
| 7. | Lu YY, Liang YD, Cheng J, Chen TY, Wang L, Liu Y, Li K, Zhang LX, Yang YP. Mutual interaction between hepatitis B virus antigen and metallothionein. Zhonghua Gan Zang Bing Za Zhi. 2004;12:540-542. [PubMed] |
| 8. | Kondo Y, Kuo SM, Watkins SC, Lazo JS. Metallothionein localization and cisplatin resistance in human hormone-independent prostatic tumor cell lines. Cancer Res. 1995;55:474-477. [PubMed] |
| 9. | Kondo Y, Yamagata K, Satoh M, Himeno S, Imura N, Nishimura T. Optimal administration schedule of cisplatin for bladder tumor with minimal induction of metallothionein. J Urol. 2003;170:2467-2470. [PubMed] |
| 10. | Pastuszewski W, Dziegiel P, Krecicki T, Podhorska-Okolow M, Ciesielska U, Gorzynska E, Zabel M. Prognostic significance of metallothionein, p53 protein and Ki-67 antigen expression in laryngeal cancer. Anticancer Res. 2007;27:335-342. [PubMed] |
| 11. | Jin R, Chow VT, Tan PH, Dheen ST, Duan W, Bay BH. Metallothionein 2A expression is associated with cell proliferation in breast cancer. Carcinogenesis. 2002;23:81-86. [PubMed] |
| 12. | Deng D, El-Rifai W, Ji J, Zhu B, Trampont P, Li J, Smith MF, Powel SM. Hypermethylation of metallothionein-3 CpG island in gastric carcinoma. Carcinogenesis. 2003;24:25-29. [PubMed] |
| 13. | Ostrakhovitch EA, Olsson PE, Jiang S, Cherian MG. Interaction of metallothionein with tumor suppressor p53 protein. FEBS Lett. 2006;580:1235-1238. [PubMed] |
| 14. | Ostrakhovitch EA, Olsson PE, von Hofsten J, Cherian MG. P53 mediated regulation of metallothionein transcription in breast cancer cells. J Cell Biochem. 2007;. [PubMed] |
| 15. | Sunada F, Itabashi M, Ohkura H, Okumura T. p53 negativity, CDC25B positivity, and metallothionein negativity are predictors of a response of esophageal squamous cell carcinoma to chemoradiotherapy. World J Gastroenterol. 2005;11:5696-5700. [PubMed] |