修回日期: 2007-10-09
接受日期: 2007-10-28
在线出版日期: 2007-11-08
目的: 探讨食管鳞癌组织和癌旁正常黏膜组织中S100A4和MMP2的表达及其与食管鳞癌临床病理因素之间的关系.
方法: 应用SP免疫组织化学技术检测100例食管鳞癌及其癌旁正常黏膜组织中S100A4和MMP2蛋白的表达.
结果: 食管鳞癌组织中S100A4和MMP2蛋白阳性率分别为52.00%和67.00%, 明显高于癌旁正常黏膜组织26.00%和31.00%(P<0.01). 二者在食管鳞癌中的表达呈正相关, 且与癌组织的分化程度、浸润深度、淋巴结转移密切相关(P<0.05).
结论: S100A4可能通过对MMP-2蛋白的调控在食管鳞癌的发生、发展及食管鳞癌的早期侵袭转移中起关键作用, 有望成为评估食管癌预后的一个新的标志物.
引文著录: 郑献召, 李珊珊, 轩小燕, 李娜, 王丰. 食管鳞癌组织中S100A4和MMP2蛋白表达与临床病理学特征的关系. 世界华人消化杂志 2007; 15(31): 3338-3342
Revised: October 9, 2007
Accepted: October 28, 2007
Published online: November 8, 2007
AIM: To investigate the expression of S100A4 and matrix metalloproteinase 2 (MMP-2) in esophageal squamous cell carcinoma and adjacent normal mucosa, and their correlation with clinicopathological features.
METHODS: SP immunohistochemistry was used to detect the expression of S100A4 and MMP2 proteins in 100 cases of esophageal squamous cell carcinoma and adjacent normal mucosa.
RESULTS: The positive rates of S100A4 and MMP2 protein expression were 52.00% and 67.00%, respectively, in esophageal squamous cell carcinoma, while only 26.00% and 31.00% in normal mucosa. The positive rates of S100A4 and MMP2 protein expression in esophageal squamous cell carcinoma were significantly higher than those in normal mucosa (P < 0.01). The expression of S100A4 and MMP2 protein was significantly associated with differentiation, depth of tumor invasion and lymph node metastasis (P < 0.05). A positive correlation was observed between S100A4 and MMP2 protein in esophageal squamous cell carcinoma.
CONCLUSION: The overexpression of S100A4 protein may produce a marked effect in the genesis, development and progression of esophageal squamous cell carcinoma through regulation of MMP2 protein overexpression. S100A4 may be a potential marker for evaluating the prognosis of esophageal carcinoma.
- Citation: Zheng XZ, Li SS, Xuan XY, Li N, Wang F. Expression of S100A4 and matrix metalloproteinase 2 and their correlations with clinicopathological features in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3338-3342
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3338
食管癌(esophageal cancer, EC)是世界上最常见的恶性肿瘤之一, 并因侵袭与转移使临床进展迅速而且预后很差. 因此找到食管癌早期发生侵袭与转移的主要调控因素, 将直接影响食管癌的治疗与预后. S100A4蛋白是最近通过cDNA文库基因表达系列分析(serial analysis of gene expression, SAGE)筛选出的与多种恶性肿瘤生长密切相关的分子, 在恶性肿瘤的侵袭与转移中起到不可替代的作用[1]. 恶性肿瘤的侵袭与转移包括血管增生、细胞黏附、侵袭和细胞扩增等一系列步骤. 其中基质金属蛋白酶2(matrixmetallo proteinases 2, MMP-2)通过降解基底膜和包绕肿瘤的基质, 突破基质屏障及促进新生血管生成在肿瘤的侵袭与转移中起重要作用. 本文用免疫组化SP法检测了100例食管鳞癌组织中和癌旁正常黏膜组织中S100A4蛋白的表达, 探讨其在食管癌发生、发展中的作用; 统计分析S100A4蛋白与MMP-2蛋白表达的相关性, 探讨其在食管鳞癌侵袭转移中的作用, 可望进一步揭示食管癌早期侵袭与转移的分子生物学机制, 为防治食管癌, 改善预后提供新的思路和理论依据.
郑州大学第一附属医院2001-2004年手术切除100例食管癌标本, 男58例, 女42例, 年龄37-79(57.8±6.2)岁. 按组织分化程度: 高分化25例, 中分化64例, 低分化11例. 其中淋巴结转移23例, 无淋巴结转移77例, 侵及浅层(黏膜下层或浅肌层)36例, 侵及深层(深肌层或外膜)64例. 兔抗人S100A4(AP-9003)多克隆抗体为美国Neomar-Ker公司产品, 兔抗人MMP-2多克隆抗体和免疫组化SP试剂盒购自北京中杉生物公司.
免疫组织化学染色采用链酶卵白素-生物素过氧化物酶法(streptavidin peroxidse, SP). S100A4和MMP-2抗体稀释倍数分别为1:400和1:600, DAB显色, 苏木素复染, 染色步骤严格按说明书进行. 实验中同时作阳性对照及阴性对照, 扁桃体组织切片作阳性对照, 用PBS代替一抗作阴性对照. 细胞质或细胞核中呈现棕黄色染色颗粒为阳性细胞, 计数10个高倍视野中阳性细胞的百分比计算阳性率. S100A4: 阳性细胞数<2%为阴性(-), 阳性细胞数≥2%为(+); MMP-2: 阳性细胞数≤30%为阴性(-), 阳性细胞数>30%为(+).
统计学处理 利用SPSS13.0软件, 率的比较采用χ2检验, 相关分析采用kendall相关分析法, 检验标准取α = 0.05.
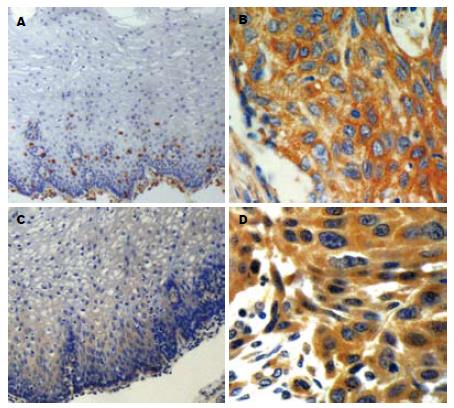
S100A4在正常食管黏膜细胞的胞质表达弱, 可见胞核着色; 在食管鳞癌细胞中有中等强度的胞质着色, 偶见胞核着色, 间质中可见大量血管平滑肌细胞、内皮细胞着色; 间质淋巴细胞、纤维细胞的胞质着色较强(图1A-B). 在食管鳞癌组织中的阳性率为52.0%, 明显高于食管正常黏膜组织中的表达率26.0%(P<0.01). 在不同分化程度的食管鳞癌组织中, S100A4蛋白表达率有显著差异. 高、中、低分化鳞癌中的阳性率分别为36.0%, 51.6%和90.9%. 随癌细胞浸润深度增加S100A4蛋白阳性率增高. 浸润至深层(深肌层和外膜)的食管鳞癌组织中S100A4蛋白阳性表达率为59.4%, 明显高于浸润至浅层(黏膜和浅肌层)的阳性率38.9%(P<0.05). 有淋巴结转移组中S100A4蛋白的阳性表达率(69.5%)高于无淋巴结转移组(40.0%), 差异具有统计学意义(P<0.05)(表1).
| 临床病理特征 | n | S100A4 | MMP-2 | ||||||
| - | + | 阳性率(%) | χ2 | - | + | 阳性率(%) | χ2 | ||
| 正常黏膜 | 100 | 74 | 26 | 26.0 | 14.208b | 69 | 31 | 31.0 | 25.930b |
| 鳞癌 | 100 | 48 | 52 | 52.0 | 33 | 67 | 67.0 | ||
| 性别 | |||||||||
| 男 | 58 | 30 | 28 | 48.3 | 0.767 | 21 | 37 | 63.8 | 0.642 |
| 女 | 42 | 18 | 24 | 57.1 | 12 | 30 | 71.4 | ||
| 年龄 | |||||||||
| ≥60 | 53 | 23 | 30 | 56.6 | 0.958 | 14 | 39 | 73.6 | 3.054 |
| <60 | 47 | 25 | 22 | 46.8 | 19 | 28 | 59.6 | ||
| 分化程度 | |||||||||
| 高 | 25 | 16 | 9 | 36.0 | 13 | 12 | 48.0 | ||
| 中 | 64 | 31 | 33 | 51.6 | 6.440a | 19 | 45 | 70.3 | 7.330a |
| 低 | 11 | 2 | 9 | 90.9 | 1 | 10 | 90.9 | ||
| 浸润深度 | |||||||||
| 浅层 | 36 | 22 | 14 | 38.9 | 3.874a | 19 | 17 | 47.2 | 9.952a |
| 深层 | 64 | 26 | 38 | 59.4 | 14 | 50 | 78.1 | ||
| 淋巴结转移 | |||||||||
| 有 | 23 | 5 | 18 | 69.5 | 8.253a | 3 | 20 | 87.0 | 5.380a |
| 无 | 77 | 43 | 34 | 40.0 | 30 | 47 | 61.0 | ||
S100A4蛋白是由101个氨基酸组成的多肽, 分子量约为11.5 kDa, 属于钙结合蛋白家族成员. 很多研究表明其与多种肿瘤的发生、发展及侵袭转移有关[2-3]. 本研究结果显示, S100A4蛋白在食管正常黏膜组织中的表达明显低于其在食管鳞癌组织中的表达, 且阳性细胞多集中在基底细胞层; 在食管鳞癌组织中尤其较强表达于纤维细胞、间质淋巴细胞的胞质. 间质中可见大量血管平滑肌细胞、内皮细胞着色, 说明S100A4蛋白不仅存在于肿瘤细胞内, 还同时存在于肿瘤细胞外. S100A4通过发挥细胞内和细胞外作用, 影响肿瘤细胞的黏附、酶解、运动、增殖与凋亡和血管生成而促进肿瘤细胞的浸润和转移[4-5].
目前已发现S100A4在乳腺癌、结直肠肿瘤、胃肿瘤、肺癌、膀胱癌、前列腺癌、胆囊癌、卵巢癌、胰腺癌、骨肉瘤等肿瘤中高表达[6-15]. S100A4与细胞分化及肿瘤的发生、发展及预后密切相关[2,16]. S100A4影响细胞周期, 进而使细胞恶性变. Lee et al[17]研究了92例早期乳腺癌患者, 并进行了14年的跟踪随访, 也发现S100A4蛋白阳性的患者发生远期转移率明显升高, 且10年生存率显著降低, 说明S100A4阳性的肿瘤患者预后较差. 本研究结果表明, 在食管鳞癌组织中, 随着癌分化程度的降低, S100A4蛋白的表达显著增强, 表明S100A4的表达与食管癌的恶性程度有关. 随癌细胞侵袭能力的增强, S100A4蛋白阳性率增高. 浸润至深层(深肌层和外膜)的食管鳞癌组织中S100A4蛋白阳性表达率明显高于浸润至浅层(黏膜和浅肌层)的食管鳞癌组织, 伴有淋巴结转移的食管鳞癌组织中S100A4的表达显著增高, 提示S100A4可能与食管癌的高侵袭力和高转移力有关.
肿瘤发生侵袭转移时, 基底膜是主要的天然屏障, MMPs及TIMPs在细胞外基质(ECM)的动态平衡中起重要作用. 癌细胞与基底膜黏附后, 释放或激活蛋白水解酶降解基底膜和细胞外基质然后定向运动穿过缺损的空间. MMPs为一组锌离子依赖性内肽酶, 几乎能降解ECM的所有成分, 在肿瘤侵袭转移中具有重要意义[18]. MMPs家族中的明胶酶是唯一能降解ECM和基底膜(basement men, BM)中Ⅳ胶原三螺旋结构的酶, 可分为MMP-2和MMP-9两个亚型. MMP-2作为降解基底膜和细胞外基质主要结构的关键酶, 对恶性肿瘤的发展及间质血管生成起重要作用. 本研究结果证实了在食管鳞癌组织中存在MMP-2蛋白的过表达, 其阳性率和癌组织的分化程度、浸润深度及伴有淋巴结转移密切相关. 不同年龄组及性别的阳性率无明显差异.
有文献报道[13], S100A4可以通过改变TIMP-2与黏附于细胞膜上的膜型基质金属蛋白酶-1(mem-berane-type matrix metallo-proteinase-1, MT1-MMP)的结合来诱导MMP-2酶原的激活. 还有资料显示, S100A4可通过激活NF-κB通路诱导MMP-2的合成[19], 说明S100A4可直接调节MMP-2的合成. 本实验结果证实S100A4和MMP-2两种蛋白呈正相关. 由此可见, S100A4可能通过对MMP-2蛋白的调控在食管鳞癌的发生、发展及食管鳞癌的早期侵袭转移中起关键作用. 将其作为判断食管癌恶性程度及预后的一种生物学指标, 有可能成为食管鳞癌及其他肿瘤治疗的新靶点.
食管癌是目前世界范围内死亡率很高的恶性肿瘤之一. 中国尤以河南更为常见. 经过几代人的努力, 对食管癌的病因及发病机制有了一些认识, 但到目前为止食管癌的发生机制并没有从根本上阐明. 食管癌仍然严重威胁人们的生命健康. 因此探讨食管癌的发生及演进机制, 对于降低其发生率及寻找新的防治途径都非常重要.
侵袭与转移是恶性肿瘤最主要生物学特性之一, 是导致各种治疗失败, 提示预后不良, 致患者死亡的最主要因素. 大量文献证实, S100A4蛋白在多种恶性肿瘤中高表达, 且同时存在于肿瘤细胞和细胞间质, 与肿瘤的生长、侵袭与转移密切相关. S100A4蛋白促肿瘤形成的机制、调控肿瘤侵袭与转移的途径与方式是目前研究的热点.
Ninomiya et al对52例食管癌患者进行研究, 证实S100A4蛋白在食管癌组织中表达高于正常黏膜, 且提示预后不良. Makiko Moriyama-Kita et al对41例口腔鳞癌患者进行研究, 证实S100A4蛋白是促进肿瘤侵袭与转移的重要因子.
本文研究结果表明, S100A4及MMP-2蛋白的表达与食管癌的恶性程度、高侵袭力和高转移力有关, 且两种蛋白呈明显正相关. S100A4可能通过对MMP-2蛋白的调控在食管鳞癌的发生、发展及食管鳞癌的早期侵袭转移中起关键作用. 联合监测两种蛋白的表达, 对判断食管癌恶性程度及预后更有意义, 为防治食管癌, 改善预后提供新的思路和理论依据, 有望成为食管鳞癌及其他肿瘤治疗的新靶点.
本文内容新颖, 书写流畅, 分析有据, 具有一定的临床意义.
编辑: 何燕 电编:何基才
| 1. | Taylor S, Herrington S, Prime W, Rudland PS, Barraclough R. S100A4 (p9Ka) protein in colon carcinoma and liver metastases: association with carcinoma cells and T-lymphocytes. Br J Cancer. 2002;86:409-416. [PubMed] |
| 2. | Sherbet GV, Lakshmi MS. S100A4 (MTS1) calcium binding protein in cancer growth, invasion and metastasis. Anticancer Res. 1998;18:2415-2421. [PubMed] |
| 3. | Takenaga K, Nakamura Y, Sakiyama S. Expression of antisense RNA to S100A4 gene encoding an S100-related calcium-binding protein suppresses metastatic potential of high-metastatic Lewis lung carcinoma cells. Oncogene. 1997;14:331-337. [PubMed] |
| 4. | Schmidt-Hansen B, Ornas D, Grigorian M, Klingelhofer J, Tulchinsky E, Lukanidin E, Ambartsumian N. Extracellular S100A4 (mts1) stimulates invasive growth of mouse endothelial cells and modulates MMP-13 matrix metalloproteinase activity. Oncogene. 2004;23:5487-5495. [PubMed] |
| 5. | Semov A, Moreno MJ, Onichtchenko A, Abulrob A, Ball M, Ekiel I, Pietrzynski G, Stanimirovic D, Alakhov V. Metastasis-associated protein S100A4 induces angiogenesis through interaction with Annexin II and accelerated plasmin formation. J Biol Chem. 2005;280:20833-20841. [PubMed] |
| 6. | Cabezon T, Celis JE, Skibshoj I, Klingelhofer J, Grigorian M, Gromov P, Rank F, Myklebust JH, Maelandsmo GM, Lukanidin E. Expression of S100A4 by a variety of cell types present in the tumor microenvironment of human breast cancer. Int J Cancer. 2007;121:1433-1444. [PubMed] |
| 7. | Cho YG, Kim SW, Nam SW, Yoon SH, Lee SH, Yoo NJ, Lee JY, Park WS. Overexpression of S100A4 is closely associated with progression of colorectal cancer. World J Gastroenterol. 2005;11:4852-4856. |
| 8. | Chen XL, Zhang WG, Chen XY, Sun ZM, Liu SH. Correlations of S100A4 protein expression to invasion and metastasis of non-small cell lung cancer. Ai Zheng. 2006;25:1134-1137. [PubMed] |
| 9. | Agerbaek M, Alsner J, Marcussen N, Lundbeck F, Von der Maase H. Focal S100A4 protein expression is an independent predictor of development of metastatic disease in cystectomized bladder cancer patients. Eur Urol. 2006;50:777-785. [PubMed] |
| 10. | Gupta S, Hussain T, MacLennan GT, Fu P, Patel J, Mukhtar H. Differential expression of S100A2 and S100A4 during progression of human prostate adenocarcinoma. J Clin Oncol. 2003;21:106-112. [PubMed] |
| 11. | Kikuchi N, Horiuchi A, Osada R, Imai T, Wang C, Chen X, Konishi I. Nuclear expression of S100A4 is associated with aggressive behavior of epithelial ovarian carcinoma: an important autocrine/paracrine factor in tumor progression. Cancer Sci. 2006;97:1061-1069. [PubMed] |
| 12. | Oida Y, Yamazaki H, Tobita K, Mukai M, Ohtani Y, Miyazaki N, Abe Y, Imaizumi T, Makuuchi H, Ueyama Y. Increased S100A4 expression combined with decreased E-cadherin expression predicts a poor outcome of patients with pancreatic cancer. Oncol Rep. 2006;16:457-463. [PubMed] |
| 13. | Mathisen B, Lindstad RI, Hansen J, El-Gewely SA, Maelandsmo GM, Hovig E, Fodstad O, Loennechen T, Winberg JO. S100A4 regulates membrane induced activation of matrix metalloproteinase-2 in osteosarcoma cells. Clin Exp Me. tastasis. 2003;20:701-711. [PubMed] |
| 14. | Yonemura Y, Endou Y, Kimura K, Fushida S, Bandou E, Taniguchi K, Kinoshita K, Ninomiya I, Sugiyama K, Heizmann CW. Inverse expression of S100A4 and E-cadherin is associated with metastatic potential in gastric cancer. Clin Cancer Res. 2000;6:4234-4242. [PubMed] |
| 15. | Chen H, Fernig DG, Rudland PS, Sparks A, Wilkinson MC, Barraclough R. Binding to intracellular targets of the metastasis-inducing protein, S100A4 (p9Ka). Biochem Biophys Res Commun. 2001;286:1212-1217. [PubMed] |
| 16. | Cajone F, Sherbet GV. Stathmin is involved in S100A4-mediated regulation of cell cycle progression. Clin Exp Metastasis. 1999;17:865-871. [PubMed] |
| 17. | Lee WY, Su WC, Lin PW, Guo HR, Chang TW, Chen HH. Expression of S100A4 and Met: potential predictors for metastasis and survival in early-stage breast cancer. Oncology. 2004;66:429-438. [PubMed] |
| 18. | Egeblad M, Werb Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2:161-174. [PubMed] |
| 19. | Han YP, Tuan TL, Wu H, Hughes M, Garner WL. TNF-alpha stimulates activation of pro-MMP2 in human skin through NF- (kappa)B mediated induction of MT1-MMP. J Cell Sci. 2001;114:131-139. [PubMed] |