修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-08
目的: 探讨SOCS1和STAT3蛋白在HCC组织中的表达、相互关系及在HCC发生发展中的意义.
方法: 应用免疫组化方法检测48例HCC组织和癌周肝组织、肝硬化(liver cirrhosis, LC)组织(n = 11)及正常肝组织中(n = 11)SOCS1和STAT3的表达水平.
结果: 癌周肝组织中SOCS1蛋白表达强度显著高于HCC组织, SOCS1蛋白在LC组织及正常肝组织中全部呈阴性表达. HCC组织和癌周肝组织STAT3蛋白阳性表达率显著高于LC组织和正常肝组织; SOCS1在瘤体大小间的表达有显著性差异(P<0.01). STAT3在表达AFP阴性和阳性癌组织组间有显著性差异(P<0.05). HCC组织中SOCS1和STAT3表达具有显著等级正相关(rs = 0.431, P<0.01).
结论: SOCS1和STAT3表达与HCC的发生密切相关, 且两者之间的表达强度具有显著等级正相关.
引文著录: 张荣贵, 臧国庆, 汤正好, 冯洁, 余永胜. 肝细胞癌组织SOCS1和STAT3蛋白的表达意义. 世界华人消化杂志 2007; 15(31): 3310-3314
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 8, 2007
AIM: To investigate the expression of SOCS1 and STAT3 in hepatocellular carcinoma (HCC), as well as their significance in the occurrence and development of HCC.
METHODS: The expression of SOCS1and STAT3 proteins were examined by immunohistochemistry in 48 tissue specimens from HCC and their para-carcinoma tissues, 11 from liver cirrhosis tissues, and 11 from normal liver tissues.
RESULTS: The positive rate of SOCS1 expression was significantly higher in the para-carcinoma tissues than in the HCC tissues (P < 0.001), but its expression in liver cirrhosis and normal liver tissues was negative. While the positive rate of STAT3 expression was markedly higher in HCC than in para-carcinoma tissues (P < 0.001), its expression in the latter was higher than that in liver cirrhosis and normal liver tissues (P < 0.001). Expression of SOCS1 was significantly correlated with tumor size (P < 0.01). Expression of STAT3 was correlated with the expression of alpha fetoprotein (AFP) in HCC tissues (P < 0.05). There was a positive correlation between the expressions of SOCS1 and STAT3 in HCC (rs = 0.431, P < 0.01).
CONCLUSION: Expression of SOCS1 and STAT3 is closely correlated with the development of HCC. A markedly positive correlation exists between SOCS1 and STAT3 expressions.
- Citation: Zhang RG, Zang GQ, Tang ZH, Feng J, Yu YS. Expression of SOCS1 and STAT3 in hepatocellular carcinoma tissues and its significance. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3310-3314
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3310
肝细胞癌(hepatocellular carcinoma, HCC)的发生发展机制是涉及多基因调控、多信号通路参与的复杂网络体系, 是同时牵涉时间和空间概念的四维概念, 其根源是基因表达的异常. 现代分子生物学研究表明, HCC的发生、发展与原癌基因的激活和/或表达增加, 抑癌基因失活和/或表达减少及信号转导通路的异常等有关[1]. 细胞因子受体介导的JAK/STAT(janus kinase/signal transducer and activator of transcription)信号传导途径是目前细胞因子研究领域的热点. JAKs/STATs信号转导通路的异常活化与肿瘤、免疫相关疾病的病理过程密切相关[2]. 研究表明, SOCS1基因和STAT3基因分处于该信号转导通路的上下游, 在多种肿瘤的发生进展中起一定作用. 细胞因子信号转导抑制因子(suppressors of cytokine signaling, SOCS)家族为多种细胞因子、生长因子和激素的信号传导途径的负向调节者, SOCS1为SOCS家族中的重要成员. SOCS1定位在16p12-p13.1, 人类SOCS1基因编码211个氨基酸[3]. SOCS1不仅是细胞因子的调节者, 而且在控制T细胞分化和决定细胞命运方面起重要作用, 与自身免疫、免疫耐受等多种免疫反应以及肿瘤发生亦有重要关系[4]. SOCS1在HCC中广泛甲基化和表达明显降低, 提示SOCS1可能是一抑癌基因[5-7]. 人类STAT3基因定位于第12号染色体, STAT3蛋白是信号转导子与转录激活子家族(signal transducers and activators of transcription, STAT)的重要成员. STAT3是EGFR, IL-6/JAK, Src等多个致癌性酪氨酸激酶信号通道汇聚的焦点, 在多种肿瘤细胞和组织中都有过度激活, 如乳腺癌、卵巢癌、头颈部鳞状细胞癌、前列腺癌、恶性黑色素瘤、多发性骨髓瘤、淋巴瘤、脑瘤、非小细胞肺癌和各种白血病等. 由于持续性激活的STAT3能够促使培养细胞发生恶性转化并能在裸鼠中形成肿瘤, STAT3已被认为是一种癌基因[8-9]. 为了研究癌基因和抑癌基因的异常表达及信号传导通路改变在HCC发生发展过程中的分子机制, 我们应用免疫组化方法检测了正常肝组织及HCC组织中SOCS1和STAT3的表达, 并探讨其在HCC发生、发展中的作用.
肝细胞癌、肝硬化及正常肝组织标本取自2006-01/2006-11手术切除标本及肝穿刺. HCC标本48例, 男39例, 女9例, 年龄32-78(平均51.5)岁. 所有组织标本均经术后病理检查证实为HCC, 所选病例全部包含有癌旁肝组织, 术前未予放化疗. 肿瘤分化程度采用Edmondson 4级分级法. 肝硬化(LC)组织和正常组织各11例, 所有HCC及LC病例血清HBsAg均为阳性. 标本取出后立即以40 g/L中性多聚甲醛溶液固定, 常规石蜡包埋, 5 μm的连续切片, 备作免疫组织化学检测. SOCS1多克隆抗体(兔抗)为北京博奥森生物技术有限公司产品, STAT3多克隆抗体(猫抗) 为Neomarkers公司产品.
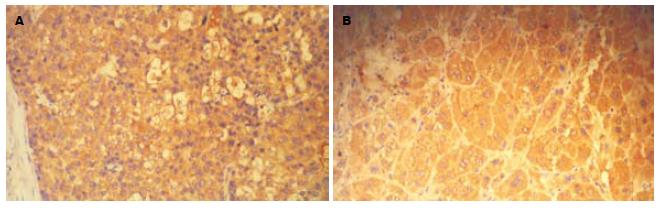
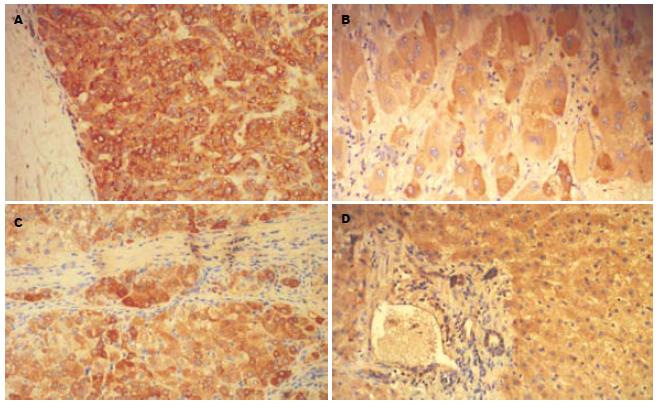
免疫组织化学染色技术的具体操作步骤采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶法(SP法)进行. SOCS1阳性细胞染色定位于细胞质, 以细胞质中呈浅黄、棕黄、或更深的棕褐色的细小颗粒作为阳性细胞(图1). STAT3的阳性细胞染色定位于细胞质, 以细胞质中呈浅黄、棕黄、或更深的棕褐色的细小颗粒作为阳性细胞(图2), 以PBS代替一抗作为阴性对照. 采用3个参数(即染色强度、阳性细胞数和两者记分的乘积)的半定量的计数方法. 着色强度记分标准: 无着色为0分, 浅黄色为1分, 棕黄色为2分, 棕褐色为3分. 光镜下随机观察10个高倍视野, 记录5个高倍视野中染色阳性细胞的百分率. 记分标准: 0%为0分, 1%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 染色强度记分与阳性细胞数记分之积为最后得分: 0分为(-), 1-2分为(+), 3-4分为(++), >4分为(+++).
统计学处理 应用SPSS11.5统计软件包进行统计分析, 组间采用非参数两个或多个独立样本检验, 两指标间采用有序分组资料的等级相关检验. P<0.05为差异有统计学意义.
SOCS1蛋白在HCC组织的表达为(-)6例, (+)30例, (++)12例, (+++)0例; 在癌旁组织的阳性表达为(-)1例, (+)11例, (++)30例, (+++)6例; 在LC组织和正常肝组织的表达全部为阴性. 经统计学检验SOCS1蛋白的表达差异有显著性意义(表1, P<0.01). STAT3蛋白在HCC组织的表达为(-)3例, (+)18例, (++)19例, (+++)8例; 在癌旁组织的阳性表达为(-)0例, (+)22例, (++)21例, (+++)5例; 在肝硬化组织的阳性表达为(-)4例, (+)7例, (++)0例, (+++)0例; 在正常肝组织的阳性表达为(-)5例, (+)6例, (++)0例, (+++)0例. 经统计学检验STAT3蛋白的表达差异有显著性意义(表1, P<0.01).
SOCS1和STAT3的阳性表达在各性别组和各年龄组之间无显著差异, SOCS1表达在瘤体大小间(瘤体<5 cm, ≥5 cm)有显著性差异(P<0.001), 而在肿瘤分化程度及癌组织中AFP, HBsAg表达间无显著性差异(表2, P>0.05). STAT3表达在癌组织AFP表达(阴性和阳性表达)组间有显著性差异(P<0.05), 而表达在肿瘤分化程度、瘤体大小及癌组织HBsAg表达组间无显著性差异(表2, P>0.05). 经等级相关检验表明, HCC组织中SOCS1和STAT3表达具有显著正相关(表3, rs = 0.431, P<0.01).
| SOCS1 | STAT3 | 合计 | |||
| - | + | ++ | +++ | ||
| - | 1 | 3 | 2 | 0 | 6 |
| + | 2 | 14 | 10 | 4 | 30 |
| ++ | 0 | 1 | 7 | 4 | 12 |
| +++ | 0 | 0 | 0 | 0 | 0 |
| 合计 | 3 | 18 | 19 | 8 | 48 |
肿瘤发生和进展的机制至今还未完全阐明, 一般认为与原癌基因的激活和(或)表达增加, 抑癌基因失活和(或)表达减少及信号转导通路的异常等有关, 是一个多因素、多步骤复杂过程. 细胞因子信号转导抑制因子家族为多种细胞因子、生长因子和激素的信号传导途径的负向调节者. SOCS1为SOCS家族中的重要成员, 最早于1997年由3个不同的研究小组分别用不同的方法发现的[10-12]. SOCS1的mRNA通常以低水平存在于未受到刺激的细胞内, 但可以在15-30 min内被许多细胞因子、激素及生长因子所诱导. Tannapfel et al[5]用蛋白微列阵方法检测32种蛋白在HCC中的表达, 发现SOCS1蛋白减少. Nagai et al[6]发现SOCS1基因在HCC中有50%(4/8)的SOCS1mRNA表达水平被明显抑制, CpG岛甲基化分析可显示基因的超甲基化. Yoshikawa et al[7]在HCC细胞系的SOCS1的CpG岛中鉴别出与其转录沉默相关的异常甲基化, 发生率为65%(17/26). 本实验SOCS1蛋白在癌旁肝组织的表达显著高于HCC组织中的表达, 在HCC组织显著高于呈阴性表达的LC组织和正常肝组织, 说明SOCS1基因在HCC发生的早期被多种细胞因子激活, 而并没有发生完全失活. 同时发现SOCS1蛋白的表达在瘤体≥5 cm组显著低于<5 cm组(P<0.001), 表明SOCS1随HCC的生长、进展而表达减少, 可能与SOCS1基因随HCC的进展而逐步失活有关. 进一步证明SOCS1表达与HCC的发生和进展有关, 所以SOCS1的检测对于HCC的早期诊断和预后判断都有十分重要的意义.
Yu et al[13]在研究饲喂3'Me-DAB建立的大鼠HCC模型时, 用免疫组化方法发现STAT3在HCC发生的再生和LC期表达增加(与对照组相比P<0.05). 用蛋白印迹法检测显示STAT3呈强阳性表达(P<0.05). Feng et al[14]发现HCC中P-STAT3的阳性率为74.5%(41/55), 明显高于癌周肝组织(23.6%, 13/55, P<0.01), 认为STAT3的激活可能是HCC发生的早期事件. 本实验中的STAT3的表达在HCC组织显著高于癌周肝组织, 癌周肝组织显著高于LC组织, 提示STAT3基因与HCC的发生发展密切相关, 并且在HCC的发生发展过程中除了STAT3蛋白发生磷酸化之外, 还可能存在STAT3基因的扩增. STAT3蛋白表达在HCC组织AFP阴性表达组显著高于阳性表达组, 而且在病理分化组间差别无显著意义, 可能与我们所用抗体不能反映蛋白磷酸化有关.
JAK/STAT通路代表的是一条极其快速的从细胞外到细胞核的信号转导通路. 近年来发现JAK/STAT途径的激活, 对于细胞的生长, 增殖和转化产生重要影响. Yoshikawa et al[7]在HCC细胞系SNU-387和HuH-1中发现甲基化诱发的SOCS1沉默引起JAK2的磷酸化和STAT3的持续激活, STAT3的激活可能是SOCS1沉默导致HCC发生的一个重要因素.
SOCS1能与JAKs(JAK1-JAK3、TYK2)的JH1区结合并抑制其激酶活性, 从而抑制JAK/STAT通路的信号传导. SOCS1可能是通过其激酶抑制区作为一种假底物妨碍JAK的底物与JAK的结合, 从而抑制JAK的激酶活性[12,15], 进而抑制STAT3的表达和激活. SOCS1基因的启动子含有STAT3的结合位点, STAT3可通过与SOCS1基因的启动子结合而调节其表达. 为了进一步探讨信号转导通路的异常及癌基因和抑癌基因相对表达异常在HCC发生发展中的作用, 我们观察了HCC组织中SOCS1和STAT3蛋白表达之间的关系. 经等级相关检验表明HCC组织中SOCS1和STAT3表达具有显著正相关(rs = 0.431, P<0.005), 提示STAT3的表达可能反馈调节SOCS1的表达, 从而促进SOCS1发挥抗癌作用. HCC的发生、发展是一个多因素逐渐演变的复杂过程. SOCS1和STAT3在HCC中的作用机制有待进一步研究, 二者之间的相互关系有待深入探讨.
我国是肝癌的高发区, 对其发病机制的研究是热点、重点和难点. 研究表明, 肝细胞癌(HCC)的发生与STAT3蛋白的磷酸化密切相关, 同时SOCS1作为一种新的候选抑癌基因也发生甲基化. 但是STAT3和SOCS1蛋白在HCC组织中的表达情况及其关系未见报道.
近来细胞因子体介导的JAK/STAT(janus kinase/signal transducer and activator of tran-scription)信号传导途径是目前细胞因子研究领域的热点, SOCS1和STAT3分处于此通路的上下游, 在HCC的发生过程中起着重要作用, 但是其确切的作用机制有待进一步阐明.
Yoshikawa et al和Nagai et al研究了HCC细胞系和组织中SOCS1基因的甲基化和mRNA表达情况; Yoshikawa et al在HCC细胞系SNU-387和HuH-1中发现甲基化诱发的SOCS1沉默引起JAK2的磷酸化和STAT3的持续激活, STAT3的激活可能是SOCS1沉默导致HCC发生的一个重要因素.
对于SOCS1和STAT3与HCC的关系, 目前主要集中于SOCS1的基因甲基化和STAT3的蛋白磷酸化. 本文首次全面研究了SOCS1和STAT3蛋白在HCC组织的表达情况, 并发现二者表达存在正相关关系.
本文发现癌周组织中存在SOCS1和STAT3蛋白的高表达, 检测其血清和组织表达能够为HCC的早期诊断和鉴别诊断提供有力证据; 以SOCS1和STAT3基因为靶点可以为包括HCC在内的恶性肿瘤的治疗提供新途径.
本文选题新颖, 但技术方法一般, 对肝癌的基础研究有一定的参考意义.
编辑: 何燕 电编:郭海丽
| 1. | Feitelson MA, Sun B, Satiroglu Tufan NL, Liu J, Pan J, Lian Z. Genetic mechanisms of hepatocarcinogenesis. Oncogene. 2002;21:2593-2604. [PubMed] |
| 2. | Terrell AM, Crisostomo PR, Wairiuko GM, Wang M, Morrell ED, Meldrum DR. Jak/STAT/SOCS signaling circuits and associated cytokine-mediated inflammation and hypertrophy in the heart. Shock. 2006;26:226-234. [PubMed] |
| 3. | Yandava CN, Pillari A, Drazen JM. Radiation hybrid and cytogenetic mapping of SOCS1 and SOCS2 to chromosomes 16p13 and 12q, respectively. Genomics. 1999;61:108-111. [PubMed] |
| 4. | Trop S, De Sepulveda P, Zuniga-Pflucker JC, Rottapel R. Overexpression of suppressor of cytokine signaling-1 impairs pre-T-cell receptor-induced proliferation but not differentiation of immature thymocytes. Blood. 2001;97:2269-2277 [PMID: 11290587] 5 Tannapfel A, Anhalt K, Hausermann P, Sommerer F, Benicke M, Uhlmann D, Witzigmann H, Hauss J, Wittekind C. Identification of novel proteins associated with hepatocellular carcinomas using protein microarrays. J Pathol 2003; 201: 238-249. [PubMed] |
| 5. | Nagai H, Kim YS, Konishi N, Baba M, Kubota T, Yoshimura A, Emi M. Combined hypermethylation and chromosome loss associated with inactivation of SSI-1/SOCS-1/JAB gene in human hepatocellular carcinomas. Cancer Lett. 2002;186:59-65. [PubMed] |
| 6. | Yoshikawa H, Matsubara K, Qian GS, Jackson P, Groopman JD, Manning JE, Harris CC, Herman JG. SOCS-1, a negative regulator of the JAK/STAT pathway, is silenced by methylation in human hepatocellular carcinoma and shows growth-suppression activity. Nat Genet. 2001;28:29-35. [PubMed] |
| 7. | Burke WM, Jin X, Lin HJ, Huang M, Liu R, Reynolds RK, Lin J. Inhibition of constitutively active Stat3 suppresses growth of human ovarian and breast cancer cells. Oncogene. 2001;20:7925-7934. [PubMed] |
| 8. | Leong PL, Andrews GA, Johnson DE, Dyer KF, Xi S, Mai JC, Robbins PD, Gadiparthi S, Burke NA, Watkins SF. Targeted inhibition of Stat3 with a decoy oligonucleotide abrogates head and neck cancer cell growth. ProcNatl Acad Sc. i U S A. 2003;100:4138-4143. [PubMed] |
| 9. | Starr R, Willson TA, Viney EM, Murray LJ, Rayner JR, Jenkins BJ, Gonda TJ, Alexander WS, Metcalf D, Nicola NA. A family of cytokine-inducible inhibitors of signalling. Nature. 1997;387:917-921. [PubMed] |
| 10. | Naka T, Narazaki M, Hirata M, Matsumoto T, Minamoto S, Aono A, Nishimoto N, Kajita T, Taga T, Yoshizaki K. Structure and function of a new STAT-induced STAT inhibitor. Nature. 1997;387:924-929. [PubMed] |
| 11. | Endo TA, Masuhara M, Yokouchi M, Suzuki R, Sakamoto H, Mitsui K, Matsumoto A, Tanimura S, Ohtsubo M, Misawa H. A new protein containing an SH2 domain that inhibits JAK kinases. Nature. 1997;387:921-924. [PubMed] |
| 12. | Yu XT, Zhu SN, Xu ZD, Hu XQ, Zhu TF, Chen JQ, Lu SL. Roles of EGFR-Stat3 signal pathway in carcinogenesis of experimental hepatoma in rats. J Cancer Res Clin Oncol. 2007;133:145-152. [PubMed] |
| 13. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] |
| 14. | Giordanetto F, Kroemer RT. A three-dimensional model of Suppressor Of Cytokine Signalling 1 (SOCS-1). Protein Eng. 2003;16:115-124. [PubMed] |