修回日期: 2007-09-24
接受日期: 2007-09-28
在线出版日期: 2007-11-08
目的: 研究补充小剂量全反式维甲酸(ATRA)对酒精喂养大鼠肝脏维生素A类物质(reti-noids, 主要是维生素A和RA)含量、维生素A类物质极性代谢产物(PRMs)形成, 细胞色素P4502E1(CYP2E1)表达和肝细胞损伤的影响.
方法: 将30只SD大鼠随机分为A组(正常对照组), B组(单纯乙醇组)、C组(无水乙醇8 g/kg ig 8 wk+150 µg/kg ATRA)、D组(无水乙醇8 g/kg ig 8 wk+1.5 mg/kg ATRA ig 4 wk)四组. 光镜下观察肝组织病理变化, 高效液相色谱(HPLC)技术测定肝组织中Vitamin A类物质(retinoids)的含量, Western blotting检测肝脏CYP2E1的表达.
结果: B组大鼠肝脏RA、维生素A(Retinol)和维生素A棕榈酸酯(retinyl palmitate)与A组相比含量显著降低(0.077±0.029 nmol/g vs 0.183±0.037 nmol/g, 8.13±1.379 nmol/g vs 21.43±2.944 nmol/g, 132.6±6.472 nmol/g vs 221.1±10.35 nmol/g, P<0.01), 且肝脏中出现明显的PRMs. C组RA和Retinol含量恢复至A组水平, retinyl palmitate含量也部分恢复. D组RA和retinyl palmitate完全恢复至正常水平, 而Retinol水平较A组升高(27.26±3.149 nmol/g vs 21.43±2.944 nmol/g, P<0.05). 两种剂量的ATRA均可完全阻止PRMs形成. 病理组织学检查显示补充ATRA可明显减轻肝细胞肿胀、脂肪变性, 但对CYP2E1的表达没有明显影响.
结论: 小剂量ATRA能恢复酒精性肝病(ALD)大鼠肝脏retinoids含量, 阻止PRMs产生, 从而减轻肝细胞损伤.
引文著录: 潘志红, 但自力, 龚发良, 郑宗军. 全反式维甲酸对酒精性肝损伤大鼠肝脏retinoids含量和CYP2E1表达的影响. 世界华人消化杂志 2007; 15(31): 3261-3266
Revised: September 24, 2007
Accepted: September 28, 2007
Published online: November 8, 2007
AIM: To investigate the effects of low-dose all-trans-retinoic acid (ATRA) supplementation on the concentrations of hepatic retinoids, formation of polar retinoid metabolites (PRMs), expression of microsomal cytochrome P4502E1 (CYP2E1) and liver injury in ethanol-fed rats.
METHODS: A rat model of alcoholic liver disease (ALD) was induced by intragastric infusion of ethanol. Thirty male SD rats were randomly assigned to four groups: group A was a control group, rats of groups B, C and D were received intra-gastric infusion of alcohol (8 g/kg) for 8 weeks, and rats of groups C and D were administered all-trans-RA at two different doses (150 µg/kg body wt in group C and 1.5 mg/kg body wt in group D), by intragastric infusion, for 4 weeks. The concentrations of retinoids in rat liver were detected using high-performance liquid chromatography (HPLC), the levels of CYP2E1 were measured by Western blotting, and pathological changes in the livers were observed under light microscope.
RESULTS: Retinoid (vitamin A, RA, retinyl palmitate) concentrations in the livers of ethanol-fed rats were markedly diminished (8.13 ± 1.379 nmol/g, 0.077 ± 0.029 nmol/g and 132.6 ± 6.472 nmol/g, respectively, vs 21.43 ± 2.944 nmol/g, 0.183 ± 0.037 nmol/g and 221.1 ± 10.35 nmol/g; P < 0.01) in group B animals compared with those in group A animals. Furthermore, obvious peaks representing PRMs were observed in extracts from the livers of group B animals. In group C animals, the RA and vitamin A concentrations were raised to control levels and the retinyl palmitate concentrations were partially restored (P < 0.05). In group D animals, RA and retinyl palmitate concentrations were completely restored. However, the vitamin A concentrations were higher than those of controls (27.26 ± 3.149 nmol/g vs 21.43 ± 2.944 nmol/g, P < 0.05). Histological observation of liver tissues indicated that ATRA treatment notably reduced hepatocellular swelling and steatosis, but the expression of CYP2E1 was not affected by ATRA.
CONCLUSION: Low-dose ATRA treatment can restore retinoid concentrations and abolish PRMs formation in the livers of ALD rats, and eventually ameliorates liver injury.
- Citation: Pan ZH, Dan ZL, Gong FL, Zheng ZJ. Effect of all-trans retinoic acid on retinoid concentrations and expression of CYP2E1 in the livers of ethanol-fed rats. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3261-3266
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3261.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3261
长期大量饮酒可改变肝脏维生素A代谢, 导致肝脏维生素A及维甲酸(RA)缺乏[1], 肝脏中PRMs形成及CYP2E1表达增加[2], PRMs可能在ALD的发病机制中起重要作用. RA是维生素A最具有生物活性的代谢物, 他在控制细胞增殖、分化及正常功能发挥中起重要调节作用[1]. 但自力 et al研究证实PRMs通过诱导肝细胞凋亡而对肝细胞产生毒性作用. Chung et al[4]研究发现小剂量ATRA可抑制乙醇导致的大鼠肝细胞过度增生. 本实验通过建立酒精性肝损伤模型, 观察小剂量ATRA对肝脏retinoids和PRMs含量、CYP2E1表达及肝脏损伤的影响.
健康SD大鼠30只, 体质量180-220 g, 由本校实验动物学部提供. 标准品(色谱级)视黄醇(Retinol)、视黄醇棕榈酸酯(retinyl palmitate)、RA和内标视黄醇醋酸酯(retinyl acetate)均购自Sigma公司, 甲醇(色谱纯)和正己烷(分析纯)为天津市标准科技有限公司产品. 无水乙醇(分析纯)由上海振兴化工一厂生产. CYP2E1多克隆抗体由德国埃尔兰根-纽伦堡大学医学部肝病实验室友情赠送, 增强化学发光(ECL)试剂为Pierce公司产品, 免疫组化SP试剂盒购自北京中杉金桥生物技术有限公司. 高效液相色谱仪HPLC为美国Waters公司生产: 2690型分离单元, 996型二极管阵列检测器, 自动进样装置, Millennium 3.20版本数据工作站. 色谱柱: Eurospher C 18反相色谱柱, 250 mm×4.6 mm, 5 µm(产自德国KNAUER公司).
将30只SD大鼠随机分为4组(A、B、C、D组), 正常对照组(A组)6只, 实验组(B、C、D组)各组8只. B、C、D组用无水乙醇和生理盐水配制的500 mL/L乙醇溶液ig, 开始剂量为4 g/kg体质量, 经过2 wk的适应期, 剂量逐渐加大到8 g/kg体质量, 分早晚两次ig. A组以等量生理盐水ig, 其余条件相同. 8 wk后, C、D组开始同时给予ATRA ig, 剂量分别为150 µg/kg、1.5 mg/kg, 持续4 wk. 实验期间各组大鼠自由进食全价营养颗粒饲料及饮用水. 每周记录大鼠体质量一次. 造模结束后, 各组大鼠禁食过夜, 然后用60 g/L水合氯醛0.5 mL/100 g ip麻醉, 心脏取血2份. 一份肝素抗凝, 3000 r/min离心15 min获取血浆; 另一份直接3000 r/min离心15 min获得血清. 取出肝脏, 取部分肝组织固定制作光镜切片, 其余肝脏速冻于液氮中, 随后放入-80℃冰箱储存以待检测.
1.2.1 肝脏标本retinoids提取: 参照Liu et al[2]所述方法, 取肝组织约0.3 g, 加入冰上预冷的HEPES Buffer 1 mL和甲醇0.5 mL, 冰上匀浆后取1 mL匀浆液, 依次加入0.5 mol/L KOH乙醇溶液150 µL、无水乙醇50 µL、内标溶液100 µL, 再加入4 mL正己烷, 旋涡振荡1 min, 然后4℃下4000 r/min离心10 min, 将上清正己烷层转移至另一试管, 剩余物中加入6 mol/L盐酸100 µL, 再次用4 mL正己烷提取. 把两次提取物混合, 氮气流吹干正己烷, 无水乙醇重新溶解干燥物待用. 上述动物处死取标本和retinoids的提取过程均在避光条件下进行, 以防retinoids遇光分解.
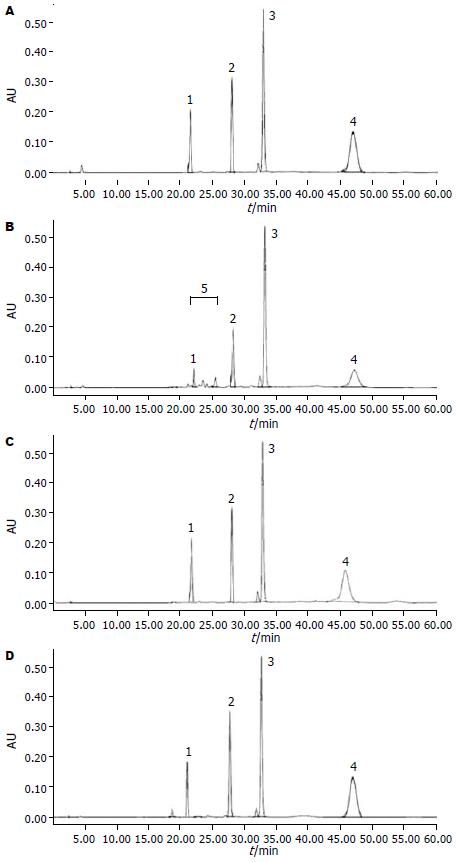
1.2.2 HPLC分析: (1)HPLC流动相: 溶液A: 甲醇-水(70:30, V/V, 水中含10 g/L醋酸铵), 溶液B: 甲醇. (2)流动相梯度设置: 1000 mL/L溶液A持续8 min, 接着10 min的线性梯度至300 mL/L溶液A和700 mL/L溶液B, 然后20 min的线性梯度至1000 mL/L溶液B, 并持续20 min, 最后2 min的梯度回至1000 mL/L溶液A[2]. (3)流速: 1 mL/min. (4)检测波长: 340 nm. (5)RA、Retinol、retinyl acetate和retinyl palmitate的洗脱时间分别是22.3 min、27.6 min、32.2 min和46.7 min. (6)retinoids各成分含量的计算是以内标retinyl acetate的HPLC峰面积为基础.
1.2.3 Western: blot: 肝组织约0.2 g, 加入匀浆液(100 mmol Tris, pH7.4, 0.1 mmol EDTA, 0.32 mol蔗糖, 0.1 mmol DDT和蛋白酶抑制剂PMSF, Aprotinin, Leupeptin)冰上匀浆, 然后进行低温差速离心: 4600 r/min离心5 min, 取上清, 8200 r/min离心5 min, 取上清, 275 000 r/min离心60 min. 将沉淀物混悬于此缓冲液: 100 mmol Tris, pH7.4, 0.1 mmol EDTA, 0.1 mmol DDT, 1.15%(W/V)KCl和20%(V/V)甘油[5]. Bradford比色法测定蛋白浓度, 进行SDS-PAGE电泳(4%浓缩胶, 12%分离胶), 电转移法将蛋白质转移至醋酸纤维素膜(NC膜), 50 g/L脱脂牛奶封闭1 h, 兔抗人多克隆CYP2E1抗体(1:1800)37℃孵育1.5 h, 辣根过氧化物酶(HRP)标记的羊抗兔IgG(1:2000)37℃孵育1 h, 增强化学发光法(ECL)显色, X光片曝光显影.
统计学处理 使用SPSS11.5统计软件包进行统计学处理. 试验数据以mean±SD表示, 计量资料采用单因素方差分析, 各处理组间用最小显著性差数法(LSD)进行多重比较.
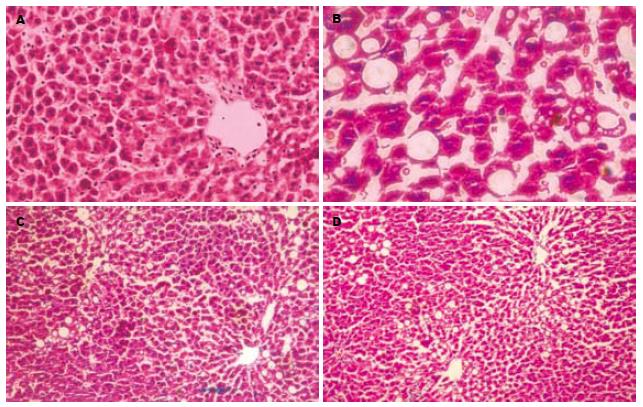
对照组肝组织结构完整, 肝细胞索排布规则. 单纯乙醇ig组肝细胞出现明显脂肪变性, 主要位于肝小叶中心带, 胞体肿大甚至成球形, 胞质透明, 胞核被挤至胞质边缘, 肝窦受压, 肝索紊乱. 有散在肝细胞点状坏死, 坏死灶区和汇管区有炎性细胞浸润. 乙醇ig+RA 150 µg/kg组和乙醇ig+RA 1.5 mg/kg组肝细胞脂肪变性较单纯乙醇灌胃组减轻, 胞体肿大但无球形, 胞质网状, 无肝细胞点状坏死. 肝索排列欠整齐(图1).
乙醇ig 3 mo后, 与正常对照组相比, 单纯乙醇ig组大鼠肝脏RA含量降低了58%(P<0.01), 而肝脏Retinol和retinyl palmitate含量分别减少了60%及40%(P<0.01). 然而与单纯乙醇ig组相比, 对乙醇ig的大鼠给予两种不同剂量(150 µg/kg和1.5 mg/kg体质量)的RA均可恢复肝脏RA含量至正常水平. 补充RA 150 µg/kg使肝脏Retinol含量恢复至对照组水平, 补充RA 1.5 mg/kg则使肝脏Retinol含量高于对照组水平, 两者差异有显著性意义(P<0.05). 与对照组和单纯乙醇ig组比较, 给予RA 150 µg/kg可部分恢复肝脏retinyl palmitate水平(P<0.05), RA 1.5 mg/kg则完全恢复肝脏retinyl palmitate至正常水平(表1).
从HPLC色谱图(图2)可看出, 在单纯乙醇ig组大鼠肝脏, 21 min至26 min处出现明显乙醇诱导的肝脏retinoids极性代谢产物(PRMs), 而两种剂量的RA补充均可阻止该极性产物的产生.
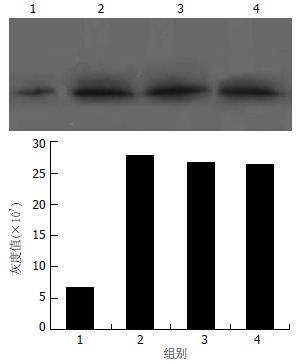
对照组大鼠肝脏CYP2E1表达低下, 在乙醇的诱导下, CYP2E1的表达显著升高(P<0.01), 灰度值约为对照组的4倍. 乙醇ig后给予RA补充, 150 µg/kg和1.5 mg/kg均未明显降低CYP2E1的表达(P>0.05)(图3).
大量研究发现, 酒精性肝病患者的肝脏维生素A含量明显降低. 甚至当肝损伤只是中度(脂肪肝), 血液中维生素A、视黄醇结合蛋白(RBP)等未受影响时, 肝脏中维生素A就已显著降低. 本研究发现, 大鼠长期大量摄入乙醇后, 肝脏维生素A、RA和retinyl palmitate及血浆中RA大幅度降低, 但血浆中retinyl palmitate不受明显影响. 此与Wang et al[9]和Chung et al[10]报道一致. 乙醇干扰retinoids在肝脏的代谢主要有以下3种机制: (1)乙醇是维生素A氧化代谢成RA的一种竞争性抑制剂, 正常情况下乙醇在体内主要由乙醇脱氢酶(ADH)氧化成乙醛接着由乙醛脱氢酶(ALDH)氧化成乙酸排出体外. 维生素A与乙醇共同拥有ADH、ALDH这条代谢途径. 乙醇可竞争性抑制ADH和ALDH, 阻止维生素A氧化为RA[11]. (2)乙醇诱导肝微粒体细胞色素P450 2E1(CYP2E1)表达显著增加, 使维生素A和RA代谢成各种极性产物明显增多[8]. (3)乙醇促进视黄醇酯(维生素A的储存形式)从肝脏转移到肝外组织器官增多[11].
PRMs是一类物质的总称, 包括4-oxo-RA, 18-OH-RA和一些未被确认的产物[7,16]. PRMs在ALD肝损害中所发挥的作用还未被阐明. Dan et al[3]已从细胞水平证实PRMs具有肝细胞毒性. 他们从酒精ig的大鼠肝脏中将PRMs提取出来, 作用于HepG2细胞和大鼠原代肝细胞, 结果证明PRMs以浓度依赖和时间依赖方式通过诱导凋亡导致肝细胞死亡. 本实验结果显示, PRMs在大鼠酒精性肝损伤中明显增高, 给酒精ig大鼠补充ATRA 4 wk后, 2种剂量的ATRA处理组均无PRMs产生. 同时, 150 µg/kg组大鼠肝脏的维生素A、RA和血浆中RA完全恢复到正常对照组水平, 肝脏中retinyl palmitate得到部分恢复; 1.5 mg/kg组大鼠肝脏retinyl palmitate可完全回复至正常水平, 但是维生素A的水平却高于对照组, 此可能与RA反馈抑制维生素A的氧化和促进维生素A酯化有关. 故推测ATRA阻滞PRMs的形成可能是由于ATRA补充可恢复肝脏维生素A代谢平衡, 使维生素A和RA含量正常.
CYP2E1是微粒体呼吸链上的一种氧化酶, 在ALD发病中起非常重要的作用, 长期大量乙醇摄入可以使其含量增加10倍之多[13]. CYP2E1可将许多小分子物质代谢活化成毒性产物, 如将乙醇代谢成具有毒性的乙醛, 并产生氧自由基, 促进脂质过氧化等[15]. 通过CYP2E1, 维生素A和RA被生物转化为PRMs, CYP2E1抑制剂氯美噻唑可以有效阻止PRMs产生[7]. 本试验结果显示, 补充ATRA不能明显降低CYP2E1的表达, 但却能阻止PRMs产生. 此可能是由于CYP2E1的活性受到抑制, 也可能是另有途径阻止PRMs的产生.
本研究证明小剂量ATRA补充可能通过恢复乙醇导致的肝脏维生素A和RA缺乏, 阻止PRMs产生, 从而减轻酒精性肝损伤. 本实验进一步证实了PRMs形成在酒精性肝损害发病中的作用, 但是其具体作用机制以及高剂量ATRA对酒精性肝病的影响还不十分清楚, 有待我们进一步研究.
酒精是世界范围内被广泛滥用的成瘾性物质, 长期大量饮酒可导致酒精性肝病(包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和肝硬化)及一些与酒精相关的疾病(酒精性心脏病, 癌症等). 因此, 探讨这些疾病的病理生理机制和寻求有价值的治疗措施显得尤为重要.
不论在酗酒者还是在动物模型中, 长期大量摄入酒精可导致肝脏维生素A及RA缺乏, 肝脏中PRMs形成及CYP2E1表达增加. RA和CYP2E1在ALD发病中起重要作用, PRMs在ALD肝损害中所发挥的作用还未被阐明. 维生素A缺乏和过量都有肝毒性, 且乙醇可增强维生素A的毒性作用.
本实验使用小剂量ATRA对酒精灌胃大鼠进行干预, 采用HPLC检测大鼠肝脏retinoids含量的变化, 进一步证实了PRMs形成在酒精性肝损害发病中有重要作用, 小剂量ATRA对酒精性肝损害起保护作用.
尽管ALD患者肝脏维生素A及RA含量明显减少, 但补充维生素A常加重酒精性肝损伤, 故临床应用时需谨慎考虑其狭窄的治疗窗. 因此探索RA治疗ALD的最适剂量, 以达到最大治疗效果最小毒性作用具有重要的临床意义.
PRMs: 维生素A类物质极性代谢产物, 是一类物质的总称, 包括4-oxo-RA, 18-OH-RA和一些未被确认的产物. 通过CYP2E1, 维生素A和RA被生物转化为PRMs, PRMs可能是促进酒精性肝损害的毒性物质.
本文结构合理, 方法先进, 分析有据, 图文并茂, 有一定的可读性和科学性.
编辑: 程剑侠 电编:何基才
| 1. | Seitz HK, Stickel F. Molecular mechanisms of alcohol-mediated carcinogenesis. Nat Rev Cancer. 2007;7:599-612. [PubMed] |
| 2. | Liu C, Russell RM, Seitz HK, Wang XD. Ethanol enhances retinoic acid metabolism into polar metabolites in rat liver via induction of cytochrome P4502E1. Gastroenterology. 2001;120:179-189. [PubMed] |
| 3. | Dan Z, Popov Y, Patsenker E, Preimel D, Liu C, Wang XD, Seitz HK, Schuppan D, Stickel F. Hepatotoxicity of alcohol-induced polar retinol metabolites involves apoptosis via loss of mitochondrial membrane potential. FASEB J. 2005;19:845-847. [PubMed] |
| 4. | Chung J, Chavez PR, Russell RM, Wang XD. Retinoic acid inhibits hepatic Jun N-terminal kinase-dependent signaling pathway in ethanol-fed rats. Oncogene. 2002;21:1539-1547. [PubMed] |
| 5. | Howard LA, Micu AL, Sellers EM, Tyndale RF. Low doses of nicotine and ethanol induce CYP2E1 and chlorzoxazone metabolism in rat liver. J Pharmacol Exp Ther. 2001;299:542-550. [PubMed] |
| 6. | Sundaresan PR, Collins TF, Whitby KE, Welsh JJ, Black TN, Shackelford M, Flynn T, Newell RF, O'Donnell MW. Effect of ethanol and vitamin A excess on vitamin A status in the liver, plasma and foetuses of pregnant rats. Food Chem To. xicol. 1994;32:247-254. [PubMed] |
| 7. | Liu C, Chung J, Seitz HK, Russell RM, Wang XD. Chlormethiazole treatment prevents reduced hepatic vitamin A levels in ethanol-fed rats. Alcohol Clin Exp Res. 2002;26:1703-1709. [PubMed] |
| 8. | Leo MA, Lieber CS. Alcohol, vitamin A, and beta-carotene: adverse interactions, including hepatotoxicity and carcinogenicity. Am J Clin Nutr. 1999;69:1071-1085. [PubMed] |
| 9. | Wang XD, Liu C, Chung J, Stickel F, Seitz HK, Russell RM. Chronic alcohol intake reduces retinoic acid concentration and enhances AP-1 (c-Jun and c-Fos) expression in rat liver. Hepatology. 1998;28:744-750. [PubMed] |
| 10. | Chung J, Liu C, Smith DE, Seitz HK, Russell RM, Wang XD. Restoration of retinoic acid concentration suppresses ethanol-enhanced c-Jun expression and hepatocyte proliferation in rat liver. Carcinogenesis. 2001;22:1213-1219. [PubMed] |
| 11. | Wang XD. Chronic alcohol intake interferes with retinoid metabolism and signaling. Nutr Rev. 1999;57:51-59. [PubMed] |
| 12. | Leo MA, Kim C, Lieber CS. Increased vitamin A in esophagus and other extrahepatic tissues after chronic ethanol consumption in the rat. Alcohol Clin Exp Res. 1986;10:487-492. [PubMed] |
| 13. | Lieber CS. Microsomal ethanol-oxidizing system (MEOS): the first 30 years (1968-1998)--a review. AlcoholClin Exp Re. s. 1999;23:991-1007. [PubMed] |
| 14. | Kessova I, Cederbaum AI. CYP2E1: biochemistry, toxicology, regulation and function in ethanol-induced liver injury. Curr Mol Med. 2003;3:509-518. [PubMed] |
| 15. | Mishin VM, Rosman AS, Basu P, Kessova I, Oneta CM, Lieber CS. Chlorzoxazone pharmacokinetics as a marker of hepatic cytochrome P4502E1 in humans. Am J Gastroenterol. 1998;93:2154-2161. [PubMed] |
| 16. | Wang XD, Krinsky NI, Russell RM. Retinoic acid regulates retinol metabolism via feedback inhibition of retinol oxidation and stimulation of retinol esterification in ferret liver. J Nutr. 1993;123:1277-1285. [PubMed] |
| 17. | Shimada T, Ross AC, Muccio DD, Brouillette WJ, Shealy YF. Regulation of hepatic lecithin:retinol acyltransferase activity by retinoic acid receptor-selective retinoids. Arch Biochem Biophys. 1997;344:220-227. [PubMed] |