修回日期: 2007-10-04
接受日期: 2007-10-28
在线出版日期: 2007-10-28
目的: 研究抵抗素(resistin)基因启动子-420C/G多态性与日本高知地区非酒精性脂肪肝炎(Nonalcoholic steatohepatitis, NASH)的相关性.
方法: 应用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)分别检测77例NASH患者和107例正常者resistin基因启动子-420C/G多态性的变异. 酶链免疫测定法测定NASH组患者空腹12 h血清resistin水平等, 同时采用HOMA公式评价胰岛素抵抗指数和分泌指数HOMA-IR和 HOMA-β, 并用糖负荷30 min净增胰岛素/净增葡萄糖ΔI30/ΔG30比值评价早期胰岛素分泌反应及应用CT扫描评估内脏及肝脏脂肪浸润面积.
结果: 在校正年龄、性别等因素之后, Resistin基因启动子-420C/G的多态性分析中发现, NASH患者组的G等位基因频率与正常对照组比较,差异有显著性(0.552 vs 0.407, P<0.01). NASH患者组中GG基因型携带者的resistin血浆含量显著高于其他基因型携带者(27.1±4.7 mg/L vs 16.4±6.2 mg/L, P<0.001), GG基因型组肝纤维化程度更重(2.25±0.68 vs 1.61±0.65, P<0.02)且更易发生糖耐量异常(OR = 3.80, 95%可信区间: 1.14-12.67, P<0.05).
结论: Resistin基因启动子-420位点的G等位基因与NASH发生发展具有显著相关性.
引文著录: 马瑞宏, 黄颖秋, 西元利治. 抵抗素基因启动子-420C/G多态性与日本高知地区非酒精性脂肪肝炎的相关性. 世界华人消化杂志 2007; 15(30): 3204-3209
Revised: October 4, 2007
Accepted: October 28, 2007
Published online: October 28, 2007
AIM: To investigate the relationship between the C/G genotypes of resistin single nucleotide polymorphism (SNP) at -420 and the development and progression of non-alcoholic steatohepatitis (NASH) in the Kochi area of Japan.
METHODS: Polymerase chain reaction (PCR) and restriction fragment length polymorphism (RFLP) were used to determine a common polymorphism of the human resistin gene, -420C > G, in 107 controls and 77 patients with NASH. In patients with NASH, 12-hour fasting serum resistin level was determined by enzyme linked immunosorbent assay (ELISA). CT was used to assess liver visceral fat infiltration.
RESULTS: Homozygotes for -420G of the resistin gene were more frequent in NASH patients than in controls (0.552 vs 0.407, P < 0.01). Resistin level was significantly higher in NASH patients homozygous for -420G of the resistin gene than in those with other genotypes (27.1 ± 4.7 mg/L vs 16.4 ± 6.2 mg/L, P < 0.001). NASH patients homozygous for -420G of the resistin gene were sensitive to the progression not only of impaired glucose tolerance (OR = 3.80; 95% CI, 1.14-12.67; P < 0.05), but also of liver fibrosis (2.25 ± 0.68 vs 1.61 ± 0.65, P < 0.02).
CONCLUSION: The G homozygote of the resistin gene SNP at -420 is associated with NASH in the Kochi area of Japan.
- Citation: Ma RH, Huang YQ, Toshiji S. C/G homozygotes of resistin single nucleotide polymorphism at -420 are associated with non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(30): 3204-3209
- URL: https://www.wjgnet.com/1009-3079/full/v15/i30/3204.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i30.3204
非酒精性脂肪肝炎(NASH)是一种代谢综合症, 常合并内脏性肥胖、血脂紊乱、高血压、糖调节异常和2型糖尿病等多元代谢紊乱[1-2]. 在NASH的发展进程中, 胰岛素抵抗伴随肝细胞脂肪变性被认为是NASH形成的重要影响因素[3-4]. 已有证据显示, 抵抗素(resistin), 也被称作ADSF(adipocyte secreted factor)或FIZZ3(found in inflammatory zone 3), 可能是通过提升肝糖输出, 削弱胰岛素诱导的葡萄糖转运作用而在引发胰岛素抵抗过程中扮演生理学角色[5-7], 有可能是导致内脏性肥胖患者肝脏胰岛素抵抗的一种重要细胞因子[8]. 然而, resistin在代谢类疾病中的确切作用目前还有争议[9-10], 尚待进一步研究. 我们就resistin基因启动子第-420C/G等位基因单核苷酸多态性与NASH疾病相关性作初步探讨.
选取无亲缘关系的日本高知地区共184人, 其中经肝脏活检证实NASH患者组77例, 男38例, 女39例; 年龄44±16岁, BMI: 28.9±4.9, 正常对照组107例, 男53例, 女54例, 年龄42±17, BMI: 22.9±3.3. NASH患者组为高知医大附属医院消化内科门诊及住院患者. PCR扩增仪是美国应用生物系统公司(ABI)生产的GeneAmp PCR System 9700.
1.2.1 DNA的制备: 两组受试者均提取外周静脉血白细胞, 用常规法制备DNA. 方法概括为: 抽取受试者外周静脉血3 mL, 经抗凝处理后, 加入9 mL红细胞溶血剂, 红细胞充分溶解后, 再加入2 mL白细胞溶解剂, 隔夜后, 将667 µL的蛋白质沉淀剂加入上述未出现沉淀等异常现象的溶液内, 离心后取上清液, 加入2-丙醇(2-propanol)2 mL, 振荡至液体澄清, 可见白色絮状物出现, 即为DNA.
1.2.2 肝脏穿刺活组织切片检查: 肝活组织检查是在全面临床检查评估后并征得NASH患者同意进行的. 肝活检组织用40 g/L甲醛固定(pH7.4), 经石蜡包埋, 切片用苏木精、伊红染色. 经处理后的活组织切片由病理学者H.E.分析并依据Brunt对NASH病理改变的建议确定病理分期[1](表1). 依据Chevallier半定量评分系统[11], 分别对肝脏炎症程度及纤维化进行评分. NASH患者组筛选过程中, 已知使用过甲氨蝶呤、他莫昔芬、肾上腺皮质类固醇、胰岛素的NASH患者, 每日饮酒量超过20 g的脂肪肝患者和患有其他肝脏疾病的患者(病毒性肝炎、血色沉着病、Wilson病和自身免疫性肝病)均被排除在外.
| 级(G) | 炎症活动度 | 期(S) | 纤维化程度 | |
| 汇管区及周围 | 小叶内 | 纤维化程度 | ||
| 0 | 无炎症 | 无炎症 | 0 | 无 |
| 1 | 汇管区炎症 | 变性及少数点状坏死 | 1 | 肝腺泡Ⅲ区静脉旁, 肝窦周围和肝细胞周围纤维化, 灶性或泛在 |
| 2 | 轻度PN | 变性, 点, 灶状坏死或嗜酸性小体 | 2 | 同1, 伴灶性或泛在的汇管区纤维化 |
| 3 | 中度PN | 融合坏死或见BN | 3 | 桥接纤维化, 灶性或泛 |
| 4 | 重度PN | BN广泛, 累及多个小叶(多小叶坏死) | 4 | 在肝硬化 |
1.2.3 血液实验室检查: 对77例NASH患者进行空腹12 h临床血指标检查, 包括应用酶链免疫测定法测定血清resistin水平(Fermentas, Burlington Canada), 同时用全自动生化仪测定血清白蛋白、血清丙氨酸转氨酶(ALT)、血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)值, 空腹血糖(FPG, 葡萄糖氧化酶法)、空腹胰岛素(FINS, 胰岛素放射免疫试剂盒Fermentas, Burlington Canada, 放射免疫分析法)、糖化血红蛋白(HbA1C, 高效液相法DCA2000+, Bayer Germany)和脱水山梨糖醇1.5-AG浓度(气相层析法, shimadzu, GC-9A). 测量身高、体质量、腰围及血压, 并计算出体质量指数 (BMI = 体质量kg身高的平方m2). 采用稳态模式评估法(HOMA公式)评价胰岛素抵抗指数(HOMA-IR)和胰岛素分泌指数(HOMA-β), 并用糖负荷30 min净增胰岛素/净增葡萄糖(ΔI30/ΔG30)比值评价早期胰岛素分泌反应(insulinogenic index), 各参数计算公式如下: HOMA-IR = FPG×FINS/22.5; HOMA-β = 20×FINS /(FPG-3.5); OGTT胰岛素曲线下面积 = (S 0+S 180)+(S 30+S 60+S 120)/2, 其中S 0, S 30, S 60, S 120, S 180分别代表 0, 30, 60, 120, 180 min所测的胰岛素数值.
1.2.4 CT扫描: NASH患者组CT扫描使用螺旋CT(ProSeed, General Electric Yokogawa Medical Systems, Tokyo, Japan), 厚度和间隔均以10 mm为单位, 避开血管和同源区域伪影. 肝脏CT平均值依据左右叶实质的平均值得出, 在脾脏相似区域用同样方法得出平均值, 进而计算出L/S值. L/S = 0.9与肝脏脂肪浸润面积达30%相对应, 作为区分易发NASH分界指标, 用于肝脏脂肪沉积的半定量评价[12]. 77例患者内脏脂肪(VF)和皮下脂肪(SF)含量的测定选择平脐周部位, 采用FatScan系统(N2 System, Japan)扫描.
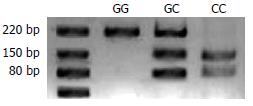
1.2.5 Resistin基因启动区第-420位点基因型的测定: 利用已制备的两组受试者的DNA, 应用PCR扩增包括resistin基因启动子第-420位点等位基因在内的219 bp长度片段.从GenBank(AF323081)中查取人抵抗素基因序列(略), 使用primer Primier 5.0 Demo软件进行在线引物设定. 引物序列为: 上游引物5'CTGCTTGTCTACCTGTTCCTC3, 下游引物为5'GGGCTTCCTGTCTTGGCTAATAA3', 由日本北海道sequence株式会社合成及纯化. PCR反应体系含Taq PCR mixture15 µL(QIAGEN Taq PCR core kit试剂盒), 上游引物600 pmol, 下游引物600 pmol, 模板DNA<1 µg, 加超纯水至30 µL. PCR扩增循环: 94℃预变性5 min, 94℃ 30 s, 58℃ 30 s, 72℃ 1 min 30 s, 72℃延伸7 min, 4℃终止, 37个循环. 取PCR扩增产物3 µL, 40 g/L琼脂糖凝胶电泳15 min, 电压100 V, Kodak电泳图像分析系统EDAS290比较PCR扩增产物, 并根据marker条带位置确定PCR扩增产物是否为目的基因片段. 另取PCR扩增产物3 µL, 混入0.5 µL 10×BufferG, 0.5 µL限制性内切酶BpiⅠ(BbvⅡ, Fermentas, Burlington, Canada), 4 µL超纯水, 对PCR扩增产物进行酶切, 条件是37℃ 12 h. 酶切产物经40 g/L琼脂糖凝胶电泳20 min, 电压100 V, 用Kodak电泳图像分析系统观察带型并拍照.
统计学处理 应用SPSS10.0软件包, 文中有关变量用mean±SD表示. HOMA-IR经对数转换后进行分析, 相对危险度和相关分析采用软件包中的比值比(odds ratio, OR)和Chi-Square检验. P<0.05具有显著差异性.
2组受试者均可检测到预计的219 bp片段, 且均符合Hardy-Weinberg平衡检验及卡方Chi-Square检验(P>0.05). 限制性内切酶BpiⅠ(BbvⅡ)对resistin基因PCR扩增产物(图1)酶切后存在三种基因型(图2): GG(缺乏BpiI酶切位点, 仅见与扩增产物一样的219 bp片段)、GC(可见219 bp片段, 131 bp片段和88 bp片段)、CC(可见131 bp片段和88 bp片段). NASH患者组与正常对照组相比, G等位基因频率有显著差异性(55.2% vs 40.7%, P<0.01, OR = 1.80). NASH患者组的GG基因型频率要显著高于正常对照组(36.3% vs 18.7%, P<0.01, OR = 2.49)(表2).
依据resistin基因PCR扩增产物酶切后3种基因型, 将NASH患者分为GG组、GC组和CC组, 3组基因型临床资料数据见表3.
| 基因型 | G/G | C/G | C/C | P |
| 年龄 | 44.9±16.9 | 49.7±15.2 | 35.2±16.2 | N.S. |
| 性别(M/F) | 15/13 | 13/16 | 11/9 | N.S. |
| 腰围(cm) | 90.7±16.0 | 81.4±5.0 | 99.1±10.6 | N.S. |
| BMI | 30.0±5.0 | 27.0±3.2 | 30.1±5.8 | N.S. |
| 收缩压(mmHg) | 132.8±12.7 | 124.0±16.8 | 138.3±16.4 | N.S. |
| 舒张压(mmHg) | 80.3±11.8 | 73.9±9.8 | 81.5±10.4 | N.S. |
| ALT(IU/L) | 92.9±61.0 | 76.1±38.5 | 111.9±53.9 | N.S. |
| 白蛋白Albumin(g/L) | 44±3 | 46±3 | 46±3 | N.S. |
| TG(mg/dL) | 168.1±104.4 | 179.5±110.6 | 136.8±61.0 | N.S. |
| TC(mg/dL) | 201.6±37.1 | 208.9±56.1 | 175.6±35.7 | N.S. |
| HDL-Chol(mg/dL) | 47.1±14.2 | 47.6±15.1 | 41.8±10.5 | N.S. |
| Resistin(mg/L) | 27.1±4.7M | 18.7±5.7 | 13.4±5.5 | <0.001 |
| 糖耐量正常(NGT)/糖耐量减低(IGT)/2型糖尿病(DM) | 4/14/10M | 11/11/7 | 8/6/6 | <0.05 |
| HbA1c (%) | 5.6±0.8 | 5.8±1.3 | 5.8±1.9 | N.S. |
| 脱水山梨糖醇1.5-AG(mg/L) | 15.5±10.6M | 19.1±9.3 | 24.2±8.9 | <0.02 |
| 空腹血糖FPG(mg/dL) | 114.6±35.5 | 100.7±14.4 | 104.4±16.2 | N.S. |
| 空腹胰岛素FINS(mU/L) | 13.4±10.5 | 9.9±8.7 | 13.0±9.6 | N.S. |
| HOMA-IR | 3.27±2.83 | 3.00±2.71 | 3.25±2.33 | N.S. |
| HOMA-β(%) | 111.8±99.3 | 96.3±76.1 | 136.8±107.4 | N.S. |
| Insulinogenic index | 0.62±0.54 | 0.75±0.55 | 1.94±1.78N | <0.02 |
| 胰岛素曲线下面积AUCinslin[mIU/(h•L)]肝脏组织学检查 | 231.8±128.5 | 213.2±127.1 | 379.8±257.9N | <0.01 |
| 纤维化分期 | 2.25±1.14M | 1.63±0.84 | 1.59±0.89 | <0.02 |
| 脂肪肝炎活动度 | 1.77±0.62 | 1.91±0.42 | 1.81±0.78 | N.S. |
| 肝脏脂肪浸润面积(%)CT | 43.8±21.3M | 60.7±19.7 | 67.5±23.2 | <0.001 |
| L/S比值 | 0.69±0.31 | 0.72±0.27 | 0.70±0.26 | N.S. |
| 内脏脂肪面积(cm2) | 174.5±55.5 | 141.8±46.6 | 212.4±55.7N | <0.001 |
2.2.1 GG组有显著统计学意义的临床特征性指标: (1)血清resistin水平明显高于其他两组(27.1±4.7 µg/L vs 18.7±5.7 µg/L, 13.4±5.5 µg/L, P<0.001); (2)合并IGT和DM患者的数量要多于其他两组(OR = 3.80, 95%可信区间: 1.14-12.67), 而血液脱水山梨糖醇1.5-AG水平低于其他两组(15.5±10.6 µg/L vs 19.1±9.3 µg/L, 24.2±8.9 µg/L, P<0.02), 这反映GG组血糖水平高于其他两组, 二者情况相一致; (3)尽管肝脏脂肪浸润面积要少于其他两组(43.8±21.3 vs 60.7±19.7, 67.5±23.2, P<0.001), 肝纤维化进展迅速于其他两组(2.25±1.14 vs 1.63±0.84, 1.59±0.89, P<0.02).
2.2.2 CC组有显著统计学意义的临床特征性指标: (1)po糖耐量实验过程中的胰岛素AUC要明显大于其他2组(P<0.01), 提示CC组糖负荷后胰岛素反应能力强于其他组, 这也可以解释经CT检测的内脏脂肪浸润面积要明显大于其他2组(212.4±55.7 cm2 vs 174.5±55.5 cm2, 141.8±46.6 cm2, P<0.001); (2)早期胰岛素分泌反应insulinogenic index显著高于其他2组(1.94±1.78 vs 0.62±0.54, 0.75±0.55, P<0.02).GG基因组的HOMA-IR, BMI与其他两组基因型相比较并无显著统计学差异.
Resistin是由脂肪组织分泌, 属于富含半胱氨酸的分泌型抵抗素样蛋白质分子家族中的一员, 由于其有可能在肥胖和IR之间起潜在的连结作用, 故近来备受关注[1,13-15]. 现今, IR和高胰岛素血症通过降低肝脏血糖输出及甘油三酯转运障碍而引起内脏性肥胖等机制, 参与NASH的发病已被广为接受[3,16-20]. 基于以上观点, 越来越多的研究集中于从生物学作用和基因水平方面来探讨resistin在IR中所扮演的角色[21-26], 但其中也有研究表示resistin的表达与IR和(或)中心性肥胖并无关联[9,27-29]. 鉴于resistin生物学特性与NASH的发病机制及发病进程有许多待证实的交叉点, 而以往研究多从试验动物着手[30-31], 我们试图从临床患者方面, 对resistin基因启动子-420C/G多态性与NASH相关性进行研究. 研究显示, NASH患者组中resistin基因启动子-420G等位基因的出现频率要远高于正常对照组. NASH患者组中, 与其他基因型相比, GG基因型携带者的resistin血浆含量更高, 更易发生糖耐量异常, 纤维化程度更重; 而CC组则保有比较高的胰岛素分泌能力. 但在我们的研究中, GG基因组的HOMA-IR与其他两组基因型相比较并无显著统计学差异. 在这三组患者中其他临床数据没有提示有价值的信息.
基因表现型是遗传和环境互应的结果, 对外界环境因素的忽略有可能降低研究的力度. 此外, 研究样本人数偏少及研究条件的差异, 都有可能限制研究的结果. 在NASH的发病机制及发展进程中, resistin所起的作用需要更进一步的研究探讨.
NASH是一种全球性疾病, 常与肥胖、2型糖尿病、脂类代谢异常等多种代谢综合症集结出现, 近年来患病率有明显增高趋势. Resistin是Steppan et al在研究一类治疗糖尿病新药-噻唑烷二酮类药物作用机制时发现的, 被认为可能使胰岛素作用通路障碍而引发IR. 目前resistin的生物学作用还不十分明确, 存在很多争议.
目前更多的研究集中于从生物学作用和基因水平方面来探讨resistin在IR中所扮演的角色, 这为NASH的发病机制提供了新的研究途径, 从而为NASH的治疗带来新的希望.
鉴于resistin生物学特性与NASH的发病机制及发病进程有许多待证实的交叉点, 而以往研究多从试验动物着手, 本文从临床患者方面研究发现resistin基因启动子-420位点的G等位基因与NASH发生发展具有显著相关性.
本文就resistin基因启动子第-420C/G等位基因单核苷酸多态性与NASH疾病相关性做初步探讨, 希望为NASH发病机制的研究提供新的思路.
胰岛素抵抗(IR): 是指外周靶组织对内/外源性胰岛素的敏感性和反应性降低, 他是代谢综合症赖以生存的基础.随着IR在代谢综合症中的作用进一步证实, 认为IR在NASH病变过程中也扮演着重要角色, 引起了各国学者越来越浓厚的兴趣.
本文选题新颖, 观察指标较系统, 结论明确, 具有很强的学术价值和临床研究意义.
编辑: 李军亮 电编:马文华
| 1. | Brunt EM. Nonalcoholic steatohepatitis. Semin Liver Dis. 2004;24:3-20. [PubMed] |
| 2. | Ratziu V, Tahiri M, Bonyhay L. Nonalcoholic steatohepatitis. Ann Endocrinol (Paris). 2005;66:1S71-80. [PubMed] |
| 3. | Choudhury J, Sanyal AJ. Insulin resistance in NASH. Front Biosci. 2005;10:1520-1533. [PubMed] |
| 4. | Palasciano G, Moschetta A, Palmieri VO, Grattagliano I, Iacobellis G, Portincasa P. Non-alco-holic fatty liver disease in the metabolic syndrome. Curr Pharm Des. 2007;13:2193-2198. [PubMed] |
| 5. | Steppan CM, Bailey ST, Bhat S, Brown EJ, Banerjee RR, Wright CM, Patel HR, Ahima RS, Lazar MA. The hormone resistin links obesity to diabetes. Nature. 2001;409:307-312. [PubMed] |
| 6. | Banerjee RR, Rangwala SM, Shapiro JS, Rich AS, Rhoades B, Qi Y, Wang J, Rajala MW, Pocai A, Scherer PE. Regulation of fasted blood glucose by resistin. Science. 2004;303:1195-1198. [PubMed] |
| 7. | Steppan CM, Lazar MA. The current biology of resistin. J Intern Med. 2004;255:439-447. [PubMed] |
| 8. | Muse ED, Obici S, Bhanot S, Monia BP, McKay RA, Rajala MW, Scherer PE, Rossetti L. Role of resistin in diet-induced hepatic insulin resistance. J Clin Invest. 2004;114:232-239. [PubMed] |
| 9. | Vozarova de Courten B, Degawa-Yamauchi M, Considine RV, Tataranni PA. High serum resistin is associated with an increase in adiposity but not a worsening of insulin resistance in Pima Indians. Diabetes. 2004;53:1279-1284. [PubMed] |
| 10. | Rajala MW, Obici S, Scherer PE, Rossetti L. Adipose-derived resistin and gut-derived resistin-like molecule-beta selectively impair insulin action on glucose production. J Clin Invest. 2003;111:225-230. [PubMed] |
| 11. | Chevallier M, Guerret S, Chossegros P, Gerard F, Grimaud JA. A histological semiquantitative scoring system for evaluation of hepatic fibrosis in needle liver biopsy specimens: comparison with morphometric studies. Hepatology. 1994;20:349-355. [PubMed] |
| 12. | Ludwig J, McGill DB, Lindor KD. Review: nonalcoholic steatohepatitis. J Gastroenterol Hepatol. 1997;12:398-403. [PubMed] |
| 13. | Lesniowski B, Kumor A, Jasinska A, Daniel P, Pietruczuk M, Malecka-Panas E. Is resistin may be a new laboratory marker in diagnosis acute pancreatitis? Pol Merkur Lekarski. 2007;22:385-387. [PubMed] |
| 14. | Norata GD, Ongari M, Garlaschelli K, Tibolla G, Grigore L, Raselli S, Vettoretti S, Baragetti I, Noto D, Cefalu AB. Effect of the -420C/G variant of the resistin gene promoter on metabolic syndrome, obesity, myocardial infarction and kidney dysfunction. J Intern Med. 2007;262:104-112. [PubMed] |
| 15. | Wentworth JM, Harrison LC. Does insulin resistance need resistin? J Clin Endocrinol Metab. 2007;92:2036-2037. [PubMed] |
| 16. | Wiegand J, Mossner J, Tillmann HL. Non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Internist (Berl). 2007;48:154-163. [PubMed] |
| 17. | Roberts EA. Non-alcoholic steatohepatitis in children. Clin Liver Dis. 2007;11:155-172, x. [PubMed] |
| 18. | Chitturi S, Abeygunasekera S, Farrell GC, Holmes-Walker J, Hui JM, Fung C, Karim R, Lin R, Samarasinghe D, Liddle C. NASH and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology. 2002;35:373-379. [PubMed] |
| 19. | Wang H, Chu WS, Hemphill C, Elbein SC. Human resistin gene: molecular scanning and evaluation of association with insulin sensitivity and type 2 diabetes in Caucasians. J Clin Endocrinol Metab. 2002;87:2520-2524. [PubMed] |
| 20. | Verma S, Li SH, Wang CH, Fedak PW, Li RK, Weisel RD, Mickle DA. Resistin promotes endothelial cell activation: further evidence of adipokine-endothelial interaction. Circulation. 2003;108:736-740. [PubMed] |
| 21. | Juan CC, Au LC, Fang VS, Kang SF, Ko YH, Kuo SF, Hsu YP, Kwok CF, Ho LT. Suppressed gene expression of adipocyte resistin in an insulin-resistant rat model probably by elevated free fatty acids. Biochem Biophys Res Commun. 2001;289:1328-1333. [PubMed] |
| 22. | Ma X, Warram JH, Trischitta V, Doria A. Genetic variants at the resistin locus and risk of type 2 diabetes in Caucasians. J Clin Endocrinol Metab. 2002;87:4407-4410. [PubMed] |
| 23. | Baranova A, Liotta L, Petricoin E, Younossi ZM. The role of genomics and proteomics: technologies in studying non-alcoholic fatty liver disease. Clin Liver Dis. 2007;11:209-220, xi. [PubMed] |
| 24. | Baranova A, Gowder SJ, Schlauch K, Elariny H, Collantes R, Afendy A, Ong JP, Goodman Z, Chandhoke V, Younossi ZM. Gene expression of leptin, resistin, and adiponectin in the white adipose tissue of obese patients with non-alcoholic fatty liver disease and insulin resistance. Obes Surg. 2006;16:1118-1125. [PubMed] |
| 25. | de Oliveira CP, Stefano JT, de Lima VM, de Sa SV, Simplicio FI, de Mello ES, Correa-Giannella ML, Alves VA, Laurindo FR, de Oliveira MG. Hepatic gene expression profile associated with non-alcoholic steatohepatitis protection by S-nitroso-N-acetylcysteine in ob/ob mice. J Hepatol. 2006;45:725-733. [PubMed] |
| 26. | Day CP. The potential role of genes in nonalcoholic fatty liver disease. Clin Liver Dis. 2004;8:673-691, xi. [PubMed] |
| 27. | McTernan CL, McTernan PG, Harte AL, Levick PL, Barnett AH, Kumar S. Resistin, central obesity, and type 2 diabetes. Lancet. 2002;359:46-47. [PubMed] |
| 28. | Nagaev I, Smith U. Insulin resistance and type 2 diabetes are not related to resistin expression in human fat cells or skeletal muscle. Biochem Biophys Res Commun. 2001;285:561-564. [PubMed] |
| 29. | Engert JC, Vohl MC, Williams SM, Lepage P, Loredo-Osti JC, Faith J, Dore C, Renaud Y, Burtt NP, Villeneuve A. 5' flanking variants of resistin are associated with obesity. Diabetes. 2002;51:1629-1634. [PubMed] |
| 30. | Maebuchi M, Machidori M, Urade R, Ogawa T, Moriyama T. Low resistin levels in adipose tissues and serum in high-fat fed mice and genetically obese mice: development of an ELISA system for quantification of resistin. Arch Biochem Biophys. 2003;416:164-170. [PubMed] |