修回日期: 2006-11-01
接受日期: 2006-11-11
在线出版日期: 2007-01-28
目的: 探讨CD24在大肠癌中的表达及其与细胞增殖、血管生成的关系.
方法: 运用流式细胞术直接免疫荧光法检测66例大肠癌肿瘤组织及相应正常大肠黏膜CD24的表达量. CD24蛋白表达量以阳性率(PPC)和平均荧光强度MFI值表示. 运用免疫组织化学法检测肿瘤组织CD34, PCNA的表达情况, 根据CD34的染色情况计算出大肠癌组织的微血管密度(microvessel density), 根据PCNA染色情况计算出肿瘤细PCNA标记指数.
结果: 大肠癌肿瘤组织CD24阳性率90.40% (75.10%-96.35%)明显高于相应的癌旁组织36.15%(32.00%-53.28%)(χ2 = 6.877, P<0.001). 大肠癌肿瘤组织CD24蛋白MFI值18.10(11.45-25.43), 明显高于正常黏膜组织8.41(5.59-10.33)(χ2 = 6.934, P<0.001). 浸润型、高Dukes分期、高pTNM分期及有淋巴结转移的癌组织中CD24蛋白的平均荧光强度显著高于对应组(P<0.05). 浸润型、低分化、高Dukes分期、高pTNM分期及有淋巴结转移的癌组织中CD24蛋白阳性百分率显著高于对应组(P<0.05). 在CD24阳性表达病例中, PCNA的表达随着CD24表达强度的升高而升高(P<0.05). 大肠腺癌肿瘤细胞CD24阳性表达率与MVD呈正相关(r = 0.243, P = 0.050). 而CD24蛋白平均荧光强度与MVD未见明显相关(r = 0.115, P = 0.358).
结论: CD24在大肠腺癌中表达水平明显上调, 并与肿瘤细胞增殖、血管生成密切相关.
引文著录: 庄建良, 苏子剑, 潘群雄, 许荣誉, 李明珠. 大肠癌CD24的表达及其与肿瘤细胞增殖和血管形成的关系. 世界华人消化杂志 2007; 15(3): 260-265
Revised: November 1, 2006
Accepted: November 11, 2006
Published online: January 28, 2007
AIM: To investigate the expression of CD24 and its role in the angiogenesis and tumor cell proliferation in colorectal carcinoma.
METHODS: Direct immunofluorescence flow cytometry (FCM) was used to detect the expression of CD24 in 66 specimens of colorectal carcinoma and normal colorectal tissues. The expression of CD24 protein was shown by the percentage of positive cells (PPC) and mean fluorescence index (MFI). The expression of CD34 and proliferating cell nuclear antigen (PCNA) in colorectal carcinoma were detected by immunohistochemistry. Microvessel density (MVD) was figured out according to the positive staining for CD34. The proliferation index of carcinoma cells was figured out according to the expression of PCNA.
RESULTS: The values of PPC and MFI were significantly higher in colorectal carcinoma tissue than that in the normal colorectal tissue (PPC: 90.40% vs 36.15%, χ2 = 6.877, P < 0.001; MFI: 18.10 vs 8.41, χ2 = 6.934, P < 0.001). The values of MFI and PPC were significantly correlated with tumor stages (Dukes and pTNM), lymph noda metastasis and infiltration types (P < 0.05). The expression of PCNA was increased with the up-regulation of CD24 expression in CD24-positive cases (P < 0.05). There was a significant correlation between the positive rate of CD24 expression and the value of MVD in colorectal carcinoma (r = 0.243, P = 0.050). But the value of MFI had no marked correlation with that of MVD in colorectal carcinoma (r = 0.115, P = 0.358).
CONCLUSION: CD24 expression is obviously up-regulated in colorectal carcinoma, and it is correlated with the angiogenesis of tumor tissues and proliferation of tumor cells.
- Citation: Zhuang JL, Su ZJ, Pan QX, Xu RY, Li MZ. Expression of CD24 and its relationship with angiogenesis and tumor cell proliferation in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 260-265
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/260.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.260
大肠癌是我国常见恶性肿瘤之一, 占全部癌症的6.8%, 大肠癌死亡率为3.54/10万, 占癌症死亡率的5.29%, 居第6位. 引起患者死亡的主要原因是肿瘤的侵袭与转移. 介导细胞黏附作用的细胞表面黏附分子在肿瘤浸润和转移中具有重要的地位. CD24是一种低分子质量高度糖基化的黏附分子, 主要表达在造血系统. 最近研究表明, 在造血系统肿瘤和一些器官的实体瘤表面可见CD24高表达. 有资料显示CD24在前列腺癌[1-2]、非小细胞肺癌[3]、鼻咽癌、原发性肝细胞癌[4]、胆管细胞癌[5]、麦克尔细胞癌[6]、神经源性肿瘤[7]、胰腺癌[8]、胃癌[9]、结肠癌[10]、肾细胞癌[11]、B细胞淋巴瘤[12]、乳腺癌[13-14]等肿瘤组织中表达增强, 且和肿瘤侵袭转移、复发和预后密切相关. 但对CD24在大肠癌侵袭转移中的作用, 特别是CD24与肿瘤性血管生成的关系尚未阐明[15]. 本研究拟用直接免疫荧光法流式细胞术检测66例原发性大肠癌肿瘤组织中CD24的表达量, 运用免疫组织化学法检测肿瘤组织CD34, PCNA的表达情况, 分析他们的相互情况, 探讨CD24与大肠癌侵袭转移、肿瘤细胞增殖和肿瘤性血管生成的关系.
泉州市第一医院2006-03/09大肠癌手术切除新鲜标本66例, 所有患者术前未经放疗和化疗, 所有病例均经切片病理确诊. 全部病例按WHO肿瘤分类标准(大肠癌)进行组织学分型, 区域淋巴结转移分站及TNM分期. 其中男37例, 女29例; 小于60岁25例, 大于60岁41例, 病理分型: 低分化癌25例, 中分化癌31例, 高分化癌10例; 大肠癌标本中浸透浆膜者47例, 未浸透浆膜者19例; 有淋巴结转移者29例; Dukes分期: A期18例, B期18例, C+D期30例. pTNM分期:Ⅰ期14例, Ⅱ期21例, Ⅲ期20例, Ⅳ期11例.
流式细胞术标本包括肿瘤部位和肿瘤边缘5 cm以上的相应癌旁肠黏膜, 标本离体半小时内新鲜取材. 另取对应癌组织, 经40 g/L中性甲醛固定, 24 h内取材, 常规石蜡包埋, 4 μm厚度连续切片.
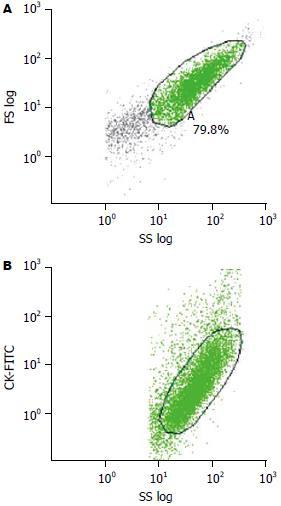
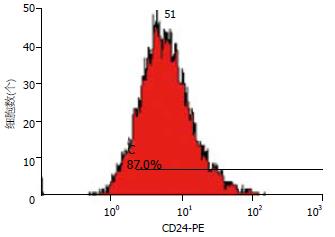
1.2.1 流式细胞术: 离体半小时内选取大肠癌组织及距离癌组织约5 cm以上的正常大肠黏膜(经病理证实无癌组织残留)各1份, 眼科剪刀剪碎组织, 去除坏死组织和血块, 将剪碎组织置组织细胞分离器(DAKO Medimachine)中制备单细胞悬液, 500目尼龙网过滤, 将收集的细胞悬液离心(800 r/min)5 min×3次, 弃上清液、沉淀, 用2 mL的PBS漂洗, 再以1500 r/min离心5 min, 弃上清液, PBS调整细胞数每管为1×106个细胞. 鼠抗人CK-FITC mAb一抗工作液购自Dako cytomation(Clone: MNF116). 鼠抗人CD24-PE mAb一抗工作液购自Caltag Laboratories(Clone: SN3). 每管中加入20 μL鼠抗人CK-FITC mAb一抗工作液标记上皮细胞(正常黏膜管)和肿瘤细胞(肿瘤管), 并加入20 μL特异的鼠抗人CD24-PE mAb一抗工作液, 另一管中加入阴性对照, 以20 μL的IgG异硫氰酸荧光素(FITC)与细胞悬液反应. 避光室温反应30 min. 所用流式细胞仪为(FACSsort型流式细胞仪). 用荧光微球校准流式细胞仪之后, 通过前向角散射(FSC)和侧向角散射(SSC)双参数, 建立FS(log)/SS(log)双参数直方图, 以矩形框和对角框选取有关细胞细胞群(尽量去除细胞碎片及细胞集团)建立二维点图(图1A). 以CK-FITC为纵坐标, SS(log)为横坐标, 建立双参数直方图, 圈定CK阳性的细胞群(图1B). 再建立FL2-CD24 PE单参数直方图检查CK阳性的上皮细胞/肿瘤细胞CD24的表达强度(图2). 依次测定每例标本中阳性细胞百分率(percentage of positive cell, PPC)和平均荧光强度值(mean fluorescence intensity, MFI).
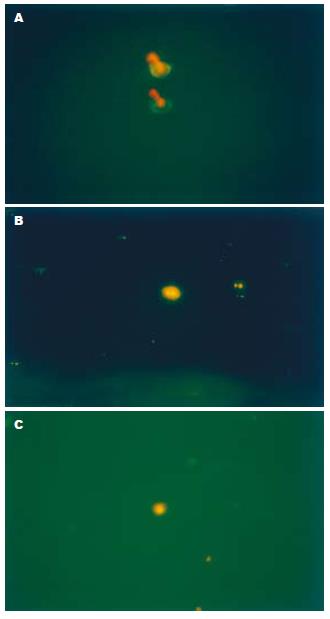
1.2.2 免疫荧光染色: 避光室温反应后, 取少量细胞悬液滴于波片上, 置于荧光显微镜下(Olympus: BX-60-32FB2-A03)观察.
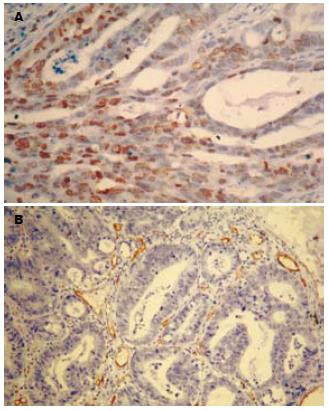
1.2.3 免疫组织化学染色: CD34 mAb(克隆号: QBEnd/10)、PCNA mAb(克隆号: PC10)购自福州迈新科技有限公司, 操作严格按照说明书进行. 用已知阳性片作阳性对照. 同时用PBS代替第一抗体作阴性对照. PCNA免疫组化结果以细胞核出现棕黄色颗粒细胞为阳性细胞. 随机选取5个高倍视野(×400)计数阳性细胞百分率. 依阳性细胞百分率判定阳性强度. 阳性细胞数≤25%为"+", 26%-50%为"++", ≥51%为"+++". CD34阳性染色定位于血管内皮细胞, 呈棕黄色. 大肠癌组织内孤立的棕黄色血管内皮细胞或细胞簇代表一条单独的微血管. 在10倍物镜下挑选微血管分布最高的区域, 再在高倍(×200)镜下计数被染成棕黄色的血管数目. 结果用3个200倍视野下的血管数目的平均数来表示. 取其平均值作为微血管密度. 分辨不清或染色模糊的细胞不计入结果.
统计学处理 正态性检验应用KS检验法(Kolmogorov-Smirnov); 方差齐性时数据用mean±SD表示, 组间比较用单因素方差分析, 组间两两比较用S-N-Q检验, 非正态性分布或方差不齐时数据用中位数(四分位数间距)[M(QR)]表示, 采用秩和检验, 组间两两比较用Nemenyi法检验. 相关分析采用双变量Pearson相关分析. 检验水准α = 0.05. 皆用SPSS12.0和Excell软件处理.
在免疫荧光显微镜下, 可见CK-FITC阳性CD24-PE阴性的肿瘤细胞发出绿色荧光(图3A); CD24-PE阳性CK-FITC阴性的非上皮细胞发出橘红色的荧光(图3A); CD24阳性的肿瘤细胞呈CK-FITC, CD24-PE双染色, 发出绿色和橘红色双色荧光(图3B-C). 染色部位均位于细胞膜.
66例大肠癌肿瘤组织CD24蛋白阳性表达率为90.40%(75.10%-96.35%), 明显高于相应的癌旁组织36.15%(32.00%-53.28%), χ2 = 6.877, P<0.001. 66例大肠癌肿瘤组织CD24蛋白MFI值18.10(11.45-25.43), 明显高于正常黏膜组织8.41(5.59-10.33), χ2 = 6.934, P<0.001. 浸润型、高Dukes分期、高pTNM分期及有淋巴结转移的癌组织中CD24蛋白的平均荧光强度显著高于对应组(P<0.05). 浸润型、低分化、高Dukes分期、高pTNM分期及有淋巴结转移的癌组织中CD24蛋白阳性百分率显著高于对应组(P<0.05), 而与大肠癌患者的性别、年龄、浸润深度无关(表1).
| 项目 | n | 肿瘤组织CD24染色 | |
| MFI | 阳性细胞率(%) | ||
| 性别 | |||
| 男性 | 37 | 18.30(13.6-31.3) | 91.00(80.95-97.20) |
| 女性 | 29 | 15.20(10.0-21.9) | 88.60(51.40-95.90) |
| 年龄 | |||
| <60岁 | 25 | 15.30(10.55-20.82) | 88.60(47.65-95.15) |
| >60岁 | 41 | 18.30(12.05-31.10) | 92.30(77.90-97.15) |
| 大体分型 | |||
| 肿块型 | 26 | 17.31(11.18-23.58) | 89.50(51.95-96.63) |
| 溃疡型 | 30 | 15.20(10.15-24.38) | 87.95(73.70-92.55) |
| 浸润型 | 10 | 26.05(18.40-36.58)ad | 96.35(94.48-98.35)f |
| 组织学分级 | |||
| 高分化 | 10 | 13.70(10.15-15.53) | 77.55(48.90-89.00) |
| 中分化 | 31 | 18.10(10.00-28.20) | 91.90(65.20-96.50) |
| 低分化 | 25 | 18.50(15.10-31.10) | 92.70(80.45-97.15)j |
| Dukes分期 | |||
| A期 | 18 | 12.05(9.21-19.68) | 78.05(67.50-92.05) |
| B期 | 18 | 15.10(10.88-18.20) | 86.05(43.86-92.93) |
| C+D期 | 30 | 23.10(17.95-36.13)j | 95.35(89.70-97.43)j |
| TNM分期 | |||
| Ⅰ期 | 14 | 13.50(9.89-25.60) | 86.90(75.18-94.18) |
| Ⅱ期 | 21 | 15.10(10.50-18.10)k | 75.10(42.65-92.60)n |
| Ⅲ期 | 20 | 18.52(13.50-35.43) | 92.40(88.73-96.43) |
| Ⅳ期 | 11 | 23.20(18.10-39.80)or | 97.10(88.70-98.30) |
| 浸润深度 | |||
| pT1 | 5 | 12.30(6.50-19.50) | 75.10(73.30-86.90) |
| pT2 | 7 | 11.80(10.00-35.10) | 80.00(75.20-99.00) |
| pT3 | 7 | 15.10(8.20-24.50) | 91.00(50.20-92.70) |
| pT4 | 47 | 18.30(14.60-30.50) | 92.30(77.40-97.00) |
| 淋巴结转移 | |||
| pN0 | 37 | 15.10(10.10-18.40) | 83.50(58.85-92.70) |
| pN1 | 16 | 18.40(13.50-23.65) | 88.85(77.65-92.45) |
| pN2 | 13 | 35.10(20.80-42.50)sv | 97.20(95.75-99.55)x |
大肠癌CD24蛋白平均荧光强度和阳性细胞百分率与大肠癌细胞增殖指数显著相关(P<0.05), 并且随着CD24蛋白表达水平的增强, 细胞增殖指数也随之升高, 两者呈正相关关系(图4, 表2).
66例大肠癌MVD在200倍视野的均数为47.55±7.86. 随着CD24阳性细胞率的增强, MVD也升高, 两者呈正相关(r = 0.243, P = 0.05). 而CD24蛋白平均荧光强度与MVD未见明显相关(r = 0.115, P = 0.358).
CD24是一种低分子质量高度糖基化的黏附分子, 由27个氨基酸组成, 通过糖基磷脂酰肌醇黏附在细胞膜上[16]. P-选择素是CD24的唯一配体, 通过低聚糖与CD24特异性结合. 在正常生理情况下, CD24能够介导单核细胞或中性粒细胞黏附于表达P-选择素的活化内皮细胞或血小板, 抗P-选择素或抗CD24抗体可阻断这种黏附作用. 在病理状态下, CD24介导癌细胞与活化血小板和内皮细胞的结合[17]. 因此CD24/P-选择素的黏附途径, 被推测更有利于CD24阳性肿瘤细胞的浸润性和转移行为. 体外培养和动物模型已经证实CD24表达产物足以促进肿瘤的侵袭和转移[15]. CD24明显增强P-选择素依赖的肿瘤细胞与内皮细胞黏附和肿瘤细胞在小鼠肺内迁移滞留和集落形成[18]. 与对照组相比, CD24表达可显著增加增殖转移能力较弱的胰腺癌细胞株和乳腺癌细胞株向裸鼠肺部转移结节的数量[18]. Senner et al[19]证实CD24显著增加星形细胞瘤细胞株在小鼠纹状体内的侵袭范围. 细胞培养刮痕实验也显示, 在排除细胞增殖的影响下, 表达CD24的乳腺癌单细胞层愈合速度明显比CD24阴性的细胞快[18]. 我们发现与正常大肠黏膜相比, 大肠癌肿瘤组织CD24蛋白阳性表达率和平均荧光强度明显增强. 浸润型、高Dukes分期、高pTNM分期、低分化及有淋巴结转移的癌组织中CD24蛋白的表达显著高于对应组. Weichert et al[10]也发现结肠癌肿瘤中有68.7%胞膜染色阳性, 84.4%胞质染色阳性, 胞质染色阳性与肿瘤临床分期(Dukes和pT分期)、淋巴结转移、远处转移和病理分级明显相关, 胞质CD24表达患者生存期明显缩短. 最近Sagiv et al[20]发现90.7%的结直肠腺瘤和86.3%结直肠腺癌表达CD24, 从而提示CD24表达增强发生在结直肠癌肿瘤形成的早期阶段, 可能参与大肠癌的肿瘤形成过程.
研究发现CD24水平与恶性肿瘤的快速生长密切相关. Baumann et al[18]应用实验性动物模型发现表达有CD24的乳腺癌细胞株增殖明显比CD24阴性的细胞株增殖快. 敲除CD24基因的膀胱上皮癌细胞UM-UC-3、前列腺癌细胞DU145、宫颈癌海拉(HeLa)细胞株、乳腺癌细胞MCF-7及骨肉瘤细胞SAOS-2增殖能力明显降低[21]. 我们发现大肠癌癌组织CD24蛋白表达水平与肿瘤细胞增殖指数显著相关, 伴随着CD24蛋白表达水平的增强, 肿瘤细胞增殖指数明显升高. 提示CD24可促进肿瘤细胞生长.
我们发现, 随着大肠腺癌CD24肿瘤细胞阳性表达率的增加, MVD也升高(P = 0.050). 故提示CD24蛋白可能通过某种方式促进肿瘤性血管的生长. 有关CD24与大肠癌血管生成的研究较少, 而且CD24蛋白平均荧光强度与MVD未见明显相关. 因此很难对CD24在大肠癌血管生成中是否起作用下定论. 这需要进一步研究.
总之, CD24参与大肠癌发生、发展, 促进肿瘤细胞生长, 可能参与大肠癌血管生成, 可通过抑制或拮抗CD24表达来抑制肿瘤生长.
大肠癌的临床过程多变, 如果能够判定肿瘤的生物学特点就能预测个体内肿瘤的发展过程. 传统的预后指标已不能满足临床的要求. 现在已有应用分子标记来确定预后分级, CD24是最近确定的新型预后标记基因, 与肿瘤的侵袭转移相关, 在确定肿瘤预后分级方面和早期诊断方面具有重要意义, CD24可能帮助外科医生判断肿瘤预后, 从而决定手术切除范围及辅助治疗方案.
体外培养和动物模型已经证实,CD2 4 对多种肿瘤的生长和转移相关的特性具有调节作用. 但对 CD24在大肠癌侵袭转移中的作用, 特别是CD24与肿瘤性血管生成的关系尚未阐明.
国内应用流式细胞仪对实体瘤进行分析多数采用酶消化或者手工破碎法收集单细胞悬液, 易导致细胞溶解或者组织破碎不够、细胞数太少等问题, 本实验采用组织细胞分散仪收集单细胞悬液, 能避免以上问题, 使实验 数据更据有说服力. 同时应用低分子质量的CK(细胞角蛋白)标记单细胞悬液中的肿瘤细胞, 从而使实 验数据更加精确.
国外学者应用抗CD24的mAb可以时间和剂量依赖的方式抑制表达 CD24的胰腺癌细胞系和结肠癌细胞系的生长. 应用抗CD2 4 和抗 CD21特异性抗体治疗移植相关的 B 细胞增殖综合征已取得良好的效果. 表明应用抗CD24 mAb或者去除、降低CD24表达可能是治疗表达CD24肿瘤的一种新方案.
CK: 细胞角蛋白, 主要标记角化上、复层鳞状上、复层上皮、增生的角化细胞和单层上皮, 用于鳞癌(包括梭形变异), 各种腺癌(包括肾上腺癌, 肝细胞癌), 移行细胞癌等上皮性肿瘤的标记.
本研究认为, CD24在大肠腺癌中表达水平明显上调, 并与肿瘤细胞增殖、血管形成密切相关有一定的新颖性, 创新性, 科学性较强.
电编: 张敏 编辑:张焕兰
| 1. | Kristiansen G, Pilarsky C, Wissmann C, Kaiser S, Bruemmendorf T, Roepcke S, Dahl E, Hinzmann B, Specht T, Pervan J. Expression profiling of microdissected matched prostate cancer samples reveals CD166/MEMD and CD24 as new prognostic markers for patient survival. J Pathol. 2005;205:359-376. [PubMed] |
| 2. | Kristiansen G, Pilarsky C, Pervan J, Sturzebecher B, Stephan C, Jung K, Loening S, Rosenthal A, Dietel M. CD24 expression is a significant predictor of PSA relapse and poor prognosis in low grade or organ confined prostate cancer. Prostate. 2004;58:183-192. [PubMed] |
| 3. | Kristiansen G, Schluns K, Yongwei Y, Denkert C, Dietel M, Petersen I. CD24 is an independent prognostic marker of survival in nonsmall cell lung cancer patients. Br J Cancer. 2003;88:231-236. [PubMed] |
| 4. | Huang LR, Hsu HC. Cloning and expression of CD24 gene in human hepatocellular carcinoma: a potential early tumor marker gene correlates with p53 mutation and tumor differentiation. Cancer Res. 1995;55:4717-4721. [PubMed] |
| 5. | Su MC, Hsu C, Kao HL, Jeng YM. CD24 expression is a prognostic factor in intrahepatic cholangiocar-cinoma. Cancer Lett. 2006;235:34-39. [PubMed] |
| 6. | Deichmann M, Kurzen H, Egner U, Altevogt P, Hartschuh W. Adhesion molecules CD171 (L1CAM) and CD24 are expressed by primary neuroendocrine carcinomas of the skin (Merkel cell carcinomas). J Cutan Pathol. 2003;30:363-368. [PubMed] |
| 7. | Poncet C, Frances V, Gristina R, Scheiner C, Pellissier JF, Figarella-Branger D. CD24, a glycosylphosphatidylinositol-anchored molecules is transiently expressed during the development of human central nervous system and is a marker of human neural cell lineage tumors. Acta Neuropathol (Berl). 1996;91:400-408. [PubMed] |
| 8. | Jacob J, Bellach J, Grutzmann R, Alldinger I, Pilarsky C, Dietel M, Kristiansen G. Expression of CD24 in adenocarcinomas of the pancreas correlates with higher tumor grades. Pancreatology. 2004;4:454-460. [PubMed] |
| 9. | Jung KC, Seo JN, Kim TW, Choi YM, Oh KI, Song HH, Shin HS, Park YE. CD24 Expression in gastric adenocarcinoma is associated with tumor invasiveness. Korean J Pathol. 2004;38:388-393. |
| 10. | Weichert W, Denkert C, Burkhardt M, Gansukh T, Bellach J, Altevogt P, Dietel M, Kristiansen G. Cytoplasmic CD24 expression in colorectal cancer independently correlates with shortened patient survival. Clin Cancer Res. 2005;11:6574-6581. [PubMed] |
| 11. | Droz D, Zachar D, Charbit L, Gogusev J, Chretein Y, Iris L. Expression of the human nephron differentiation molecules in renal cell carcinomas. Am J Pathol. 1990;137:895-905. [PubMed] |
| 12. | Raife TJ, Lager DJ, Kemp JD, Dick FR. Expression of CD24 (BA-1) predicts monocytic lineage in acute myeloid leukemia. Am J Clin Pathol. 1994;101:296-299. [PubMed] |
| 13. | Kristiansen G, Winzer KJ, Mayordomo E, Bellach J, Schluns K, Denkert C, Dahl E, Pilarsky C, Altevogt P, Guski H. CD24 expression is a new prognostic marker in breast cancer. Clin Cancer Res. 2003;9:4906-4913. [PubMed] |
| 14. | Surowiak P, Materna V, Gyorffy B, Matkowski R, Wojnar A, Maciejczyk A, Paluchowski P, Dziegiel P, Pudelko M, Kornafel J. Multivariate analysis of oestrogen receptor alpha, pS2, metallothionein and CD24 expression in invasive breast cancers. Br J Cancer. 2006;95:339-346. [PubMed] |
| 15. | 庄 建良, 苏 子剑, 许 荣誉. CD24与肿瘤侵袭转移的关系. 国际病理科学与临床杂志. 2006;26:387-390. |
| 16. | Kay R, Rosten PM, Humphries RK. CD24, a signal transducer modulating B cell activation responses, is a very short peptide with a glycosyl phosphatidylinositol membrane anchor. J Immunol. 1991;147:1412-1416. [PubMed] |
| 17. | Aigner S, Ruppert M, Hubbe M, Sammar M, Sthoeger Z, Butcher EC, Vestweber D, Altevogt P. Heat stable antigen (mouse CD24) supports myeloid cell binding to endothelial and platelet P-selectin. Int Immunol. 1995;7:1557-1565. [PubMed] |
| 18. | Baumann P, Cremers N, Kroese F, Orend G, Chiquet-Ehrismann R, Uede T, Yagita H, Sleeman JP. CD24 expression causes the acquisition of multiple cellular properties associated with tumor growth and metastasis. Cancer Res. 2005;65:10783-10793. [PubMed] |
| 19. | Senner V, Sturm A, Baur I, Schrell UH, Distel L, Paulus W. CD24 promotes invasion of glioma cells in vivo. J Neuropathol Exp Neurol. 1999;58:795-802. [PubMed] |
| 20. | Sagiv E, Memeo L, Karin A, Kazanov D, Jacob-Hirsch J, Mansukhani M, Rechavi G, Hibshoosh H, Arber N. CD24 is a new oncogene, early at the multistep process of colorectal cancer carcinogenesis. Gastroenterology. 2006;131:630-639. [PubMed] |
| 21. | Smith SC, Oxford G, Wu Z, Nitz MD, Conaway M, Frierson HF, Hampton G, Theodorescu D. The metastasis-associated gene CD24 is regulated by Ral GTPase and is a mediator of cell proliferation and survival in human cancer. Cancer Res. 2006;66:1917-1922. [PubMed] |