修回日期: 2006-11-01
接受日期: 2006-11-02
在线出版日期: 2007-01-28
目的: 分析原发性肝癌(primary hepatic carcinoma, PHC)患者血清P53抗体与临床特征的关系.
方法: 用ELISA法定量分析68例肝癌患者首诊时血清P53抗体, 并用单因素和多因素统计方法分析与性别、年龄、饮酒史、HbsAg、KPS评分、病理诊断、肿瘤分化程度、肝硬化、肿瘤生长方式、肿瘤分期、血管侵犯、有无肝外转移、Child分级、血清白蛋白、AFP、血清铁蛋白等的相关性.
结果: 68例PHC血清P53抗体阳性率29.4% (20/68). 单因素分析显示, 血清P53抗体阳性与肿瘤分化程度低(P = 0.020)、肝外转移(P = 0.002)、肿瘤分期晚(P = 0.027)、血管侵犯有关(P = 0.010). 多因素分析显示只有肝外转移与P53抗体阳性有关(OR = 4.185, P = 0.022).
结论: 血清P53抗体阳性与PHC的不良生物学特征有关.
引文著录: 官泳松, 刘源, 贺庆. 血清P53抗体与原发性肝癌临床特征的关系. 世界华人消化杂志 2007; 15(3): 246-253
Revised: November 1, 2006
Accepted: November 2, 2006
Published online: January 28, 2007
AIM: To analyze the level of serum anti-P53 antibody in primary hepatic carcinoma (PHC) as well as its correlation with clinical characteristics.
METHODS: The enzyme-linked immunosorbent assay (ELISA) was used to detect the serum level of anti-P53 antibody in 68 patients with PHC. Univariate analysis and multivariate Logistic regression analysis were performed to investigate the correlation between the serum level of P53 antibody and clinical data, including the age, sex of patients, alcohol intake, HBsAg, KPS scores, pathological findings, differentiation degree, liver cirrhosis, pattern of tumor growth, tumor stages, vascular invasion, remote metastasis, Child class, the level of serum albumin, alpha-fetoprotein (AFP) and ferritin.
RESULTS: A total of 20 patients (29.4%) were detected positive for serum anti-P53 antibody. Univariate analysis revealed that the positive status of serum P53 antibody was associated with the degree of differentiation (P = 0.020), remote metastasis (P = 0.002), tumor stages (P = 0.027) and vascular invasion (P = 0.010). Multivariate analysis showed that only remote metastasis was independently associated with the positive status of serum anti-P53 antibody (OR = 4.185, P = 0.022).
CONCLUSION: The positive status of serum P53 antibody may be associated with the malignant biological features and poor prognosis of PHC.
- Citation: Guan YS, Liu Y, He Q. Relationship between serum anti-P53 antibody and clinical characteristics of primary hepatic carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 246-253
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/246.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.246
肿瘤抑制基因P53的功能与肿瘤发生、生长调控、凋亡关系密切. 人类肿瘤中, P53突变是最常见的基因改变, 大约有50%的肿瘤患者出现P53基因突变[1]. P53基因突变后表达异常的P53蛋白, 刺激机体产生自身体液免疫, 并可在患者血清中检测到P53抗体[2-3]. 研究发现, 绝大多数恶性肿瘤患者(如食管癌、肺癌、肝癌、结直肠癌等)均检测到了血清P53抗体, 阳性率大约在7%-63%[4-9], 并发现P53抗体与肿瘤分化低、恶性度高、远处转移、肿瘤耐药等不良生物学特征有关[5-6,8-11]. 原发性肝癌(primary hepatic carcinoma, PHC)起病隐匿, 恶性程度高, 大部分患者发现时已是中晚期, 失去外科切除机会. 其预后与包括肝功能、瘤体大小在内的多个因素有关.目前尚无满意的预后指标估计预后, 指导治疗. 国外已有PHC患者血清P53抗体的研究, 发现P53抗体阳性率在7%-32%[9,12-14], 并有相互矛盾的结论, 且未探讨与临床特征之间有无关系[15]. 故有必要对国人PHC患者血清P53抗体及与临床特征的关系作一研究.
2005-06/2006-02在四川大学华西医院确诊为PHC的患者68例, 纳入标准: (1)符合PHC临床诊断标准(2001年广州标准)[16]和/或有肝癌病理诊断依据; (2)临床病史资料完整; (3)KPS评分[17]>60分. 排除标准: (1)已经接受介入治疗、外科手术切除、无水乙醇消融(percutaneous ethanol injection, PEI)、射频、超声聚焦刀(high intensity focus ultrasound, HIFU)等治疗的肝癌患者; (2)有严重免疫抑制或正接受免疫抑制治疗者; (3)临床病史和影像资料不完整. 主要研究仪器及设备有德国产AXIOM-ARTIS 数字减影血管造影机; 德国产Sensation 16多层螺旋CT; 德国产Sonata 1.5T MRI; -20℃冰箱; 法国PharmaCell公司血清P53抗体试剂盒; 酶标仪.
1.2.1 血清P53抗体检测: 血液标本抽取患者空腹静脉血液标本, 立即离心后取上清液, 存放于-20℃冰箱中保存、待测. 标本收集完毕后, 在24℃室温下, 应用PharmaCell公司anti-P53 ELISA试剂盒, 严格按说明书进行操作: 洗涤重组P53蛋白或质控蛋白包被的聚苯乙烯微量反应板, 将稀释的样本和质控蛋白各100 µL分别加入到相应的反应板微孔内, 20℃-25℃震荡温育1 h, 取出后吹干, 加入过氧化物酶标记的抗人IgG抗体反应液100 µL, 20℃-25℃震荡温育1 h, 再次洗涤4次后吹干, 加入酶反应底物TMB100 µL, 室温避光反应10 min, 加入100 µL H2SO4终止酶反应. 用酶标仪测定450 nm波长的吸光度. 根据标准曲线, 按照公式计算出血清P53抗体半定量值(kU/L), 并按照下列标准(参考值范围由试剂盒给出)确定血清P53抗体阴性、阳性(表1).
| 血清P53抗体定量值 | 结果判断 |
| < 0.85 kU/L | 阴性 |
| 0.85-1.15 kU/L | 可疑阳性 |
| >1.15 kU/L | 阳性 |
1.2.2 观察内容及指标: 一般资料: 性别、年龄、饮酒史. 入院时KPS评分[17].
实验室检查: 血清白蛋白(g/L)、肿瘤标记物(甲胎蛋白, 铁蛋白, μg/L).
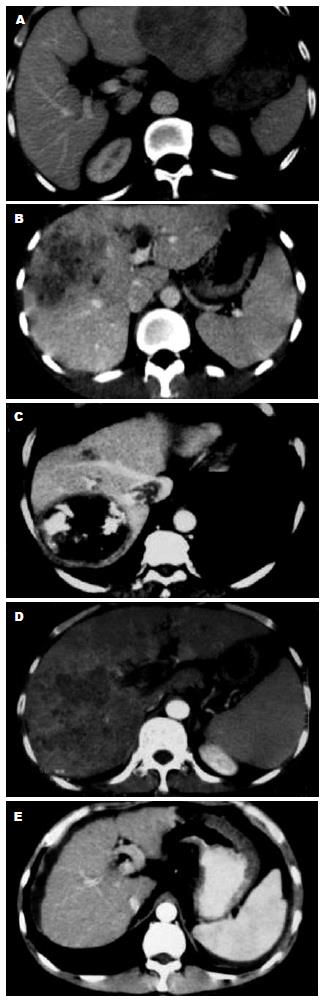
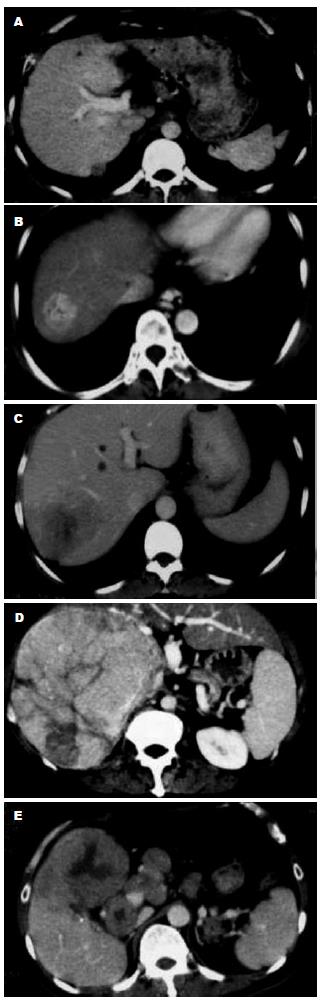
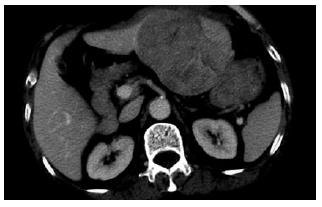
影像学检查: (1)肿瘤大小: 在CT或MRI资料上找出肿瘤最大层面, 测量其长径. (2)生长方式: 按照肿瘤边缘清楚与否分为膨胀生长和浸润生长两类(图1A-B). (3)血管侵犯: 根据CT, MRI或DSA检查, 观察肿瘤有无造成门静脉(分支、主干)癌栓、下腔静脉癌栓、肝动脉门静脉瘘、肝动脉肝静脉瘘. 没有血管侵犯的, 以0级表示; 侵犯一种血管, 以1级表示; 侵犯两种血管, 以2级表示; 侵犯三种以上血管, 以3级表示(图1C-D). (4)肝硬化: 根据超声、CT、MRI检查, 按有无肝叶比例失调、肝裂增宽、肝表面结节样改变、继发门静脉高压等肝硬化表现, 分为有肝硬化和无肝硬化两类(图1E). (5)肝外转移: 根据平片、超声、CT、MRI、核素扫描等影像学检查, 观察有无肝外的淋巴结增大或肿瘤转移病灶(包括肿瘤直接侵犯临近脏器), 并分为有肝外转移和无肝外转移两类.
病理检查: (1)病理诊断: 根据穿刺活检的病理结果, 分为肝细胞肝癌(hepatocellular carcinoma, HCC)和非肝细胞肝癌(包括胆管源性、肝细胞胆管细胞混合癌等)两类. (2)肿瘤分化程度: 按照Edmondson分级法, 分为高分化、中分化、低分化三类.
其他指标: (1)Child分级[18]: 根据检验结果和临床资料将患者肝功能分为Child A、B、C三级. (2)肿瘤临床分期[16]: 并参考"中国肝癌协作组2001年广州会议标准", 将肝癌分为Ⅰa, Ⅰb, Ⅱa, Ⅱb, Ⅲa, Ⅲb共三期6个等级(图2).
1.2.3 资料收集: 收集患者入院后例行的血常规、肝肾功能、凝血常规、肿瘤标记物等实验室检查结果. 同时抽血并离心、冷冻保存血清标本, 等待检测P53抗体. 常规行胸片、腹部增强CT扫描并根据情况行胸、腹部或全身CT、MRI、核素扫描等影像学检查. CT扫描: 介入治疗前常规采用Sensation 16多层螺旋CT扫描: 用Medrad-DP 100型高压注射器, 优维显(ultravist 300 gI/L), 剂量2 mL/kg, 流速3 mL/s, 经肘前静脉给药, 行动脉期(扫描延迟18-20 s)和门静脉期(扫描延迟时间60 s)双重扫描. 介入治疗后[19] 4 wk复查CT, 复查参数同前. 阅片: 由2名副高职称以上、有影像诊断和血管造影诊断经验的医生盲法分析患者的影像学资料(包括患者治疗前的胸片、CT、MRI、超声检查、核素扫描、介入治疗时的血管造影表现以及治疗后1 mo复查的影像资料). 重点按照前述观察指标评价患者影像学资料特点, 并进行肝癌的临床分期, 判定复查患者的疗效, 做好记录以备分析.
统计学处理 分析治疗前血清P53抗体水平与临床特点的关系, 包括患者性别、年龄、饮酒史、HBsAg、病理诊断、KPS评分、肿瘤分化程度、有无肝硬化、肿瘤生长方式、肿瘤长径、肝外转移、肿瘤分期、Child分级、血管侵犯、血清白蛋白、血清铁蛋白、AFP(同时按肝癌诊断标准将AFP以400 μg/L为界值处理为二分类变量)等. 将有统计学意义的指标与血清P53抗体状态(阴性、阳性)作多因素Logistic回归分析. 通过单因素(秩和检验或卡方检验)及多因素Logistic回归统计分析, 明确与P53抗体阳性有关的临床特征指标.
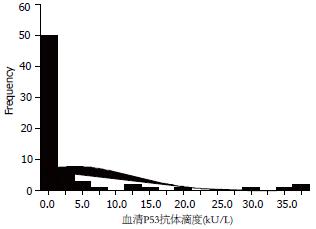
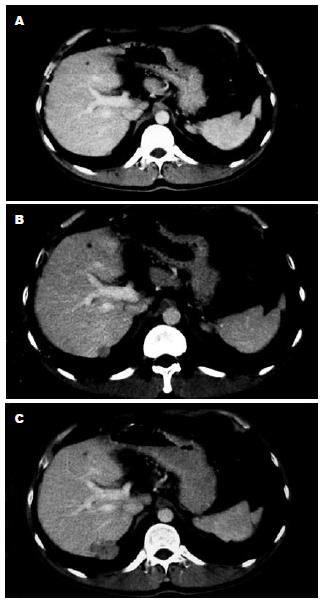
本研究共收集75例患者血清, 排除了不符合纳入标准的7例, 共检测了68例共89份血清标本, 其中男56例(82.4%), 女12例(17.6%). 有13例患者检测了2次P53抗体, 4例患者检测了3次. 患者血清P53抗体检测情况. 68例中治疗前血清P53抗体最大值37.022 kU/L, 最小值0.161 kU/L, 中位数0.798 kU/L, 抗体定量值分布见图3. 按照阳性>1.15 kU/L标准判断, 29.4%(20/68)患者血清P53抗体阳性.部分患者血清P53抗体滴度及CT图片(图4-5).
血清P53抗体阴性和阳性两组患者临床特征见表2-4. 单因素分析显示, 血清P53抗体阳性与阴性两组患者间肝外转移、分化程度、病理诊断、肿瘤分期、血管侵犯的差别有统计学意义.根据单因素统计分析结果, 将有统计学意义因素(肿瘤分化程度、病理诊断两指标因例数不够, 不纳入回归模型)纳入多因素Logistic回归模型, 进行多因素统计分析, 明确与P53抗体阳性有关的临床特征. 统计结果表明: 肝外转移是与血清P53抗体阳性有关的独立因素(表5).
| P53抗体阴性n=48 | P53抗体阳性n=20 | 阳性率(%) | P值 | |
| 性别 | ||||
| 男 | 41 | 15 | 26.8 | 0.308 |
| 女 | 7 | 5 | 41.7 | |
| 饮酒史 | ||||
| 无 | 36 | 17 | 32.1 | 0.368 |
| 有 | 12 | 3 | 20 | |
| HbsAg | ||||
| 阴性 | 14 | 7 | 33.3 | 0.638 |
| 阳性 | 34 | 13 | 27.7 | |
| KPS评分 | ||||
| 100 | 20 | 5 | 20 | 0.3361 |
| 90 | 13 | 8 | 38.1 | |
| 80 | 12 | 5 | 29.4 | |
| 70 | 1 | 2 | 66.7 | |
| 60 | 2 | 0 | 0 | |
| 肝硬化 | ||||
| 无 | 30 | 16 | 34.8 | 0.163 |
| 有 | 18 | 4 | 18.2 | |
| 生长方式 | ||||
| 膨胀 | 27 | 11 | 28.9 | 0.925 |
| 浸润 | 21 | 9 | 30 | |
| 肝外转移 | ||||
| 无 | 38 | 8 | 17.4 | 0.002 |
| 有 | 10 | 12 | 54.5 | |
| 肿瘤分期 | ||||
| Ia | 4 | 1 | 20 | 0.0271 |
| Ib | 5 | 1 | 16.7 | |
| IIa | 13 | 1 | 7.1 | |
| IIb | 16 | 9 | 36 | |
| IIIa | 10 | 8 | 44.4 | |
| IIIb | 0 | 0 | ||
| Child分级 | ||||
| A | 38 | 17 | 30.9 | 0.5411 |
| B | 8 | 3 | 27.3 | |
| C | 2 | 0 | 0 | |
| 血管侵犯 | ||||
| 0级 | 32 | 7 | 17.9 | `0.0101 |
| 1级 | 10 | 6 | 37.5 | |
| 2级 | 5 | 5 | 50 | |
| 3级 | 1 | 2 | 66.7 | |
| AFP | ||||
| <400 μg/L | 31 | 10 | 24.4 | 0.263 |
| ≥400 μg/L | 17 | 10 | 37 |
| P53抗体阴性n=48 | P53抗体阳性n=20 阳性率(%) | P值 | |
| 年龄(岁) | 51.88 | 49.7 | 0.5192 |
| 血清白蛋白(g/L) | 36.27 | 34.81 | 0.3772 |
| AFP(mg/L) | 86.395 | 490 | 0.1621 |
| 血清铁蛋白(mg/L) | 422.3 | 373 | 0.3891 |
| 肿瘤最大径(cm)(n = 56) | 9(n = 38) | 7(n = 18) | 0.8881 |
| P53抗体阴性n=19 | P53抗体阳性n=11 | 阳性率(%) | P值 | |
| 病理诊断 | ||||
| HCC | 13 | 6 | 31.6 | 0.205 |
| 非HCC | 6 | 5 | 45.5 | |
| 肿瘤分化程度 | ||||
| 高 | 3 | 1 | 25 | 0.0201 |
| 中 | 12 | 2 | 14.2 | |
| 低 | 4 | 8 | 66.7 |
| P值 | OR值 | 95%CI | |
| 肝外转移 | 0.022 | 4.185 | 1.266-13.829 |
| 血管侵犯 | 0.102 | 1.720 | 0.897-3.299 |
| 肿瘤分期 | 0.798 | 1.087 | 0.574-2.061 |
1979年, Deleo et al[20]发现了小鼠对由甲基胆蒽诱发的肿瘤所产生的针对P53蛋白的体液免疫; 也有人发现带有SV40肿瘤的动物出现针对P53蛋白的体液免疫反应. 1982年, Crawford et al[21]首先在乳腺癌患者中发现并描述了P53抗体. 人类肿瘤中, P53突变是最常见的基因改变, 大约有50%的肿瘤患者出现P53基因突变, 已有1000余种P53突变被发现. 突变的P53基因表达突变的P53蛋白, 不能进行DNA修复和控制细胞分裂, 另一重要特点是突变的P53蛋白的半衰期由野生型的20 min增长到数小时之久, 并在肿瘤细胞核内积聚[2-3]. 积聚于细胞核中的突变P53蛋白, 在细胞坏死裂解后进入体液, 导致机体对这一蛋白产生自身体液免疫, 从而产生了P53抗体. 通常, 对肿瘤组织中的P53基因测序或用免疫组化显示肿瘤细胞中突变的P53蛋白是检测肿瘤有无P53基因突变的金标准. 但基因测序技术条件要求高, 且两种方法均需要肿瘤标本, 在临床中常规应用有较大难度. 许多研究发现P53抗体出现与P53蛋白积聚以及P53基因突变有明显相关性, 因而可以相对简单地由血清中P53抗体状态推测机体有无P53基因突变[7]. 在正常人群中和良性疾病中, 极少检测到P53抗体, 阳性率明显低于恶性肿瘤患者[7,13,15,22-23]. 通常认为, P53抗体阳性与肿瘤分化低、分期晚、化疗耐药等提示肿瘤恶性生物学行为的指标有关[5-6,9,11], 但关于P53抗体在预后分析中的价值, 研究者持有不同观点. 有认为不宜作预后指标[24-25]; 也有人认为可用于预后判断[7].
本研究分析了68例PHC患者(男56例, 女12例), P53抗体阳性率29.4%(20/68), 符合其他文献报道肝癌患者中的阳性率7-32%的范围[9,12-15]. 不同研究的P53抗体阳性率差异较大, 与研究纳入患者的种族、肿瘤分期有关, 也可能与P53基因突变的部位、类型有关. 单因素分析显示血清P53抗体是否阳性与患者的性别、年龄、饮酒史、HBsAg、肝功能分级、白蛋白等均无差别, 而且与患者生活质量(KPS)评分、有无肝硬化也无明显关系. 而肿瘤分化程度、血管侵犯、肝外转移等代表肿瘤不良生物学特性的指标在P53抗体阳性、阴性两组患者间差别较大. 与前人研究相似[6,12-13].
单因素分析显示, 病理分化程度为低分化者, P53抗体阳性率66.7%, 明显高于高分化(25.0%)和中分化(15.4%)者. 肿瘤分期晚者, P53抗体阳性率高于分期早者. 这些结果提示血清P53抗体阳性患者, 其肿瘤分化程度低, 分期晚, 恶性度高. 基础研究也发现P53基因突变率在分化较差的肝癌中更高, 在肿瘤晚期比在早期更多地出现P53基因突变[27-28]. 同时, 血清P53抗体阳性者, 肿瘤更容易侵犯血管(P = 0.010), 包括门静脉、肝动脉、肝静脉、下腔静脉, 造成癌栓阻塞管腔和/或肝动脉与静脉系统之间的瘘, 因而更容易发生远处转移. Saffroy et al[9]分析了130例欧洲PHC患者, 也发现P53抗体与AFP无关, 但阳性者更有可能出现血管侵犯. 但是, 突变的P53蛋白与肿瘤由原位生长到侵入血管再到远处转移这一系列过程中的作用机制, 尚未明确, 有待在分子生物学水平深入研究. P53抗体阳性、阴性患者间肿瘤长径没有明显差异(秩和检验P>0.05).如患者5、36号, 肿瘤长径分别为1.5, 3.0 cm, 而P53抗体均为阳性, 滴度高达3.180 kU/L、13.509 kU/L; 相反, 患者81号, 肿瘤长径11.0 cm, P53抗体阴性, 滴度0.930 kU/L, 但病检结果为中分化肿瘤. 说明虽然肿瘤长径大, 但分化较好, 没有出现P53抗体突变.也有可能是P53基因的突变系少见突变, 针对常见突变进行检测的P53抗体试剂不能检测出机体针对这一少见突变产生的抗体. Bergqvist et al[6]也发现肺癌患者的血清P53抗体与肿瘤分化、TNM分期有密切关系, 而与肿瘤病理类型、原发肿瘤大小、部位无关. Shiota et al[13]分析86例HCC, 发现P53抗体阳性与血胆红素、和肿瘤数目有关, 与瘤体大小无关. 分析30例有病理结果的患者的肿瘤类型, HCC19例, 6例(24%)P53抗体阳性, 胆管源性恶性肿瘤10例, 4例(40%)阳性, 肝母细胞瘤1例, P53抗体阳性, HCC与非HCC的P53抗体阳性率没有统计学意义(卡方检验, P = 0.714).但数据显示在胆管源性肿瘤中, P53抗体阳性率较高, 有待今后扩大样本量, 了解有无差别, 同时也需要进一步研究HCC和胆管源性肿瘤P53基因突变热点、变异的P53蛋白构象以及各自作用机制的区别. 根据经验, 膨胀生长的肝癌, 通常分化较好, 虽然为恶性肿瘤, 但可压迫周围肝实质, 出现假包膜. 尽管前面得出肿瘤分化程度与P53抗体相关, 但分析P53抗体与肿瘤生长特性发现, 两者间无相关性. 其原因有可能为样本量太少; P53基因突变位点不同引起P53抗体检测出现差别; 判断膨胀、浸润生长, 出现的测量性偏倚. 所以, 两者间的关系有待进一步扩大样本, 分析考证. AFP是公认的PHC敏感性、特异性较高的肿瘤标志物, 但不足之处在于约有30%肝癌患者的AFP在正常范围内, 且分析AFP增高时需要排除妊娠、生殖细胞肿瘤等情况[28]. 按照2004年广州会议肝癌的诊断标准[16], 将患者AFP值以400 μg/L为界分为两组, 用配对卡方检验比较AFP检出率(>400 μg/L)与P53抗体阳性率. 虽然P53抗体敏感性较低, 但按照现有样本和检验水准, 尚不能认为AFP检出率高于P53抗体阳性率. 另外, 本研究和Saffroy et al[9]在分析了130例欧洲的肝癌患者后, 均发现P53抗体与AFP无相关性. 本研究进一步分析数据发现, 在AFP小于诊断标准400 μg/L的41例患者中, 有10例P53抗体阳性. 同时, 分子生物学研究也发现, P53基因的突变可能出现在肝细胞癌变过程的早期, 并随肿瘤发展, 逐渐升高[28]. 因此, 我们可以利用P53抗体的高特异性[7-8,11], 在肝癌诊断上可以与AFP互补, 有助于AFP小于400 μg/L患者的诊断; 同时, 对于AFP大于400 μg/L的患者, P53抗体阳性可以提高肝癌诊断的把握度.血清铁蛋白在PHC患者诊断中也有一定意义[30-31], 本研究发现血清P53抗体阳性、阴性间与铁蛋白水平无明显关系提示两者结合有助于肝癌的诊断.
对血清P53抗体与肝癌患者临床病理特征的断面研究初步提示: P53抗体阳性、阴性患者间, 性别、年龄、饮酒史、HbsAg、KPS、病理诊断、肝硬化、生长方式、Child分级、血清白蛋白、肿瘤长径均无差别, 而与代表肿瘤不良生物学特征的指标肿瘤分化程度、临床分期和肝外转移有关.
本研究限度受条件限制, 纳入的样本例数不够多, 有可能未能发现一些潜在的有意义的联系; 受时间限制, 没有患者随访的生存资料. 有待于今后继续随访, 获得生存信息, 作Cox风险比分析; 没有正常对照, 但对本研究没有太大影响.因为许多研究证实在正常人群中, 极少有血清P53抗体检出; 纳入对象均是华西医院介入科住院患者, 有可能存在选择性偏倚.
本文得出的结论如下: (1)对68例PHC患者血清P53抗体与临床特征关系分析发现, P53抗体阳性与肿瘤分化程度低、肝外转移、肿瘤分期晚、血管侵犯等代表肿瘤不良生物学特征的指标有关; (2)血清P53抗体与AFP相结合, 有助与AFP<400 μg/L患者的肝癌临床诊断.
总之, 由于血清P53抗体检测方便、准确, 特异性高, 可应用于临床作为PHC的辅助诊断手段, 提示肿瘤的不良生物学特征和较差的预后.有必要进一步扩大样本量深入研究血清P53抗体的临床意义.
原发性肝癌的诊断和其预后的评价是一个在临床上经常遇到而又十分具有挑战性的问题. 一些研究发现, 许多恶性肿瘤患者血清中P53抗体水平异常增 高, 可能与P53基因突变、瘤体内P53蛋白异常积聚、肿瘤不良生物学行为有关. 目前, 对国人原发性肝癌的血清P53抗体阳性率及其与临床特征、预后等的关系研究尚少.
P53抗体阳性与肿瘤分化程度低, 肝外转移、肿瘤分期晚、血管侵犯等有关. 与AFP相结合, 有助与AFP<400 mg/L患者的肝癌临床诊断.
本文用ELISA法定量分析肝癌首诊时血清P53抗体值, 并用单因素和多因素统计方法分析其与临床特征的相关性, 包括性别、年龄、饮酒史、HBsAg、KPS 评分、病理诊断、肿瘤分化程度、肝硬化、肿瘤生长方式、肿瘤分期、血管侵犯、有无肝外转移、C h i l d 分级、血清白蛋白、AFP、血清铁蛋白等. 文章具有科学性、创新性和临床实用性.
电编: 李琪 编辑:张焕兰
| 1. | Hollstein M, Rice K, Greenblatt MS, Soussi T, Fuchs R, Sorlie T, Hovig E, Smith-Sorensen B, Montesano R, Harris CC. Database of P53 gene somatic mutations in human tumors and cell lines. Nucleic Acids Res. 1994;22:3551-3555. [PubMed] |
| 2. | Casey G, Lopez ME, Ramos JC, Arboleda MJ, Shaughnessy M, Karlan B, Slamon DJ. DNA sequence analysis of exons 2 through 11 and immunohistochemical staining are required to detect all known P53 alterations in human malignancies. Oncogene. 1996;13:1971-1981. [PubMed] |
| 3. | Dowell SP, Wilson PO, Derias NW, Lane DP, Hall PA. Clinical utility of the immunocytochemical detection of P53 protein in cytological specimens. Cancer Res. 1994;54:2914-2918. [PubMed] |
| 4. | Volkmann M, Sinn HP, Gaugel D, Frey M, Hajjar Y, Ludwig J, Hansel S, Bastert G, Wallwiener D, Fiehn W. Anti-P53in breast cancer: concordance of different assay procedures and association with P53 antigen expression. Oncology. 2002;63:297-305. [PubMed] |
| 5. | Bergstrom S, Dreilich M, Wagenius G, Brattstrom D, Larsson A, Hesselius P, Bergqvist M. The presence of anti-P53 antibodies in sera from patients with oesophageal carcinoma: correlation to treatment, tumour volume and survival. In Vivo. 2004;18:615-620. [PubMed] |
| 6. | Bergqvist M, Brattstrom D, Larsson A, Hesselius P, Brodin O, Wagenius G. The role of circulating anti-P53 antibodies in patients with advanced non-small cell lung cancer and their correlation to clinical parameters and survival. BMC Cancer. 2004;4:66. [PubMed] |
| 7. | Chang SC, Lin JK, Lin TC, Liang WY. Genetic alteration of P53, but not overexpression of intratumoral P53 protein, or serum P53 antibody is a prognostic factor in sporadic colorectal adenocarcinoma. Int J Oncol. 2005;26:65-75. [PubMed] |
| 8. | Takeda A, Shimada H, Nakajima K, Yoshimura S, Suzuki T, Asano T, Ochiai T, Isono K. Serum P53 antibody as a useful marker for monitoring of treatment of superficial colorectal adenocarcinoma after endoscopic resection. Int J Clin Oncol. 2001;6:45-49. [PubMed] |
| 9. | Saffroy R, Lelong JC, Azoulay D, Salvucci M, Reynes M, Bismuth H, Debuire B, Lemoine A. Clinical significance of circulating anti-P53 antibodies in European patients with hepatocellular carcinoma. Br J Cancer. 1999;79:604-610. [PubMed] |
| 10. | Cioffi M, Vietri MT, Gazzerro P, Magnetta R, D'Auria A, Durante A, Nola E, Puca GA, Molinari AM. Serum anti-P53 antibodies in lung cancer: comparison with established tumor markers. Lung Cancer. 2001;33:163-169. [PubMed] |
| 11. | Nasif WA, Lotfy M, El-Sayed IH, El-Kenawy Ael-M, El-Shahat M, El-Hak NG. Implications of CEA and P53 overexpression in the poor prognosis of colorectal cancer. Med Oncol. 2006;23:237-244. [PubMed] |
| 12. | Charuruks N, Tangkijvanich P, Voravud N, Chatsantikul R, Theamboonlers A, Poovorawan Y. Clinical significance of P53 antigen and anti-P53 antibodies in the sera of hepatocellular carcinoma patients. J Gastroenterol. 2001;36:830-836. [PubMed] |
| 13. | Shiota G, Kishimoto Y, Suyama A, Okubo M, Katayama S, Harada K, Ishida M, Hori K, Suou T, Kawasaki H. Prognostic significance of serum anti-P53 antibody in patients with hepatocellular carcinoma. J Hepatol. 1997;27:661-668. [PubMed] |
| 14. | Tangkijvanich P, Janchai A, Charuruks N, Kullavanijaya P, Theamboonlers A, Hirsch P, Poovorawan Y. Clinical associations and prognostic significance of serum anti-P53 antibodies in Thai patients with hepatocellular carcinoma. Asian Pac J Allergy Immunol. 2000;18:237-243. [PubMed] |
| 15. | Raedle J, Oremek G, Roth WK, Caspary WF, Zeuzem S. Anti-P53 autoantibodies in hepatitis C virus-infected patients. Anticancer Res. 1997;17:3079-3081. [PubMed] |
| 16. | Pascual S, Zapater P, Such J, Garcia-Herola A, Sempere L, Irurzun J, Palazon JM, Carnicer F, Perez-Mateo M. Comparison of staging systems to predict survival in hepatocellular carcinoma. Liver Int. 2006;26:673-679. [PubMed] |
| 17. | Abernethy AP, Shelby-James T, Fazekas BS, Woods D, Currow DC. The Australia-modified Karnofsky Performance Status (AKPS) scale: a revised scale for contemporary palliative care clinical practice [ISRCTN81117481]. BMC Palliat Care. 2005;4:7. [PubMed] |
| 18. | Cholongitas E, Senzolo M, Patch D, Shaw S, Hui C, Burroughs AK. Review article: scoring systems for assessing prognosis in critically ill adult cirrhotics. Aliment Pharmacol Ther. 2006;24:453-464. [PubMed] |
| 19. | Therasse P, Arbuck SG, Eisenhauer EA, Wanders J, Kaplan RS, Rubinstein L, Verweij J, Van Glabbeke M, van Oosterom AT, Christian MC. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst. 2000;92:205-216. [PubMed] |
| 20. | DeLeo AB, Jay G, Appella E, Dubois GC, Law LW, Old LJ. Detection of a transformation-related antigen in chemically induced sarcomas and other transformed cells of the mouse. Proc Natl Acad Sci USA. 1979;76:2420-2424. [PubMed] |
| 21. | Crawford LV, Pim DC, Bulbrook RD. Detection of antibodies against the cellular protein P53 in sera from patients with breast cancer. Int J Cancer. 1982;30:403-408. [PubMed] |
| 22. | Neri M, Betta P, Marroni P, Filiberti R, Cafferata M, Mereu C, Ivaldi G, Montanaro F, Puntoni R, Paganuzzi M. Serum anti-P53 autoantibodies in pleural malignant mesothelioma, lung cancer and non-neoplastic lung diseases. Lung Cancer. 2003;39:165-172. [PubMed] |
| 23. | Shimada H, Takeda A, Arima M, Okazumi S, Matsubara H, Nabeya Y, Funami Y, Hayashi H, Gunji Y, Suzuki T. Serum P53 antibody is a useful tumor marker in superficial esophageal squamous cell carcinoma. Cancer. 2000;89:1677-1683. [PubMed] |
| 24. | Tafuri LS, Rocha GF, Gobbi H. Cell cycle related proteins in hyperplasia of usual type in breast specimens of patients with and without breast cancer. BMC Cell Biol. 2006;7:29. [PubMed] |
| 25. | Chow V, Yuen AP, Lam KY, Ho WK, Wei WI. Prognostic significance of serum P53 protein and P53 antibody in patients with surgical treatment for head and neck squamous cell carcinoma. Head Neck. 2001;23:286-291. [PubMed] |
| 27. | Gusterson BA, Anbazhagan R, Warren W, Midgely C, Lane DP, O'Hare M, Stamps A, Carter R, Jayatilake H. Expression of P53 in premalignant and malignant squamous epithelium. Oncogene. 1991;6:1785-1789. [PubMed] |
| 28. | Kashyap R, Jain A, Nalesnik M, Carr B, Barnes J, Vargas HE, Rakela J, Fung J. Clinical significance of elevated alpha-fetoprotein in adults and children. Dig Dis Sci. 2001;46:1709-1713. [PubMed] |
| 29. | Peng SY, Chen WJ, Lai PL, Jeng YM, Sheu JC, Hsu HC. High alpha-fetoprotein level correlates with high stage, early recurrence and poor prognosis of hepatocellular carcinoma: significance of hepatitis virus infection, age, P53 and beta-catenin mutations. Int J Cancer. 2004;112:44-50. [PubMed] |
| 30. | Ioannou GN, Kowdley KV. Iron, HFE mutations, and hepatocellular carcinoma: is hepatic iron a carcinogen? Clin Gastroenterol Hepatol. 2003;1:246-248. [PubMed] |
| 31. | Lopez JB, Balasegaram M, Timor J, Thambyrajah V. Comparison of alpha-fetoprotein with some other tumour markers in Malaysians with hepatocellular carcinoma. Malays J Pathol. 1997;19:53-58. [PubMed] |