修回日期: 2006-11-01
接受日期: 2006-11-16
在线出版日期: 2007-01-28
目的: 通过建立大鼠急性胆道梗阻模型研究梗阻性黄疸时肝细胞死亡方式.
方法: ♂Wistar大鼠随机分为胆道结扎(BDL)组和对照(C)组. BDL组采用Yoshidome法建立急性胆道梗阻模型, 7 d后取材, 应用流式细胞仪检测肝细胞胀亡和凋亡的百分比, HE染色和电镜观察肝组织病理组织学改变以及肝细胞凋亡、胀亡, 并检测血清总胆红素TBIL, DBIL, ALP, γ-GT, ALT, AST和LDH水平.
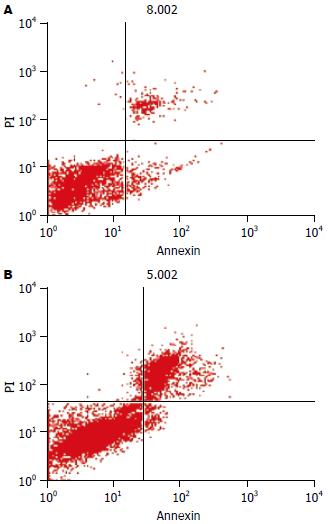
结果: BDL组胀亡和坏死细胞百分比均显著高于C组(胀亡: 25.41%±2.18% vs 6.12%±1.69%; 坏死: 3.99%±1.24% vs 0.79%±0.29%; 均P<0.05), 而凋亡百分比显著低于C组(2.79%±1.43% vs 5.18%±1.87%, P<0.05). BDL组胀亡细胞百分比显著高于凋亡(25.41%±2.18% vs 2.79%±1.43%, P<0.05). 肝病理组织学检查发现BDL组胆管增生, 纤维结缔组织明显增生, 肝细胞索排列紊乱, 胀亡增加. BDL组血清TBIL, DBIL, ALP, γ-GT, AST, ALT和LDH水平均显著高于C组(P<0.05).
结论: 急性胆道梗阻时大鼠肝细胞死亡以胀亡为主, 其肝功能损伤程度与肝细胞胀亡、凋亡有密切关系.
引文著录: 徐锋, 戴朝六, 贾昌俊, 许永庆, 彭松林, 顾玺, 赵阳. 急性胆道梗阻大鼠肝细胞的死亡方式. 世界华人消化杂志 2007; 15(3): 240-245
Revised: November 1, 2006
Accepted: November 16, 2006
Published online: January 28, 2007
AIM: To investigate the patterns of hepatic cell death in rats with acute bile duct obstruction.
METHODS: Male Wistar rats were divided randomly into bile duct ligation (BDL) group (n = 5) and control group (n = 5). The rats in BDL group underwent ligation and division of common bile duct to set up acute bile duct obstruction model according to Yoshidome's maneuver, while the rats in the control group underwent dissociation of common bile duct only. All the animals were sacrificed for sampling on day 7. Flow cytometry was used to determine the percentages of hepatocyte apoptosis and oncosis. Hematoxylin and eosin (H&E) staining and electron microscopy were used to observe hepatocyte apoptosis, oncosis and histopathological changes. An auto analyzer was used to examine the levels of serum total bilirubin (TBIL), direct bilirubin (DBIL), alkaline phosphatase (ALP), glutamyl transpeptidase (γ-GT), alanine aminotransferase (ALT), aspartate aminotransferase (AST) and lactate dehydrogenase (LDH).
RESULTS: The percentage of liver cell oncosis or necrosis was significantly higher in BDL group than that in the control group (oncosis: 25.41% ± 2.18% vs 6.12% ± 1.69%, P < 0.05; necrosis: 3.99% ± 1.24% vs 0.79% ± 0.29%, P < 0.05), while the percentage of apoptosis was remarkably lower in BDL group (2.79% ± 1.43% vs 5.18% ± 1.87%, P < 0.05). Moreover, the percentage of hepatic cell oncosis was higher than that of apoptosis in BDL group (25.41% ± 2.18% vs 2.79% ± 1.43%, P < 0.05). Hepatic histopathological examination showed proliferation of bile duct and fibrous connective tissue, obvious increase of hepatic cell oncosis and liver cell cord derangement in BDL group. The levels of serum TBIL, DBIL, ALP, γ-GT, AST, ALT and LDH in BDL group were all increased as compared with those in the control group (P < 0.05).
CONCLUSION: Oncosis is the dominant type of hepatic cell death in rats with acute bile duct obstruction, and the degree of hepatic injury has a close relationship with the oncosis or apoptosis of hepatic cells.
- Citation: Xu F, Dai CL, Jia CJ, Xu YQ, Peng SL, Gu X, Zhao Y. Patterns of liver cell death in rats with acute bile duct obstruction. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 240-245
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/240.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.240
梗阻性黄疸是外科经常遇到的临床问题, 此类患者解除胆道梗阻后往往有不同程度的肝功能不全甚至出现急性肝功能衰竭. 但目前国内外对梗阻性黄疸损伤的确切作用机制尚不完全清楚. 一般认为细胞死亡分为胀亡和凋亡, 坏死只是发生胀亡或凋亡后细胞死亡的形态学变化[1].但目前对梗阻性黄疸时肝细胞死亡方式仍存在争议[2-4], 因此, 本实验通过建立大鼠急性胆道梗阻模型, 应用流式细胞仪等技术研究梗阻性黄疸时肝细胞死亡方式, 为梗阻性黄疸的损伤机制提供新的实验依据.
Wistar♂大鼠, 体质量270±20 g, 中国医科大学盛京医院实验动物中心提供; 胀亡和凋亡检测试剂盒(Annexin V-FITC和PI)购自美国BD公司.
将10只♂Wistar大鼠随机分为胆管结扎组(BDL组, n = 5)和对照组(C组, n = 5). 参照Yoshidome et al[5]报道的方法建立急性胆道梗阻模型, 稍加改动: 各组大鼠用100 g/L水合氯醛(按3 μL/g) ip麻醉, 取正中切口入腹. BDL组3/0丝线结扎并切断胆总管, C组仅游离胆总管, 不结扎. 术后大鼠均单笼饲养, 常规进食水. 造模7 d后取材, 自腹主动脉采血3 mL, 静置20 min, 3000 r/min离心10 min, 将血清转移至塑料弹头中, 置于-20℃冰箱中保存, 待测血清胆红素和生化酶水平; 快速夹取肝组织, 用锡箔纸包裹后置于液氮中, 再转至-80℃冰箱中保存, 待做流式细胞仪检测; 取1.0 cm×1.0 cm×1.0 cm大小肝组织置于40 g/L甲醛中固定, 待做病理组织学检查; 取0.2 cm×0.2 cm×0.2 cm大小肝组织置于25 g/L戊二醛溶液中固定, 待做电镜检查. 处死大鼠. 观察大鼠一般情况. 血清TBIL, DBIL, ALP, γ-GT, AST, ALT和LDH水平测定用Hitachi 7600全自动生化分析仪检测. 肝组织块常规石蜡包埋, 切片, HE染色, 光镜下观察肝病理组织学变化. 肝组织块常规锇酸后固定, 梯度脱水, 包埋, 聚合, 超薄切片, 柠檬酸铅-醋酸双氧铀双染色, 用Hitachi H-600型透射电镜观察肝组织超微结构改变.
1.2.1 流式细胞仪检测肝细胞胀亡和凋亡: 用Medicon(BD流式细胞仪制备单细胞仪器)降解肝组织块, 50 mm Filcon滤器过滤细胞悬液, 离心, 弃上清, 加Binding Buffer缓冲液, 调节细胞浓度至5×108-1×109个/L, 加AnnexinV-FITC和PI, 室温避光放置, 用美国BD-FACSCalibur型流式细胞仪测定各类细胞百分数. 结果分析: 正常细胞, Annexin V, PI均低染; 胀亡细胞, Annexin V, PI均高染; 凋亡细胞, Annexin V高染、PI低染; 坏死细胞, PI高染、Annexin V低染.
统计学处理 所有数据采用统计软件SPSS 11.5进行t检验分析, P<0.05被认为有统计学意义.
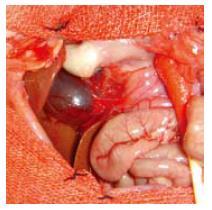
BDL组体质量减轻明显, 尿呈深黄色, 胆总管明显扩张, 肝叶肿大呈淤胆样改变, 肠道淤滞(图1). 而C组体质量轻度增加, 尿不黄, 胆总管无扩张, 肝脏颜色正常、有光泽, 肠道无淤滞. 血清TBIL, DBIL, ALP, γ-GT, AST, ALT和LDH水平测定BDL组血清各项指标水平均显著高于C组(P<0.05)(表1).
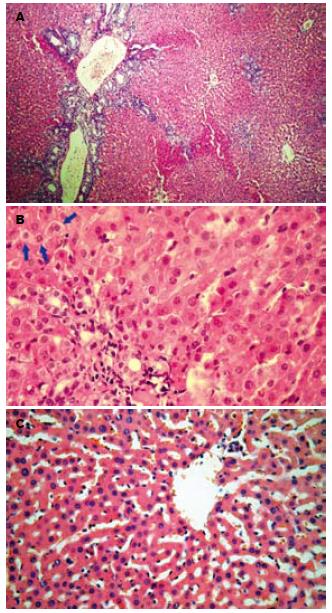
BDL组胆管增生明显, 纤维结缔组织明显增生并向肝小叶内扩展(图2A), 肝窦变窄, 肝细胞胀亡明显(图2B); C组肝小叶结构清楚, 肝细胞无肿胀, 肝细胞索排列规则, 肝窦较宽(图2C).
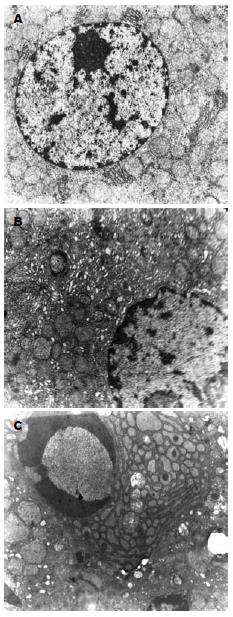
C组肝细胞核呈圆形, 核膜完整, 染色质分布正常, 线粒体丰富、结构清晰, 内质网完整, 糖原颗粒丰富(图3A). BDL组可见胀亡和凋亡细胞. 胀亡细胞: 线粒体肿胀、嵴破坏或消失, 内质网崩解、颗粒消失, 染色质边集(图3B). 凋亡细胞: 细胞皱缩, 质膜完整, 胞质致密、退行性变, 内质网扩张与胞膜融合, 染色质密度增高呈半月形(图3C).
胀亡是细胞的另一种死亡方式[6], 日益受到国内外学者的高度关注. 但目前对梗阻性黄疸时肝细胞死亡方式尤其胀亡的研究甚少, 而且对其确切的死亡方式持有不同的观点: Miyoshi et al[2]研究认为胆道梗阻后肝细胞死亡的主要形式是细胞凋亡, 但Fickert et al[3], Gujral et al[4]研究小鼠梗阻性黄疸模型时发现肝细胞死亡的主要类型是胀亡而不是凋亡. 这可能是因为胀亡和凋亡均可出现双链DNA断裂、跨膜电位减少等, 因此采用TUNEL、凝胶电泳和跨膜电位等方法均不能有效地区别这两种细胞[7]. 目前最佳的鉴别方法是采用形态学和AnnexinV-FITC与PI双染色并借助流式细胞仪进行鉴别. 因为胀亡细胞和早期凋亡细胞两者细胞膜上磷脂对称性改变使磷脂酰丝氨酸暴露于细胞膜外, 可特异性结合标记有FITC的AnnexinV, 因此单用此法不能特异地区别这两种细胞, 而PI不能进入细胞膜完整的细胞, 只能通过损伤的细胞膜结合在DNA双螺旋链之间. 双染后可鉴别这两种细胞[7]. 因此本实验应用流式细胞仪检测肝细胞胀亡和凋亡能准确地反映细胞死亡情况. 胀亡典型特征为细胞肿胀、核溶解、胞质空泡的形成, 类似细胞水变性等形态学改变. 染色质分散、凝集在核膜和/或核仁周围, 或聚集成团块; 细胞器肿胀尤以线粒体为著[8]. 胀亡是大量相邻细胞死亡, 在以前的病理学文献中表现为片状坏死现象[9]. 凋亡典型改变是胞质萎缩、核固缩、染色质新月形凝集和凋亡小体形成[1].
本实验结果显示, 大鼠急性胆道梗阻后血清胆红素、ALP和γ-GT水平均显著高于对照组, 说明梗阻性黄疸模型建立成功, 而且肝病理组织学检查亦进一步得到证实. 本研究发现急性胆道梗阻大鼠肝细胞死亡以胀亡为主, 凋亡相对较少. 这是因为细胞凋亡和胀亡与刺激强度、作用时间有关. 刺激强度较弱、作用时间较短时以凋亡为主; 反之, 细胞损伤相对严重时以胀亡为主. 还可能与凋亡是主动耗能过程、需要ATP, 而胀亡是被动性死亡、不需要能量有关[10]. 因此影响细胞ATP水平的因素可影响细胞死亡方式的选择[11].
胆道梗阻时肝脏胆盐和胆红素堆积, 破坏肝细胞能量代谢, 导致ATP含量下降, 引起肝细胞内钙超载, 激活胀亡膜特异性受体porimin, 其与配体结合后使膜通透性增加, 导致细胞胀亡[6]. 此外胆盐还可影响细胞膜ATP活性, 损害生物膜的功能, 导致细胞胀亡[12]. 能量代谢障碍还可生成大量自由基(ROS), 破坏细胞膜的完整性, 使之通透性增加, 造成肝细胞损伤. 肠道内胆盐缺乏以及sIgA分泌减少导致细菌和LPS大量入血引起肠源性内毒素血症[13-14]. 内毒素直接干扰肝细胞能量代谢, 抑制Na+-K+ATP酶活性, 此外还激活Kupffer细胞, 后者激活中性粒细胞产生大量ROS, 导致肝细胞损伤[15]. 内毒素还可促使Kupffer细胞、内皮细胞与中性粒细胞释放白三烯、TNF-α、白细胞介素、NO等导致肝脏微循环障碍, 引起组织损伤[16-19]. 此外肝纤维化、微循环紊乱以及肝窦血供减少均进一步加剧肝细胞"能源危机", 促使其胀亡[20-22]. 因此胆道梗阻导致肝细胞能量代谢障碍, ATP产生不足, 细胞无法全部完成凋亡, 进而选择细胞胀亡, 表现在本实验中肝细胞死亡以胀亡为主且较对照组明显增加, 凋亡反而相对较少. 肝细胞凋亡增加与凋亡机制的启动有关[23-30]. 例如胆盐中的甘氨鹅脱氧胆酸钠(GCDC)可通过蛋白激酶C介导肝细胞凋亡, 随着GCDC浓度增高, 细胞凋亡率增加[28-30]. 然而, 细胞胀亡和凋亡有许多相似之处, 存在某些共同信号通路如Fas, caspases等, 但有关胀亡的具体分子机制如基因调控等还不清楚, 有待进一步研究[11,31].
总之, 急性胆道梗阻大鼠肝细胞死亡方式以胀亡为主, 且肝功能损伤程度与肝细胞胀亡、凋亡有密切关系.
急性胆道梗阻往往导致不同程度的肝功能损伤甚至急性肝功能衰竭, 其损伤的确切作用机制尚不清楚. 胀亡和凋亡是细胞的两种死亡方式, 但目前对急性胆道梗阻时肝细胞的死亡方式仍存在争议.
胀亡有别于凋亡, 是目前细胞死亡方式的研究热点, 但其确切的作用机制有待进一步研究.
自从1995年提出胀亡概念后, 陆续有相关文献报道. 但对梗阻性黄疸肝细胞死亡方式仍不是很明确, 有的研究认为胆道梗阻后肝细胞死亡的主要形式是细胞凋亡, 但也有的研究梗阻性黄疸时肝细胞死亡的主要类型是胀亡而不是凋亡.
本研究结果将对梗阻性黄疸肝脏损伤作用机制的研究具有指导意义, 提供新的研究思路和方向.
胀亡(oncosis): 是细胞的另一种死亡方式, 其典型特征是细胞肿胀、核溶解、胞质空泡的形成等形态学改变. 同凋亡一样, 胀亡亦可出现双链DNA断裂、跨膜电位减少等.
本文对急性梗阻性黄疸大鼠肝细胞死亡方式进行了初步研究, 发现胀亡可能是细胞死亡的主要方式. 对研究该类病理生理机制具有一定的意义. 文章设计较合理, 数据结果可靠, 结论较科学.
电编: 张敏 编辑:张焕兰
| 1. | Majno G, Joris I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 1995;146:3-15. [PubMed] |
| 2. | Miyoshi H, Rust C, Roberts PJ, Burgart LJ, Gores GJ. Hepatocyte apoptosis after bile duct ligation in the mouse involves Fas. Gastroenterology. 1999;117:669-677. [PubMed] |
| 3. | Fickert P, Trauner M, Fuchsbichler A, Zollner G, Wagner M, Marschall HU, Zatloukal K, Denk H. Oncosis represents the main type of cell death in mouse models of cholestasis. J Hepatol. 2005;42:378-385. [PubMed] |
| 4. | Gujral JS, Liu J, Farhood A, Jaeschke H. Reduced oncotic necrosis in Fas receptor-deficient C57BL/6J-lpr mice after bile duct ligation. Hepatology. 2004;40:998-1007. [PubMed] |
| 5. | Yoshidome H, Miyazaki M, Shimizu H, Ito H, Nakagawa K, Ambiru S, Nakajima N, Edwards MJ, Lentsch AB. Obstructive jaundice impairs hepatic sinusoidal endothelial cell function and renders liver susceptible to hepatic ischemia/reperfusion. J Hepatol. 2000;33:59-67. [PubMed] |
| 6. | Ma F, Zhang C, Prasad KV, Freeman GJ, Schlossman SF. Molecular cloning of Porimin, a novel cell surface receptor mediating oncotic cell death. Proc Natl Acad Sci USA. 2001;98:9778-9783. [PubMed] |
| 7. | Van Cruchten S, Van Den Broeck W. Morphological and biochemical aspects of apoptosis, oncosis and necrosis. Anat Histol Embryol. 2002;31:214-223. [PubMed] |
| 8. | Elsasser A, Suzuki K, Schaper J. Unresolved issues regarding the role of apoptosis in the pathogenesis of ischemic injury and heart failure. J Mol Cell Cardiol. 2000;32:711-724. [PubMed] |
| 9. | Kerr JF, Cooksley WG, Searle J, Halliday JW, Halliday WJ, Holder L, Roberts I, Burnett W, Powell LW. The nature of piecemeal necrosis in chronic active hepatitis. Lancet. 1979;2:827-828. [PubMed] |
| 10. | Levin S. Apoptosis, necrosis, or oncosis: what is your diagnosis? A report from the Cell Death Nomenclature Committee of the Society of Toxico-logic Pathologists. Toxicol Sci. 1998;41:155-156. [PubMed] |
| 11. | Takeda M, Shirato I, Kobayashi M, Endou H. Hydrogen peroxide induces necrosis, apoptosis, oncosis and apoptotic oncosis of mouse terminal proximal straight tubule cells. Nephron. 1999;81:234-238. [PubMed] |
| 12. | Alpini G, Ueno Y, Glaser SS, Marzioni M, Phinizy JL, Francis H, Lesage G. Bile acid feeding increased proliferative activity and apical bile acid transporter expression in both small and large rat cholangiocytes. Hepatology. 2001;34:868-876. [PubMed] |
| 14. | Margaritis VG, Filos KS, Michalaki MA, Scopa CD, Spiliopoulou I, Nikolopoulou VN, Vagianos CE. Effect of oral glutamine administration on bacterial tanslocation, endotoxemia, liver and ileal morphology, and apoptosis in rats with obstructive jaundice. World J Surg. 2005;29:1329-1334. [PubMed] |
| 15. | Koyama K, Takagi Y, Ito K, Sato T. Experimental and clinical studies on the effect of biliary drainage in obstructive jaundice. Am J Surg. 1981;142:293-299. [PubMed] |
| 16. | Sheen-Chen SM, Chau P, Harris HW. Obstructive jaundice alters Kupffer cell function independent of bacterial translocation. J Surg Res. 1998;80:205-209. [PubMed] |
| 17. | Rockey D. The cellular pathogenesis of portal hypertension: stellate cell contractility, endothelin, and nitric oxide. Hepatology. 1997;25:2-5. [PubMed] |
| 18. | Wei CL, Hon WM, Lee KH, Khoo HE. Temporal expression of hepatic inducible nitric oxide synthase in liver cirrhosis. World J Gastroenterol. 2005;11:362-367. [PubMed] |
| 20. | Beno DW, Espinal R, Edelstein BM, Davis BH. Administration of prostaglandin E1 analog reduces rat hepatic and Ito cell collagen gene expression and collagen accumulation after bile duct ligation injury. Hepatology. 1993;17:707-714. [PubMed] |
| 21. | Gujral JS, Farhood A, Bajt ML, Jaeschke H. Neutrophils aggravate acute liver injury during obstructive cholestasis in bile duct-ligated mice. Hepatology. 2003;38:355-363. [PubMed] |
| 22. | Ito Y, Bethea NW, Baker GL, McCuskey MK, Urbaschek R, McCuskey RS. Hepatic microcircu-latory dysfunction during cholestatic liver injury in rats. Microcirculation. 2003;10:421-432. [PubMed] |
| 23. | Wang DS, Dou KF, Li KZ, Gao ZQ, Song ZS, Liu ZC. Hepatocellular apoptosis after hepatectomy in obstructive jaundice in rats. World J Gastroenterol. 2003;9:2737-2741. [PubMed] |
| 24. | Scaffidi C, Fulda S, Srinivasan A, Friesen C, Li F, Tomaselli KJ, Debatin KM, Krammer PH, Peter ME. Two CD95 (APO-1/Fas) signaling pathways. EMBO J. 1998;17:1675-1687. [PubMed] |
| 25. | Yin XM. Bid, a critical mediator for apoptosis induced by the activation of Fas/TNF-R1 death receptors in hepatocytes. J Mol Med. 2000;78:203-211. [PubMed] |
| 26. | Hatano E, Bradham CA, Stark A, Iimuro Y, Lemasters JJ, Brenner DA. The mitochondrial permeability transition augments Fas-induced apoptosis in mouse hepatocytes. J Biol Chem. 2000;275:11814-11823. [PubMed] |
| 27. | Sheen-Chen SM, Ho HT, Chen WJ, Eng HL. Effect of ZVAD-fmk on hepatocyte apoptosis after bile duct ligation in rat. World J Gastroenterol. 2005;11:2330-2333. [PubMed] |
| 29. | Wang JM, Wang H, Xu LN, Zou SQ. Hepatic injury in rats with obstructive jaundice: roles of the protein kinase C signal pathway and cytoprotection of fructose. Hepatobiliary Pancreat Dis Int. 2005;4:577-581. [PubMed] |
| 30. | Gonzalez B, Fisher C, Rosser BG. Glycocheno-deoxycholic acid (GCDC) induced hepatocyte apoptosis is associated with early modulation of intracellular PKC activity. Mol Cell Biochem. 2000;207:19-27. [PubMed] |
| 31. | Gujral JS, Knight TR, Farhood A, Bajt ML, Jaeschke H. Mode of cell death after acetaminophen overdose in mice: apoptosis or oncotic necrosis? Toxicol Sci. 2002;67:322-328. [PubMed] |