修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-01-28
目的: 观察5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycitydine, 5-Aza-CdR)对体外培养的胃癌SGC7901细胞和BGC823细胞增生、细胞周期和凋亡的影响及其对此两株细胞中Apaf-1基因的甲基化状态的影响.
方法: 不同浓度5-Aza-CdR处理体外培养的SGC7901细胞和BGC823细胞后, 用MTT法检测处理24, 48和72 h的细胞增殖活性; PI染色和流式细胞仪检测药物处理后72 h细胞周期分布和细胞凋亡率; MSP法检测用药前后细胞中Apaf-1基因的甲基化状态; RT-PCR法及 Western blot法检测用药前后细胞中Apaf-1的mRNA及蛋白表达的变化.
结果: 1×10-7, 5×10-7, 1×10-6和5×10-6 mol/L 5-Aza-CdR处理SGC7901和BGC823细胞24, 48, 72 h后, 细胞增生受到抑制, 有时间和剂量的依赖性. 流式细胞仪分析表明, 各药物浓度处理72 h后凋亡率增加明显: SGC7901细胞5×10-7, 1×10-6和5×10-6 mol/L组分别为2.53%±1.19%, 5.93%±0.86%, 10.14%±1.51%, 与对照组(0.12%±0.03%)相比差异显著(P<0.05); BGC823细胞5×10-7, 1×10-6和5×10-6 mol/L组分别为1.57%±0.26%, 4.64%±1.05%, 8.21%±1.46%, 与对照组(0.57%±0.03%)相比差异显著(P<0.05). 在5-Aza-CdR处理前未检测到SGC7901细胞系及BGC823细胞系的Apaf-1基因的mRNA及蛋白表达, 经过5-Aza-CdR处理后, Apaf-1基因在SGC7901细胞系及BGC823细胞系中甲基化状态得到了逆转, Apaf-1基因的mRNA及蛋白重新表达.
结论: 5-Aza-CdR对SGC7901细胞和BGC823细胞具有增生抑制作用; Apaf-1基因的表达情况与其甲基化状态的改变有关.
引文著录: 王贺玲, 王学清, 李岩, 孙军. 5-Aza-CdR对胃癌细胞系生长及Apaf-1基因异常甲基化的影响. 世界华人消化杂志 2007; 15(3): 221-227
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: January 28, 2007
AIM: To observe the effects of 5-aza-2'-deoxycitydine (5-Aza-CdR) on the proliferation of human gastric cancer cell lines SGC7901 and BGC823 as well as the methylation and epression of Apaf-1 gene.
METHODS: Human gastric cancer cell lines SGC7901 and BGC823 were cultured in RPMI1640 and then treated with different concentrations of 5-Aza-CdR (1 × 10-7, 5 × 10-7, 1 × 10-6 and 5 × 10-6 mol/L). The proliferation of the cells was detected by MTT assay and flow cytometry (FCM). The methylation of Apaf-1 gene in the two kinds of cell lines was detected by methylation-specific-polymerase chain reaction (MSP), and the expression of Apaf-1 was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Westen blot analysis.
RESULTS: 5-Aza-CdR displayed a growth inhibitory effect on SGC7901 and BGC823 cells in a dose- and time-dependent manner after exposure to 5-Aza-CdR at different concentrations (1 × 10-7, 5 × 10-7, 1 × 10-6, 5 × 10-6 mol/L) for 24, 48 and 72 hours. FCM analysis showed that the apoptosis rates in SGC7901 cells (2.53% ± 1.19%, 5.93% ± 0.86%, 10.14% ± 1.51%) and BGC823 cells (1.57% ± 0.26%, 4.64% ± 1.05%, 8.21% ± 1.46%) were increased significantly after exposure to 5-Aza-CdR (5 × 10-7, 1 × 10-6, 5 × 10-6 mol/L) for 72 hours as compared with 0.12% ± 0.03% and 0.57% ± 0.03% in the control cells (P < 0.05). The methylation and loss of Apaf-1 mRNA and protein expression were detected in SGC7901 and BGC823 cells before 5-Aza-CdR treatment. However, the methylation was reversed and Apaf-1 was re-expressed after 5-Aza-CdR treatment.
CONCLUSION: 5-Aza-CdR can inhibit the proliferation of SGC7901 and BGC823 cells through blocking cell cycles and inducing cell apoptosis, during which the reversion of Apaf-1 gene methylation plays an important role.
- Citation: Wang HL, Wang XQ, Li Y, Sun J. Effects of 5-aza-2'-deoxycitydine on proliferation of human gastric cancer cell lines and abnormal methylation of Apaf-1 gene. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 221-227
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/221.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.221
胃癌是一种严重威胁人类健康的恶性肿瘤, 国内外大量的资料显示[1-7], 胃癌的发生与其他恶性肿瘤一样是多基因、多阶段变异累积形成的病理过程, 这些基因主要是促进肿瘤发生的癌基因和抑制肿瘤发生的抑癌基因, 以及维持基因组稳定的DNA错配修复基因等. 抑癌基因功能的丢失可通过多种途径, 除基因突变和杂合性丢失以外还与其启动子发生甲基化修饰有关[8-11]. Apaf-1是已经确认的抑癌基因[12-14], 在细胞凋亡过程中起着重要作用, 我们通过此基因在SGC7901细胞系及BGC823细胞系中的甲基化的状态以及在改变他们甲基化状态后的表达的改变及与SGC7901细胞生长状态的关系, 进一步探讨该抑癌基因的表达与其甲基化状态的相关性.
SGC7901细胞系、BGC823细胞系购自中国医科大学细胞生物教研室, 5-氮杂-2'-脱氧胞苷(5-aza-2'-deoxycitydine, 5-Aza-CdR)、碘化丙啶(PI)为Sigma产品, 总RNA抽提试剂TRIzol购自Invitrogen公司, RT-PCR试剂盒购自TaKaRa公司, RPMI1640培养基为Hyclone产品, Apaf-1绵羊抗人Ab(Santa Cruz产品), Taq酶及dNTP均为TaKaRa公司产品, Wizard DNA Clean-up (Promega公司).
SGC7901胃癌细胞株在含100 mL/L新生牛血清的RPMI1640中, 37℃, 50 mL/L CO2条件下培养. 在细胞传代24 h后, 将5-Aza-CdR按1×10-7, 5×10-7, 1×10-6和5×10-6 mol/L的浓度配制的培养液分别加入培养瓶中, 待24, 48和72 h后分别回收细胞, 进行实验.
1.2.1 四唑盐(MTT)比色法测定5-Aza-CdR对SGC7901和BGC823增殖活性的影响: 取处理前的对数生长期的细胞, 按每孔接种200 μL细胞培养液(1×103个细胞/100 μL)接种于96孔板, 共接种5板, 每组6孔, 接种24 h后去上清液, 加入含5-Aza-CdR浓度分别为1×10-7, 5×10-7, 1×10-6, 5×10-6 mol/L的培养液继续放入CO2孵箱, 在37℃, 50 mL/L CO2及饱和湿度下继续培养, 以后在24, 48和72 h各时间点分别取一板, 每孔加入MTT溶液(5 g/L) 20 μL, 继续培养4 h, 终止培养, 去除孔内上清液, 每孔加入150 μL二甲基亚砜(DMSO), 震荡10 min, 选择570 nm波长, 在酶标仪上测定各孔光吸收值(A), 其增殖能力大小以平均吸光度(A)值分析. 以未加5-Aza-CdR干预的细胞为对照组.
1.2.2 流式细胞仪(FCM)检测细胞周期: 在细胞传代24 h后, 将5-Aza-CdR按1×10-7, 5×10-7, 1×10-6和5×10-6 mol/L的浓度配制的培养液分别加入培养瓶中, 对照组重新换普通培养液, 待72 h后分别回收细胞, 以胰酶消化法收集并4℃离心(1000 r/min, 5 min)细胞, PBS清洗3次, 700 mL/L冰乙醇固定, 用RNaseA(终浓度为0.1 g/L)消化30 min, 加入0.05 g/L碘化丙啶(PI) 250 μL, 室温避光染色30 min后上机检测. 测定细胞周期及细胞凋亡率, 每组实验重复5次.
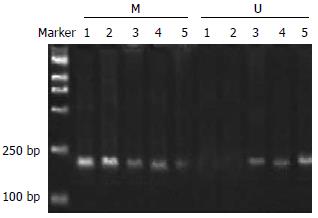
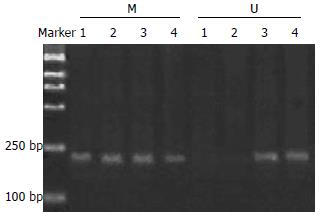
1.2.3 MSP方法检测胃癌细胞株中Apaf-1的甲基化状态: 应用饱和酚-氯仿抽提各组SGC7901细胞及BGC823细胞基因组DNA, 取20 μg DNA溶于45 μL去离子水中, 加入3 mol/L的NaOH 5 μL 75℃ 15 min后, 立即放在冰上, 经新鲜配制60 mmol/L的5 μL氢醌, 4.8 mol/L的亚硫酸钠320 μL处理, 55℃水浴过夜, 用Wizard DNA Clean-up(Promega公司)纯化回收DNA用于甲基化特异PCR分析. 甲基化特异PCR引物[12]设计选择位于Apaf-1 cDNA启动子富含CpG(CpG表示指C, G以磷酸基连接)的49-378位碱基区域, 设计引物. 上游引物: 5'-GAGGTGTCGTAGCGGTATTC-3'. 下游引物: 5'-CGAAAATTAACGAAATAAACGTC-3' PCR反应条件: 94℃变性45 s, 61℃复性45 s, 72℃延伸60 s, 共38个循环, 扩增长度为212 bp. 非甲基化引物上游5'-ATTTGAGGTGTTGTAGTGGTATTTG-3'. 下游引物: 5'-ACCTCCAAAAATTAACAAAATAAACAT-3'. 循环条件: 94℃变性45 s, 60℃复性45 s, 72℃延伸60 s, 共38个循环. 扩增长度为221 bp.
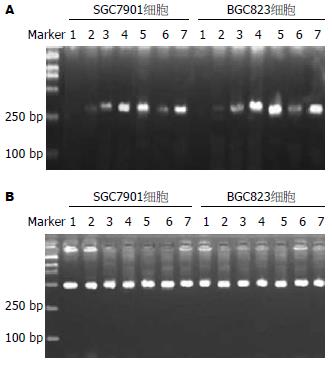
1.2.4 半定量RT-PCR分析Apaf-1的表达: 用TRIzol试剂提取各组SGC7901细胞及BGC823细胞总RNA. 用逆转录酶和Oliga(dT)20引物合成cDNA. Apaf-1引物序列应用Primer3设计[12], 包含CARD(caspase recruitment domain)功能域, 上游引物: 5'-TTGCTGCCCTTCTCCATGAT-3'. 下游引物: 5'-TCCCAACTGAAACCCAATGC-3', 扩增长度为334 bp. 以β-actin为内参, 上游引物: 5'-GTGGGGCGCCCCAGGCACCA-3'. 下游引物: 5'-CTCCTTAATGTCACGCACGATTTC-3', 扩增长度为498 bp. 两对引物均加入25 μL反应体系中, PCR反应条件为94℃变性45 s, 58℃复性45 s, 72℃延伸60 s, 共35个循环. RT-PCR产物经20 g/L琼脂糖胶分离, 用Alpha Image 2000自动成像仪摄影, 用Fluorchem V 2.0 Stand Alone软件分析RT-PCR产量.
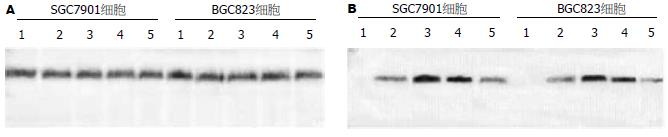
1.2.5 Western blot分析各组细胞Apaf-1蛋白表达情况: 提取总蛋白, 定量. 取100 mg总蛋白变性10 min后, 以聚丙烯酰胺凝胶电泳, 蛋白电泳分离后移至PVDF膜. 50 g/L脱脂奶粉室温封闭1 h, PVDF膜置于1:250稀释的一抗(羊抗人, Apaf-1, Santa Cruz公司产品)稀释液中, 4℃过夜, 再置于1:4500稀释的二抗(抗羊, IgG-, 北京中杉金桥生物公司产品)稀释液中, 37℃孵育1 h, 化学发光, 显影, 定影.
统计学处理 结果以均数±标准差(mean±SD)表示, 所得数据用成组设计数据的t检验进行分析.
经1×10-7, 5×10-7, 1×10-6和5×10-6 mol/L 4个浓度5-Aza-CdR处理48 h后, SGC7901和BGC823两株细胞的生长增殖活性均有明显抑制, 并且随浓度的增加其抑制的量效关系显著(表1).
| 5-Aza-CdR浓度(mol/L) | SGC7901细胞光吸收度(A) | BGC823细胞光吸收度(A) | ||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| 对照组 | 0.338±0.064 | 0.417±0.036 | 0.533±0.073 | 0.332±0.027 | 0.453±0.049 | 0.651±0.059 |
| 1×10-7 | 0.305±0.052 | 0.353±0.045a | 0.419±0.022a | 0.296±0.042 | 0.400±0.032 | 0.538±0.068a |
| 5×10-7 | 0.319±0.061 | 0.369±0.035a | 0.420±0.031a | 0.294±0.096 | 0.391±0.021a | 0.526±0.113a |
| 1×10-6 | 0.304±0.038 | 0.337±0.079a | 0.413±0.029a | 0.307±0.070 | 0.389±0.044a | 0.509±0.055a |
| 5×10-6 | 0.259±0.044a | 0.309±0.061a | 0.395±0.039a | 0.276±0.039a | 0.375±0.063a | 0.469±0.059a |
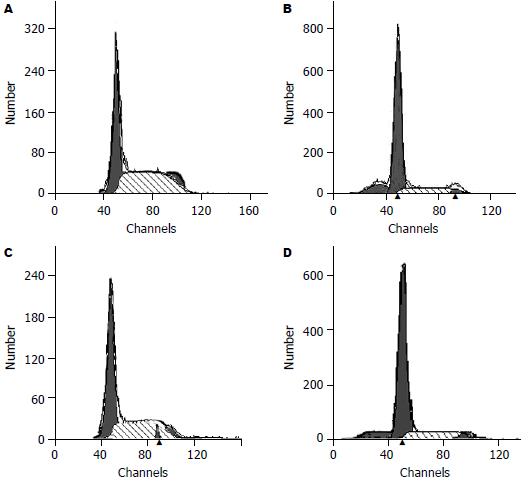
流式细胞仪分析显示, SGC7901, BGC823细胞经药物5-Aza-CdR处理后1×10-7 mol/L浓度组的G0/G1的细胞数量无明显的变化, 凋亡率略有增加, 而5×10-7, 1×10-6, 5×10-6 mol/L组G0/G1的细胞数量逐渐增加, S期细胞数下降, 凋亡率增加明显. 根据上述结果, 考虑药物作用在G0/G1, 使细胞停滞在此期, 凋亡细胞率升高(表2, 图1).
| 细胞 | 5-Aza-CdR浓度(mol/L) | G0/G1期 | S期 | G2期 | 凋亡率 |
| SGC7901 | 对照组 | 57.17±2.22 | 37.27±2.40 | 5.67±0.70 | 0.12±0.03 |
| 1×10-7 | 57.53±1.72 | 37.01±1.12 | 5.46±0.70 | 0.14±0.02 | |
| 5×10-7 | 61.51±0.87a | 33.35±1.30 | 5.13±0.49 | 2.53±1.19a | |
| 1×10-6 | 65.91±1.90a | 29.09±1.35a | 5.00±0.70 | 5.93±0.86a | |
| 5×10-6 | 73.45±2.36a | 21.78±2.07a | 4.17±0.91 | 10.14±1.51a | |
| BGC823 | 对照组 | 56.83±1.38 | 35.50±0.66 | 7.67±0.90 | 0.57±0.03 |
| 1×10-7 | 59.10±2.01 | 34.23±2.36 | 6.67±0.93 | 0.07±0.04 | |
| 5×10-7 | 62.17±2.10a | 32.23±1.86a | 5.60±0.80 | 1.57±0.26a | |
| 1×10-6 | 65.40±0.98a | 28.87±0.65a | 5.73±1.01 | 4.64±1.05a | |
| 5×10-6 | 73.53±1.63a | 21.77±2.25a | 4.70±0.62 | 8.21±1.46a |
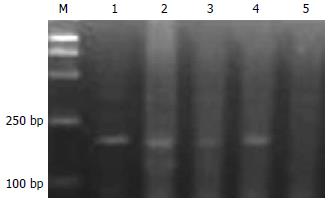
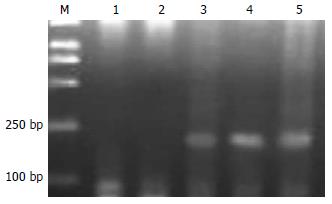
Apaf-1基因在SGC7901细胞系及BGC823细胞系中均为甲基化的纯合子, 而在经过5-Aza-CdR处理后, 则出现了杂合状态, 即该基因甲基化得到了逆转, 并且去甲基化的程度与时间及用药剂量均有一定的依赖性(图2-6).
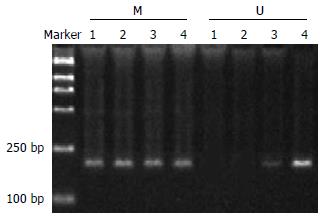
5-Aza-CdR处理前SGC7901细胞系及BGC823细胞系的Apaf-1基因的mRNA未检测到表达, 在经5-Aza-CdR处理后, Apaf-1基因mRNA重新表达, 5×10-7和1×10-6 mmol/L的5-Aza-CdR处理组尤为明显, 并且在用药48, 72 h后, 该基因表达明显上升的趋势(图7).
5-Aza-CdR处理前后SGC7901细胞系及BGC823细胞系的Apaf-1基因的蛋白表达与mRNA的表达趋势一致, 在用药前无Apaf-1基因蛋白的表达, 用药后, 蛋白表达明显增高, 其灰度值均上升30%以上, 而5×10-7和1×10-6 mmol/L的5-Aza-CdR处理组尤为明显, 并且在用药48和72 h后, 该基因表达明显上升(图8).
因甲基化导致转录灭活的基因对DNA甲基化抑制剂非常敏感, 易重新活化[15-20]. 理论上, 细胞基因如果仅出现高甲基化而无突变或缺失, 在去甲基化后基因能重新表达. 甲基化抑制剂是胞苷类似物5-Aza-CdR, 他的作用机制是能与DNA甲基转移酶共价结合, 降低DNA甲基转移酶的生物活性. 该药物目前已应用于白血病的治疗, 并取得了一定疗效[21-22], 该药物对其他基因的去甲基化作用亦有多篇报道[23-25]. 本研究证实, 5-Aza-CdR对人胃癌细胞系SGC7901及BGC823有显著的增殖抑制和诱导凋亡的作用并呈浓度和时间依赖性. 随着5-Aza-CdR的浓度与作用时间的增长, G0/G1期细胞逐渐增加, 出现G0/G1期阻滞, 凋亡细胞显著增多.
肿瘤细胞凋亡受众多凋亡相关基因调控, 而凋亡有两条独立的途径: 一是死亡受体途径, 另一个是线粒体介导的凋亡途径. Apaf-1是作用在线粒体介导的凋亡途径中, 不同形式的细胞刺激信号促使线粒体释放细胞色素C, 后者在dATP/ATP存在的情况下结合信号接头分子Apaf-1, 启动Casp级联反应, 裂解核蛋白、细胞骨架、内质网等, 造成凋亡典型的形态学改变[26-27]. 目前, 该基因被认作是凋亡的核心, 是确切的抑癌基因[28-30]. 本实验用5-Aza-CdR作用于用MSP方法检测以证实Apaf-1存在甲基化的SGC7901细胞, BGC823细胞, 发现该药物能成功逆转Apaf-1基因启动子的甲基化状态, 使该基因得以开放, Apaf-1的mRNA和蛋白得以重新表达, 并且存在对该药物的作用时间和浓度的一定的相关性, 但是以药物浓度5×10-7 mmol/L和10-6 mmol/L在用药48和72 h效果最好, 并且基因的表达状况与细胞的生长状况平行. 由此证明, 5-Aza-CdR能够使SGC7901细胞, BGC823细胞中Apaf-1基因去甲基化, 使基因恢复其转录活性, 从而能够发挥Apaf-1的肿瘤抑制作用. 另外也证明该基因在此两株细胞中蛋白表达下降是与该基因的甲基化存在明确的关系, 而对该基因的蛋白表达调控主要存在DNA转录途径.
总之, 5-Aza-CdR抑制胃癌细胞SGC7901, BGC823增殖及诱导凋亡的机制可能与干扰细胞周期、提高Apaf-1基因表达有关. 我们认为, Apaf-1基因在胃癌细胞系中的失表达与其启动子CpG岛的异常甲基化修饰有关, 5-Aza-CdR去甲基化能恢复Apaf-1基因的功能. 这也为胃癌的诊断及去甲基化治疗提供了依据.
胃癌是我国主要恶性肿瘤之一, 其发病机制并不完全清楚, 而基因的表观遗传学的改变是近年来研究的热点; Apaf-1基因是重要的抑癌基因, 是凋亡的核心, 但关于该基因与胃癌的关系的研究并未见报道.
Apaf-1基因的失活存在于许多肿瘤中, 他的失活机制包括缺失和启动子甲基化等, 而启动子甲基化的研究属于表观遗传学的范畴, 是近年来研究的热点, 5-Aza-CdR是去甲基化药物, 已经用于治疗白血病, 对实体瘤的治疗也有大量的研究, 但其作用机制仍需进一步探讨.
Apaf-1是作用在线粒体介导的亡途径中的亡因子, Le o, Mustika et al通过研究认为该基因被认作是凋亡的核心, 是确切的抑癌基因, 而许多报道证实该基因在多数肿瘤中的启动子甲基化状态, 是其表达失活的主要原因.
本实验在既往研究的基础上首次证实5-Aza-CdR对胃癌中高甲基化的Apaf-1基因有去甲基化的作用并使该基因的 mRNA 的表达和蛋白表达水平均上调, 为胃癌去甲基化治疗提供了依据.
本实验提示可用去甲基化药物治疗实体肿瘤, 提示了5-Aza-CdR治疗胃癌的一个分子水平的药理作用, 对胃癌去甲基化治疗及今后研究提供了一定的理论依据.
表观遗传学: 1939 年由Waddington首先提出, 目前认为表遗传学是研究没有DNA序列变化, 可遗传的基因表达(活性)的改变. 主要涉及 DNA甲基化作用的改变和染色质组蛋白的修饰作用(乙酰化、甲基化、磷酸化)、基因印记等. 研究表明肿瘤细胞基因组的异常甲基化, 染色质组蛋白的异常修饰及印记基因异常等表遗传学改变同样参与细胞癌变这一过程, 并成为肿瘤细胞的一个重要特征. HSC活化: 是指肝脏损伤时, HSC受到各种致病因子的刺激, 从静息状态转化为具有增生性、纤维原性和可收缩性的肌成纤维细胞. 其中 α-SMA的表达为其激活的标志, 表达量的大小可用来衡量HSC的激活程度.
本文通过5-Aza-CdR 对胃癌细胞系生长及Apaf-1基因异常甲基化的影响, 探讨5-Aza-CdR对胃癌细胞周期及诱导凋亡的作用, 以及Apaf-1基因表达与甲基化在致癌中的作用. 本研究思路清晰, 科学性较强, 结果可信, 有一定价值.
电编: 张敏 编辑:王晓瑜
| 1. | Guzman P, Araya J, Villaseca M, Roa I, Melo A, Munoz S, Roa J. Immunohistochemical expression of the E-cadherin-catenin complex in gastric cancer. Rev Med Chil. 2006;134:1002-1009. [PubMed] |
| 2. | Nakajima T, Maekita T, Oda I, Gotoda T, Yamamoto S, Umemura S, Ichinose M, Sugimura T, Ushijima T, Saito D. Higher methylation levels in gastric mucosae significantly correlate with higher risk of gastric cancers. Cancer Epidemiol Biomarkers Prev. 2006;15:2317-2321. [PubMed] |
| 3. | Li M, Liu W, Zhu YF, Chen YL, Zhang BZ, Wang R. Correlation of COX-2 and K-ras expression to clinical outcome in gastric cancer. Acta Oncol. 2006;45:1115-1119. [PubMed] |
| 4. | Tang LP, Cho CH, Hui WM, Huang C, Chu KM, Xia HH, Lam SK, Rashid A, Wong BC, Chan AO. An Inverse Correlation between Interleukin-6 and Select Gene Promoter Methylation in Patients with Gastric Cancer. Digestion. 2006;74:85-90. [PubMed] |
| 5. | Ma B, Zhao JS, Ding DY. Application of proteomics in the research of discrepancy proteins in gastric cancer. Zhonghua Wei Chang Wai Ke Za Zhi. 2006;9:534-537. [PubMed] |
| 6. | Ding YB, Xia JG, Chen GY. Effect of spleen tyrosine kinase expression re-activation by inhibition of DNA methylation on oncogenesis growth of gastric cancer. Zhonghua Wei Chang Wai Ke Za Zhi. 2006;9:523-526. [PubMed] |
| 7. | Nzengue JC, Zhan WH, Wang JP, Dong WG, Lan P, He YL, Chen ZX, Cai SR. Metastasis rates of lymph nodes and distribution in advanced gastric cancer and its clinical significance. Zhonghua Wei Chang Wai Ke Za Zhi. 2006;9:506-509. [PubMed] |
| 11. | Bender CM, Pao MM, Jones PA. Inhibition of DNA methylation by 5-aza-2'-deoxycytidine suppresses the growth of human tumor cell lines. Cancer Res. 1998;58:95-101. [PubMed] |
| 13. | Yu J, Zhang HY, Ma ZZ, Lu W, Wang YF, Zhu JD. Methylation profiling of twenty four genes and the concordant methylation behaviours of nineteen genes that may contribute to hepatocellular carcinogenesis. Cell Res. 2003;13:319-333. [PubMed] |
| 14. | Furukawa Y, Sutheesophon K, Wada T, Nishimura M, Saito Y, Ishii H, Furukawa Y. Methylation silencing of the Apaf-1 gene in acute leukemia. Mol Cancer Res. 2005;3:325-334. [PubMed] |
| 15. | Jones PA. DNA methylation errors and cancer. Cancer Res. 1996;56:2463-2467. [PubMed] |
| 16. | Okino ST, Pookot D, Li LC, Zhao H, Urakami S, Shiina H, Igawa M, Dahiya R. Epigenetic inactivation of the dioxin-responsive cytochrome P4501A1 gene in human prostate cancer. Cancer Res. 2006;66:7420-7428. [PubMed] |
| 17. | Wu Y, Meng L, Wang H, Xu Q, Wang S, Wu S, Xi L, Zhao Y, Zhou J, Xu G. Regulation of DNA methylation on the expression of the FHIT gene contributes to cervical carcinoma cell tumorigenesis. Oncol Rep. 2006;16:625-629. [PubMed] |
| 18. | Zhang X, Yashiro M, Ohira M, Ren J, Hirakawa K. Synergic antiproliferative effect of DNA methyltrans-ferase inhibitor in combination with anticancer drugs in gastric carcinoma. Cancer Sci. 2006;97:938-944. [PubMed] |
| 19. | Zheng QH, Ma LW, Zhu WG, Zhang ZY, Tong TJ. p21Waf1/Cip1 plays a critical role in modulating senescence through changes of DNA methylation. J Cell Biochem. 2006;98:1230-1248. [PubMed] |
| 20. | Stresemann C, Brueckner B, Musch T, Stopper H, Lyko F. Functional diversity of DNA methyltransferase inhibitors in human cancer cell lines. Cancer Res. 2006;66:2794-2800. [PubMed] |
| 21. | Wijermans PW, Krulder JW, Huijgens PC, Neve P. Continuous infusion of low-dose 5-Aza-2'-deoxycytidine in elderly patients with high-risk myelodysplastic syndrome. Leukemia. 1997;11:1-5. [PubMed] |
| 22. | Momparler RL. Epigenetic therapy of cancer with 5-aza-2'-deoxycytidine (decitabine). Semin Oncol. 2005;32:443-451. [PubMed] |
| 24. | 党 艳丽, 马 晓旗, 毕 红梅, 郑 维国, 辛 小燕. 5-氮胞苷对宫颈癌细胞系DAPK1异常甲基化的影响. 西安交通大学学报(医学版). 2005;26:48-51. |
| 26. | Liu X, Kim CN, Yang J, Jemmerson R, Wang X. Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell. 1996;86:147-157. [PubMed] |
| 27. | Li P, Nijhawan D, Budihardjo I, Srinivasula SM, Ahmad M, Alnemri ES, Wang X. Cytochrome c and dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade. Cell. 1997;91:479-489. [PubMed] |
| 28. | Leo C, Richter C, Horn LC, Schutz A, Pilch H, Hockel M. Expression of Apaf-1 in cervical cancer correlates with lymph node metastasis but not with intratumoral hypoxia. Gynecol Oncol. 2005;97:602-606. [PubMed] |
| 29. | Mustika R, Budiyanto A, Nishigori C, Ichihashi M, Ueda M. Decreased expression of Apaf-1 with progression of melanoma. Pigment Cell Res. 2005;18:59-62. [PubMed] |
| 30. | Shi Y. Mechanical aspects of apoptosome assembly. Curr Opin Cell Biol. 2006;18:677-684. [PubMed] |