修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-01-28
目的: 探讨大鼠原代肝星状细胞(HSC)体外培养过程中, 不同时期外源性转化生长因子β1(TGF-β1)对其活化的影响及相关因素的变化.
方法: 分离大鼠原代HSC, 于无包被的塑料培养板上分别培养2, 3, 4, 5, 6, 7 d时予TGF-β1 5 mg/L处理24 h, 倒置显微镜下观察细胞的形态变化, 应用Western blot法检测处理前后细胞a-肌动蛋白(a-SMA)的变化, 及活化过程中TGF-β1Ⅱ型受体(TβR-Ⅱ)的表达.
结果: HSC在体外培养过程中, 不同培养时间对TGF-β1的刺激活化作用反应不同. TGF-β1处理后, 对培养2, 3, 4, 5 d HSC的活化有促进作用, 以对培养第3天的细胞作用最明显, 其a-SMA表达增加78.05%, 而培养6, 7 d的HSC的形态和a-SMA变化不明显. 培养第7天的HSC比培养第3天的细胞TβR-Ⅱ表达增高(3.30±0.83 vs 1.55±0.38, P<0.05).
结论: TGF-β1对处部分活化状态中某阶段细胞的活化具有促进作用. 完全活化的细胞对TGF-β1的刺激活化作用不敏感, 原因与TβR-Ⅱ的表达量无关.
引文著录: 陈达凡, 李建英, 郑伟达, 陈治新, 王小众. 外源性转化生长因子β1对大鼠原代肝星状细胞活化的影响. 世界华人消化杂志 2007; 15(3): 211-215
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: January 28, 2007
AIM: To investigate the activation of primarily cultured hepatic stellate cells (HSCs) at different differentiated stages after treatment of exogenous transforming growth factor-β1 (TGF-β1) and the alterations of related factors during this process.
METHODS: HSCs were isolated from normal rats and primarily cultured in the uncoated plastics for 2, 3, 4, 5, 6, and 7 days. Then the cells were incubated with 5 μg/L exogenous TGF-β1 for 24 hours. The morphological features of the cells were observed under inverted microscope. Western blot was used to detect the changes of a-smooth muscle actin (a-SMA) after TGF-β1 treatment and the expression of transforming growth factor β1 recepter-Ⅱ (TβR-Ⅱ) during the activation of HSCs.
RESULTS: During the process of in vitro cultivation, HSCs at different differentiated stages showed different responses to exogenous TGF-β1 treatment. TGF-β1 promoted the activation of HSCs after the cells had been cultured for 2, 3, 4, and 5 days. The cells cultured for 3 days were the most sensitive to TGF-β1, and the level of a-SMA expression was increasd by 78.05%. The changes of HSC morphology and a-SMA expression were not significant in the cells cultured for 6 and 7 days. TβR-Ⅱ expression was significantly higher in HSCs cultured for 7 days than that in ones cultured for 3 days (3.30 ± 0.83 vs 1.55 ± 0.38, P < 0.05).
CONCLUSION: The activation of partially-activated HSCs can be promoted by exogenous TGF-β1, while the fully-activated HSCs lose this response. The amount of TβR-Ⅱ expression is not involved in this difference.
- Citation: Chen DF, Li JY, Zheng WD, Chen ZX, Wang XZ. Effects of exogenous transforming growth factor-β1 on the activation of primarily cultured rat hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 211-215
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/211.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.211
肝纤维化是指肝脏细胞外基质(ECM)特别是胶原的过度沉积, 是继发于肝脏炎症或损伤后组织修复的代偿反应[1]. 肝星状细胞(HSC)的激活是肝纤维化形成的中心环节[2-4], 细胞因子与激活过程关系密切[5], 其中TGF-β1起关键作用[3,6]. 但HSC从静止状态转化为活化状态的动态变化过程中, 细胞对外源性TGF-β1的刺激反应如何, 鲜见系统报道. 本文拟分离大鼠HSC, 观察在原代培养的不同时期外源性TGF-β1刺激对细胞的形态、a-SMA表达的影响, 及HSC活化过程中TβR-Ⅱ的变化, 以探讨原代HSC体外培养活化过程中对TGF-β1刺激的反应及相关因素的变化.
♂Sprague-Dawley大鼠, 体质量450-500 g, 中国科学院上海实验动物中心提供, 普通饲料喂养, 自由进食; Ⅳ型胶原酶(209 kU/g)购自Invitrogen公司; Nycodenz购自Sigma公司; PronaseE(4000 nU/g)购自Merck公司; DNA酶Ⅰ(DnaseⅠ, 106 kU/g)购自北京华美生物公司; DMEM培养基干粉购自Gibco公司; 胎牛血清购自奥地利PAA公司; 鼠抗人结蛋白(desmin) mAb购自DAKO公司; 免疫细胞化学SP染色试剂盒购自北京中杉金桥生物技术有限公司; 人重组TGF-β1购自R&D公司; 小鼠抗大鼠a-肌动蛋白(a-SMA) mAb购自Sigma公司; 兔抗大鼠TβR-Ⅱ多克隆抗体及兔抗β-tubulin多克隆抗体购自Santa Cruz公司; 二抗均购自北京中杉金桥生物技术有限公司.
大鼠HSC的分离方法参考文献[7]. 细胞分离后, 应用台盼蓝染色排斥法鉴定细胞活率, desmin免疫细胞化学染色法鉴定HSC纯度. 以200 mL/L胎牛血清/DMEM培养液调整细胞浓度为2×108/L, 接种于无包被的6孔塑料培养板上. 实验所用细胞来自同一大鼠, 每项实验重复5次. 细胞分6组, 每组再分别设立干预组和对照组. 6组干预组细胞分别相对应于培养2, 3, 4, 5, 6, 7 d后加用TGF-β1处理.
TGF-β1用含1 g/L牛血清白蛋白的4 mmol/L的HCl溶液激活. TGF-β1加用前24 h, 细胞用无血清的DMEM溶液洗涤2次后, 改用20 mL/L的胎牛血清/DMEM培养液继续培养, 继而按预定时间换用含5 μg/L TGF-β1的 20 mL/L胎牛血清/DMEM培养液培养、处理24 h后进行下游实验.
1.2.1 应用相差倒置显微镜观察细胞的形态变化: 细胞分离后, 每隔24 h观察其形态变化, 同时进行干预组和对照组之间的比较.
1.2.2 Western blot法分析细胞a-SMA, TβR-Ⅱ及β-tubulin的表达: 按预定时间, 用预冷的PBS洗涤细胞2次, 直接加用适当量的细胞裂解液(50 mmol/L的Tris-HCl, pH值6.8, 100 mmol/L二硫苏糖醇, 20 g/L十二烷基硫酸纳, 100 mL/L甘油), 所得溶液在沸水中煮10 min, 而后离心(15 000 g)10 min, 取上清即为细胞总蛋白溶液. 同时测定蛋白浓度. 取含8 mg总蛋白的细胞裂解液进行100 g/L SDS-PAGE电泳, 经硝酸纤维素膜转移, 用含50 g/L脱脂奶粉的TBS-T溶液(TBS+1 mL/L Tween-20)封闭后, 分别与a-SMA mAb(1:400)、TβR-Ⅱ多克隆抗体(1:200)、β-tubulin多克隆抗体(1:300)室温下孵育2 h, 洗涤后再分别与山羊抗小鼠二抗(1:2500)和山羊抗兔二抗(1:3000)作用, 经ECL底物化学发光显影, 测量胶片中条带灰度值.
统计学处理 采用SPSS11.0统计分析软件进行成组t检验或单因素方差分析. 当P<0.05时, 认为差异有统计学意义.
成功分离大鼠HSC, 细胞活力大于90%, 细胞纯度达90%-95%.
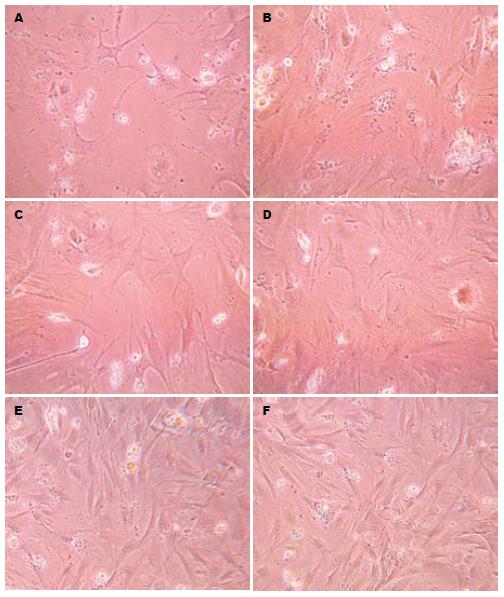
初分离的HSC呈折光性很强的圆球形, 约为肝细胞的1/3到1/4, 24 h后细胞基本贴壁, 胞质内含有大量高折光性的颗粒. 此后细胞逐渐伸展, 第3天时细胞体较大, 胞质内仍含有较多高折光性的颗粒, 伸出较多伪足, 处部分活化状态. 第5-6天, 胞质内颗粒逐渐减少, 细胞继续伸展, 开始融合成小片状. 第7天时, 折光性的颗粒明显减少, 绝大多数的细胞呈星形、梭形, 融合成片, 呈完全活化状态. 加入TGF-β1后, 与对照组相比, 明显促进培养第2-5天的细胞活化, 以培养第3天的最显著, 细胞更为伸展, 折光性颗粒减少(图1).
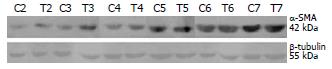
随细胞培养时间的延长, HSC的a-SMA表达逐渐升高. 与对照组相比, TGF-β1促进体外培养2-5 d HSC的a-SMA合成, 以第3天最为显著, 干预组的表达量是对照组的1.7805倍. 培养6, 7 d的HSC, 对照组和干预组a-SMA表达无明显差异. 内参照β-tubulin的表达基本一致(图2, 表1).
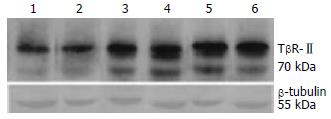
在培养过程中, 第5, 6, 7, 8天HSC的TβR-Ⅱ表达比第3, 4天高(F = 14.02, P<0.05), 但第5, 6, 7, 8天间的表达无明显差异(图3).
HSC的激活是肝纤维化形成的中心环节, 是指肝脏损伤时, HSC受到各种致病因子的刺激, 从静息状态转化为具有增生性、纤维原性和可收缩性的肌成纤维细胞[8]. 静止状态的HSC在无包被的塑料培养皿上培养, 可自发激活, 7 d呈完全活化状态, 与体内肝纤维化过程相似[2], 其中α-SMA的表达为其激活的标志, 表达量的大小可用来衡量HSC的激活程度[4]. TGF-β1在肝纤维化的大鼠中表达明显增高[9], 他可激活HSC, 有促进HSC合成、分泌细胞外基质, 减少细胞外基质的降解, 抑制细胞增殖等作用, 以自分泌与旁分泌两种方式促进HSC活化[10].
实验发现, 在HSC的活化过程中, 不同阶段加入外源性TGF-β1刺激, 反应不同, 对处部分活化状态中某阶段的细胞促活化作用较明显, 以分离培养第3天的HSC a-SMA增殖最大, 而完全活化的细胞其活化状态变化不明显, 同时测得在体外培养中, 完全活化的HSC TβR-Ⅱ的表达比部分活化的细胞(培养第3, 4天)升高. TβR-Ⅱ是TGF-β1在HSC内信号传导过程的起始结合物, 有研究表明[11], 刚分离的HSC TβR-Ⅱ的表达很低, 而后渐升高, 这可能引起处静止及部分活化状态的细胞在某阶段对TGF-β1的反应渐升高. 但完全活化的细胞TβR-Ⅱ表达仍较高, 而对TGF-β1的刺激活化作用反应却下降, 因此我们考虑完全活化的HSC的反应能力下降与TβR-Ⅱ的表达量无关, 其反应能力下降的可能原因如下: (1)有研究发现[12], 应用125I标志TGF-β1受体, 发现完全活化的HSC表面的TGF-β1Ⅰ, Ⅱ, Ⅲ型受体均明显下降, 认为可能与细胞的内摄作用有关. (2)smads通路是TGF-β1刺激HSC后的主要信号传导通路[13-14], 有学者认为完全活化的HSC smads通路的活性明显下降, 他们分别提取正常大鼠及用胆管结扎造模的肝硬化大鼠的HSC, 发现smads蛋白的表达量无明显差异, 但应用TGF-β1处理后, 造模组细胞smad2/3的磷酸化不明显, 而正常组却显著升高[14]. 另有学者应用TGF-β1体外刺激HSC后, 部分活化(培养第3天)的HSC smad4与DNA中的CAGA盒的结合明显增高, 但完全活化的HSC及其用TGF-β1刺激后, 均未发现smad4与CAGA盒的结合. 而目前认为smad2/3磷酸化后与smad4结合, 转位入核内, 与CAGA盒的结合在TGF-β1的信号传导中起重要作用[12]. (3)完全活化的HSC内源性的TGF-β1表达较高, 可能致细胞表面与外源性TGF-β1的结合位点减少. 以上几点可能引起完全活化的HSC对外界刺激的生物学应答能力下降. 但TGF-β1亦可通过MAPK等通路影响胶原的表达[15], 且各种细胞信号转导途径并非各自独立、互不相干, 而是纵横交错、相互影响, 构成一个复杂的细胞信号通路网络[16], 因此在活化过程中, 是否有其他通路蛋白的表达量、活性或受体空间结构的变化和通路间的相互作用, 及不依赖于受体的调节机制, 有待进一步的研究.
目前, 在肝纤维化治疗实验中, 有不少针对抗TGF-β1或其通路蛋白的研究. 有发现, 在肝纤维化的大鼠模型中, 抑制TGF-β1的合成和通路传导可明显改善肝纤维化[17], 另外阻断TGF-β1的受体对肝纤维化也有逆转作用[18]. 但由于TGF-β1在体内的作用广泛, 包括有促进HSC活化、抑制HSC的增殖等, 对肝纤维化的进程作用不一致, 且HSC活化过程中不同阶段对TGF-β1刺激的应答有差异, 及活化过程和细胞外基质合成的机制亦可能有不同[19], 因此在适当的时候减少或扩大TGF-β1的作用显得尤为重要, 本实验可为实验药物干预时机的选择提供参考.
肝纤维化是指肝脏细胞外基质(ECM)特别是胶原的过度沉积, 是继发于肝脏炎症或损伤后组织修复的代偿反应. 肝星状细胞(HSC)的激活是肝纤维化形成的中心环节, 细胞因子与激活过程关系密切, 其中TGF-β1起关键作用.
肝纤维化的发生与细胞因子的关系是研究热点, 在肝纤维化治疗实 验中, 有不少针对 TGF-β1或其通路蛋白的研究.
HSC活化: 是指肝脏损伤时, HSC受到各种致病因子的刺激, 从静息状态转化为具有增生性、纤维原性和可收缩性的肌成纤维细胞. 其中 α-SMA的表达为其激活的标志, 表达量的大小可用来衡量HSC的激活程度.
HSC的激活是肝纤维化形成的中心环节, 细胞因子与其激活过程关系密切, 其中内源性TG F-β1起关键作用. 但HSC从静止状态转化为活化状态过程中,对外源性TGF-β1 的刺激反应如何,鲜 见系统报道. 本实验结果表明TGF-β1对部分活化状态中的HSC的活化具有促进作用, 对完全活化HSC的刺激活化作用不敏感, 原因与TβR-Ⅱ的表达量无关. 文章结构清晰, 统计分析合理.
电编: 张敏 编辑:张焕兰
| 2. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] |
| 3. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci USA. 1999;96:2345-2349. [PubMed] |
| 4. | Reeves HL, Friedman SL. Activation of hepatic stellate cells-a key issue in liver fibrosis. Front Biosci. 2002;7:d808-826. [PubMed] |
| 5. | Marra F. Chemokines in liver inflammation and fibrosis. Front Biosci. 2002;7:d1899-1914. [PubMed] |
| 6. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-807. [PubMed] |
| 8. | Marra F. Hepatic stellate cells and the regulation of liver inflammation. J Hepatol. 1999;31:1120-1130. [PubMed] |
| 9. | Shi MN, Huang YH, Zheng WD, Zhang LJ, Chen ZX, Wang XZ. Relationship between transforming growth factor beta1 and anti-fibrotic effect of inter-leukin-10. World J Gastroenterol. 2006;12:2357-2362. [PubMed] |
| 10. | Bissell DM, Roulot D, George J. Transforming growth factor beta and the liver. Hepatology. 2001;34:859-867. [PubMed] |
| 11. | Dooley S, Delvoux B, Streckert M, Bonzel L, Stopa M, ten Dijke P, Gressner AM. Transforming growth factor beta signal transduction in hepatic stellate cells via Smad2/3 phosphorylation, a pathway that is abrogated during in vitro progression to myofibroblasts. TGFbeta signal transduction during transdifferentiation of hepatic stellate cells. FEBS Lett. 2001;502:4-10. [PubMed] |
| 12. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] |
| 13. | Bachem MG, Meyer D, Melchior R, Sell KM, Gressner AM. Activation of rat liver perisinusoidal lipocytes by transforming growth factors derived from myofibroblastlike cells. A potential mechanism of self perpetuation in liver fibrogenesis. J Clin Invest. 1992;89:19-27. [PubMed] |
| 14. | Massague J. TGF-beta signal transduction. Annu Rev Biochem. 1998;67:753-791. [PubMed] |
| 15. | Tsukada S, Westwick JK, Ikejima K, Sato N, Rippe RA. SMAD and p38 MAPK signaling pathways independently regulate alpha1(I) collagen gene expression in unstimulated and transforming growth factor-beta-stimulated hepatic stellate cells. J Biol Chem. 2005;280:10055-10064. [PubMed] |
| 17. | Shek FW, Benyon RC. How can transforming growth factor beta be targeted usefully to combat liver fibrosis? Eur J Gastroenterol Hepatol. 2004;16:123-126. [PubMed] |
| 18. | Jiang W, Yang CQ, Liu WB, Wang YQ, He BM, Wang JY. Blockage of transforming growth factor beta receptors prevents progression of pig serum-induced rat liver fibrosis. World J Gastroenterol. 2004;10:1634-1638. [PubMed] |
| 19. | Lindert S, Wickert L, Sawitza I, Wiercinska E, Gressner AM, Dooley S, Breitkopf K. Transdifferen-tiation-dependent expression of alpha-SMA in hepatic stellate cells does not involve TGF-beta pathways leading to coinduction of collagen type I and thrombospondin-2. Matrix Biol. 2005;24:198-207. [PubMed] |