修回日期: 2007-10-04
接受日期: 2007-10-28
在线出版日期: 2007-10-18
目的: 建立慢性胰腺炎(CP)胰蛋白酶免疫组化阳性判断标准, 探讨胰蛋白酶在CP中的分布特征及与CP严重程度的关系.
方法: 取正常猪4例及不同程度CP猪14例的胰腺组织, 用链菌素亲生物素-过氧化酶连接法(streptavidin peroxidase conjugated method, SP)免疫组化法检测胰蛋白酶在实验性CP胰腺组织中的分布特征并初步建立阳性判断标准, 分析胰蛋白酶的阳性标准与CP严重程度的相关性.
结果: 胰蛋白酶在CP胰腺组织主要表现为腺泡细胞质内、间质及胰管内棕色或棕黄色染色, 染色程度在轻度CP以强阳性(++)为主, 中度CP以中等阳性(+)为主, 重度CP以弱阳性(±)为主, 3组染色程度之间差异有统计学意义(P<0.05). 胰蛋白酶强阳性染色与慢性胰腺炎严重程度具有相关性(r = 0.742).
结论: 胰蛋白酶原异常活化可见于腺泡细胞质内、间质及胰管内, 建立了胰蛋白酶阳性判断标准. 随着慢性胰腺炎实质纤维化, 胰蛋白酶阳性率降低.
引文著录: 唐伟, 张小明, 赵建农, 舒健, 邵阳, 谢贤雍, 朱建均. 胰蛋白酶在猪慢性胰腺炎胰腺组织中的分布及免疫组化阳性标准. 世界华人消化杂志 2007; 15(29): 3092-3096
Revised: October 4, 2007
Accepted: October 28, 2007
Published online: October 18, 2007
AIM: To study a positive primary trypsin standard for the immunohistochemical study of pigs with chronic pancreatitis, the distribution of pancreatic trypsin in chronic pancreatitis, and correlation of the distribution of trypsin with severity of chronic pancreatitis.
METHODS: Pancreatic tissues were from four normal pigs and 14 with chronic pancreatitis of varying severity. The distribution of trypsin and a positive standard for pancreatic trypsin in pigs with chronic pancreatitis were studied by streptavidin-peroxidase conjugated immunohistochemical methods. The correlation between the positive standard and the severity of chronic pancreatitis was analyzed.
RESULTS: Trypsin was stained brown in the cytoplasm, extracellular mesenchyme and pancreatic duct. The degree of staining for trypsin was strong positive (++) in mild chronic pancreatitis, moderately positive (+) in moderate chronic pancreatitis, and weakly positive (±) in severe chronic pancreatitis. There were significant differences in the degree of trypsin staining among the three groups (P < 0.05). The degree of staining was correlated with the severity of chronic pancreatitis (r = 0.742).
CONCLUSION: Trypsinogen is abnormally activated in the cytoplasm, extracellular mesenchyme and pancreatic duct in pigs with chronic pancreatitis. The positive standard for trypsin is reasonable. The level of positive staining for trypsin decreased following the increases in pancreatic fibrosis in chronic pancreatitis.
- Citation: Tang W, Zhang XM, Zhao JN, Shu J, Shao Y, Xie XY, Zhu JJ. Distribution of pancreatic trypsin in pigs with chronic pancreatitis, and a positive trypsin standard for immunohistochemical studies. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3092-3096
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3092.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3092
正常胰腺分泌多种消化酶, 其中以蛋白酶、淀粉酶和脂肪酶为主[1]. 慢性胰腺炎(chronic pancreatitis, CP)典型病理学表现为胰腺实质纤维化[2-3]. 由于胰腺组织结构不可逆的受损, 导致不同程度的腺泡萎缩和胰管变形, 故CP患者呈不同程度的外分泌功能不足, 各种酶分泌下降. 胰蛋白酶是一种肽链内切酶, 可作为一种酶的激活因子激活弹性蛋白酶和磷脂酶A2, 后二者和胰腺的损伤有直接关系[4]. 激活的弹性蛋白酶可选择性地消化破坏血管壁的弹性纤维, 活化的磷脂酶A2能使卵磷脂和脑磷脂转变为溶血卵磷脂和溶血脑磷脂. 这些物质具有很强的细胞毒性作用, 可导致组织坏死, 胰蛋白酶在胰腺组织损伤过程中发挥中心作用[5]. 但胰蛋白酶在CP中的分布变化尚未见国内外文献报道. 我们应用链菌素亲生物素-过氧化酶连接法[6](streptavidin peroxidase conjugated method, SP)免疫组化检测胰蛋白酶在小型猪CP的分布, 并初步建立一种胰蛋白酶的阳性判断标准, 以探讨其在CP的分布特征及与慢性胰腺纤维化程度的相关性.
18头西双版纳小型猪, 其中4头正常猪, 14头通过胰管结扎建立CP动物模型. CP纤维化的程度分为Ⅰ-Ⅲ级[7-8], Ⅰ级: 轻微纤维化, 即纤维化分布以小叶周围为主; Ⅱ级: 中度纤维化, 纤维化扩展到小叶内、腺泡之间; Ⅲ级: 重度纤维化和极重度纤维化, 小叶内的纤维化相互融合, 形成较大面积的纤维化或者广泛的纤维化形成. 根据上述标准, 本组有CPⅠ级6例, Ⅱ级4例, Ⅲ级4例, 诊断由病理证实. 全部标本用40 g/L甲醛固定, 石蜡包埋, 4 μm连续切片, 其中Ⅰ级6张切片, Ⅱ级和Ⅲ级分别为5张切片. 抗人胰蛋白酶mAb(RAB-0012, 6.0 mL)和SP试剂盒购自福州迈新生物技术开发公司.
应用SP免疫组化检测胰蛋白酶在小型猪慢性胰腺炎的分布. SP法免疫组化染色, DAB显色, 苏木精复染, 中性树胶封片. 胰蛋白酶在CP胰腺组织内主要表现为腺泡细胞质内、胰管内及间质呈棕色或棕黄色染色, 以正常胰腺免疫组化染色为对照, 分为强阳性(++), 染色程度明显高于正常胰腺组织染色; 中等阳性(+), 染色程度稍高于正常胰腺组织染色; 弱阳性或无阳性染色(±), 染色程度明显低于正常胰腺组织染色3个等级. 每张切片随机观察5个高倍镜(×40)视野, 如果一个视野同时出现不同阳性等级, 以不同阳性等级所占该视野的百分比计, 分别计算Ⅰ, Ⅱ, Ⅲ级CP各种染色程度视野占所观察的每种CP总视野的百分比.
统计学处理 采用四格表确切概率法和Spearman秩(∣r∣≤1)分析, P<0.05为有统计学意义.
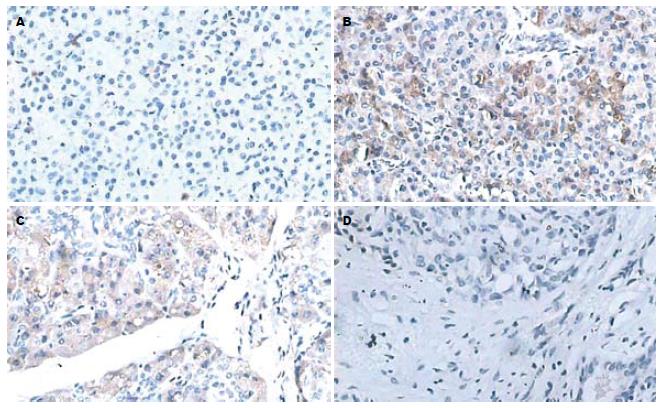
正常胰腺组织免疫组化染色显示蓝色的腺泡细胞圆形细胞核及胰管结构, 背景染色呈浅淡黄色(图1A). Ⅰ级CP免疫组化染色显示, 在腺泡细胞质内、间质及胰管内呈棕色染色, 以腺泡细胞质染色为主, 染色程度较深, 但在一些间质区域可见浅淡棕黄色染色(图1B); Ⅱ级CP免疫组化显示在腺泡细胞质内、间质及胰管内呈棕色或棕黄色染色, 以腺泡细胞质染色为主, 且可见梭形的纤维细胞核, 在纤维细胞核区域无阳性染色(图1C); Ⅲ级CP免疫组化可见大量的梭形纤维细胞核, 主要呈无阳性染色区域, 在少量的腺泡细胞核周围及一些间质区域可见深浅不一的阳性染色(图1D).
用OlympusBX50型号光学显微镜每张切片随机观察5个高倍镜视野(×40). Ⅰ级CP总共观察30个视野, 其中强阳性视野率73%, 中等阳性视野率20%, 弱阳性视野率为7%; Ⅱ级CP总共观察了25个视野, 其中强阳性视野率16%, 中等阳性视野率72%, 弱阳性视野率为12%; Ⅲ级CP总共观察了25个视野, 其中强阳性视野率4%, 中等阳性视野率12%, 弱阳性视野率为84%. 三组之间差异有统计学意义(P<0.05, 表1), 而且强阳性视野率与CP的纤维化程度有高度相关性(r = 0.742)
| ++ | + | ± | |
| CPⅠ | 73(22/30) | 20(6/30) | 7(2/30) |
| CPⅡ | 16(4/25) | 72(18/25) | 12(3/25) |
| CPⅢ | 4(1/25) | 12(3/25) | 84(21/25) |
胰蛋白酶在胰酶的激活和组织损伤过程中起重要的作用[9]. 胰蛋白酶能直接降解细胞外基质, 激活其他蛋白水解酶, 加强对细胞外基质、基底膜的降解[10]. 胰蛋白酶原是胰蛋白酶的前体, 是一种分子质量为25 kDa的蛋白酶, 在生理情况下, 胰蛋白酶原以酶原的形式从腺泡细胞分泌, 通过出胞作用排到腺泡腔内, 经胰管系统排入十二指肠而被肠激酶活化[11]. 大多数学者认为, 胰腺炎的发生主要是由于胰腺组织腺泡中的胰酶被过度激活, 并通过细胞膜释放至间质而使胰腺自身消化所致[11-14]. 我们应用免疫组化SP法检测胰蛋白酶在小猪CP组织中表达与分布特征, 结果发现, CP组织胰蛋白酶在腺泡细胞质内、间质及胰管内呈阳性染色, 提示胰蛋白酶的异常活化可以发生在胰腺3个部位: 腺泡细胞质内、间质及胰管内.
我们通过胰管结扎建立CP动物模型[15], 在结扎胰管之后, 胰管内压超过腺泡生理分泌生理压, 腺泡细胞的功能就会受到很大的影响, 消化酶的分泌排出被阻断, 但合成和细胞内转运仍在继续, 溶酶体水解酶和消化酶酶原的隔离状态被扰乱, 结果溶酶体水解酶和消化酶酶原颗粒得以接触, 从而使胰蛋白酶原在腺泡细胞内被激活[16-18]. 但是, 胰腺自身消化过程起始还有争议[19]. 我们发现, 胰蛋白酶在CP的分布以腺泡细胞为主, 而且胰蛋白酶原是在腺泡细胞内被激活的. 我们认为胰腺自身消化过程可能从腺泡细胞开始, 而不是在间质及胰管内, 间质及胰管内胰蛋白酶阳性染色与胰蛋白酶从基底膜侧异常排除有关[20], 这有待于从亚细胞水平通过电子显微镜技术去研究. Hernanden et al[21-23]研究了45例患者的血浆胰蛋白酶的变化, 包括正常志愿者18例, 轻、中度乙醇性CP16例, 非黄胆性胰腺癌7例, 钙化性CP4例. 血浆胰蛋白酶在基础水平时前3组相似. 进食(牛奶)2 h后, 血浆胰蛋白酶水平在正常志愿者和胰腺癌组明显降低, 而在轻、中度乙醇性CP组不降低. 进食前后, 血浆胰蛋白酶水平在钙化性CP近乎消失. 他们推测这是由于在CP炎症早期, 腺泡细胞的损伤较轻微, 生理性刺激可导致胰蛋白酶和胰蛋白酶原的强烈表达, 并分泌到胰腺间质, 最后到血浆所致. 我们的实验结果证实了Hernanden et al的推测. 我们根据胰腺纤维化的程度, 将CP分为3期[7-8], 即轻、中、重度CP, 并对其进行胰蛋白酶免疫组化染色. 结果发现在轻、中度CP, 胰蛋白酶染色程度较深, 而在重度CP, 胰蛋白酶染色呈弱阳性, 说明我们所建立的阳性判断标准具有一定的合理性. 但特别要指出的是本文中定量分析不是对组织中的胰蛋白酶含量进行分析, 而是对胰蛋白酶反应阳性程度进行定量.
胰蛋白酶能降解细胞外基质. Miyata et al[24-27]报道胰蛋白酶通过参与蛋白酶激活受体-2(PAR-2)信号传导, 促进细胞纤维化. 另外有研究报道, 重度纤维化的胰腺癌较轻、中度纤维化胰腺癌细胞中PAR-2表达更高, 提示PAR-2的活化可能参与胰腺癌细胞的纤维化[28-29]. 我们发现, CP纤维化程度与胰蛋白酶强阳性染色呈负相关, 这可能与CP在发展过程中腺泡细胞功能受到影响, 胰蛋白酶分泌下降有关[30]. 至于胰蛋白酶能否促进CP纤维化发展, 从胰蛋白酶能降解细胞外基质, 激活其他蛋白水解酶, 造成胰腺自生消化的作用来看, 胰蛋白酶和CP纤维化具有一定的相关性, 但其详细机制有待于进一步研究.
慢性胰腺炎发病率逐年上升, 其发病机制及其纤维化机制尚未明确, 本文通过检测轻、中、重度慢性胰腺炎胰蛋白酶的表达, 探讨胰蛋白酶在慢性胰腺炎病理过程中的可能机制.
慢性胰腺炎典型病理特点是胰腺实质纤维化, 是多种因素作用的结果, 胰蛋白酶与慢性胰腺炎纤维化的机制是研究的重点.
有学者发现, 胰蛋白酶通过参与蛋白酶激活受体-2(PAR-2)信号传导, 促进肿瘤细胞纤维化, 在慢性胰腺炎纤维化中研究较少.
慢性胰腺炎的胰腺自身消化过程从腺泡细胞开始, 而不是起源于间质及胰管.
本文以猪慢性胰腺炎为研究对象, 得出了慢性胰腺炎的胰蛋白酶的表达轻度较重度强烈, 对慢性胰腺炎的早期诊断提供了一条思路. 利用分子影像手段监测胰蛋白酶在胰腺组织中的分布达到慢性胰腺炎的早期诊断.
胰蛋白酶原: 是胰蛋白酶的前体, 是一种分子质量为25kDa的蛋白酶, 由两种同工酶组成, 包括胰蛋白酶原-1(阳离子型)和胰蛋白酶原-2(阴离子型)两种亚型, 主要发挥食物消化酶的作用.
本文内容很重要, 具有一定的临床意义.
编辑: 何燕 电编:马文华
| 1. | Williams JA. Intracellular signaling mechanisms activated by cholecystokinin-regulating synthesis and secretion of digestive enzymes in pancreatic acinar cells. Annu Rev Physiol. 2001;63:77-97. [PubMed] |
| 2. | Khokhar AS, Seidner DL. The pathophysiology of pancreatitis. Nutr Clin Pract. 2004;19:5-15. [PubMed] |
| 3. | Iglesias-Garcia J, Abdulkader I, Larino-Noia J, Forteza J, Dominguez-Munoz JE. Histological evaluation of chronic pancreatitis by endoscopic ultrasound-guided fine needle biopsy. Gut. 2006;55:1661-1662. [PubMed] |
| 4. | Goldberg DM. Proteases in the evaluation of pancreatic function and pancreatic disease. Clin Chim Acta. 2000;291:201-221. [PubMed] |
| 5. | Sherwood MW, Prior IA, Voronina SG, Barrow SL, Woodsmith JD, Gerasimenko OV, Petersen OH, Tepikin AV. Activation of trypsinogen in large endocytic vacuoles of pancreatic acinar cells. Proc Natl Acad Sci USA. 2007;104:5674-5679. [PubMed] |
| 6. | Milnerowicz H, Chmarek M, Rabczynski J, Milnerowicz S, Nabzdyk S, Knast W. Immunohisto-chemical localization of metallothionein in chronic pancreatitis. Pancreas. 2004;29:28-32. [PubMed] |
| 7. | Suda K, Nishimori I, Takase M, Oi I, Ogawa M. Autoimmune pancreatitis can be classified into early and advanced stages. Pancreas. 2006;33:345-350. [PubMed] |
| 8. | Suda K, Takase M, Fukumura Y, Ogura K, Ueda A, Matsuda T, Suzuki F. Histopathologic characteristics of autoimmune pancreatitis based on comparison with chronic pancreatitis. Pancreas. 2005;30:355-358. [PubMed] |
| 9. | Imaizumi H, Kida M, Nishimaki H, Okuno J, Kataoka Y, Kida Y, Soma K, Saigenji K. Efficacy of continuous regional arterial infusion of a protease inhibitor and antibiotic for severe acute pancreatitis in patients admitted to an intensive care unit. Pancreas. 2004;28:369-373. [PubMed] |
| 12. | Lerch MM, Albrecht E, Ruthenburger M, Mayerle J, Halangk W, Kruger B. Pathophysiology of alcohol-induced pancreatitis. Pancreas. 2003;27:291-296. [PubMed] |
| 13. | Shabanov VV. Starting mechanisms of trypsinogen activation in acute pancreatitis. Biomed Khim. 2003;49:491-501. [PubMed] |
| 14. | Kim CD. Pancreatitis--etiology and pathogenesis. Korean J Gastroenterol. 2005;46:321-332. [PubMed] |
| 15. | Boerma D, Straatsburg IH, Offerhaus GJ, Gouma DJ, van Gulik TM. Experimental model of obstructive, chronic pancreatitis in pigs. Dig Surg. 2003;20:520-526. [PubMed] |
| 16. | Toyama MT, Patel AG, Nguyen T, Ashley SW, Reber HA. Effect of ethanol on pancreatic interstitial pH and blood flow in cats with chronic pancreatitis. Ann Surg. 1997;225:223-228. [PubMed] |
| 17. | Williams JA. Regulation of pancreatic acinar cell function. Curr Opin Gastroenterol. 2006;22:498-504. [PubMed] |
| 18. | Zhou ZG, Chen YD, Sun W, Chen Z. Pancreatic microcirculatory impairment in experimental acute pancreatitis in rats. World J Gastroenterol. 2002;8:933-936. [PubMed] |
| 19. | Luthen R, Owen RL, Sarbia M, Grendell JH, Niederau C. Premature trypsinogen activation during cerulein pancreatitis in rats occurs inside pancreatic acinar cells. Pancreas. 1998;17:38-43. [PubMed] |
| 20. | Schmitt M, Klonowski-Stumpe H, Eckert M, Luthen R, Haussinger D. Disruption of paracellular sealing is an early event in acute caerulein-pancreatitis. Pancreas. 2004;28:181-190. [PubMed] |
| 21. | Hernandez CA, Nicolas JC, Fernandez J, Pizarro P. Determination of plasma trypsin-like activity in healthy subjects, patients with mild to moderate alcoholic chronic pancreatitis, and patients with nonjaundice pancreatic cancer. Dig Dis Sci. 2005;50:2165-2169. [PubMed] |
| 22. | Howes N, Greenhalf W, Stocken DD, Neoptolemos JP. Cationic trypsinogen mutations and pancreatitis. Clin Lab Med. 2005;25:39-59. [PubMed] |
| 23. | Teich N, Ockenga J, Hoffmeister A, Manns M, Mossner J, Keim V. Chronic pancreatitis associated with an activation peptide mutation that facilitates trypsin activation. Gastroenterology. 2000;119:461-465. [PubMed] |
| 24. | Miyata S, Koshikawa N, Yasumitsu H, Miyazaki K. Trypsin stimulates integrin alpha(5)beta(1)-dependent adhesion to fibronectin and proliferation of human gastric carcinoma cells through activation of proteinase-activated receptor-2. J Biol Chem. 2000;275:4592-4598. [PubMed] |
| 25. | Myatt A, Hill SJ. Trypsin stimulates the phospho-rylation of p42,44 mitogen-activated protein kinases via the proteinase-activated receptor-2 and protein kinase C epsilon in human cultured prostate stromal cells. Prostate. 2005;64:175-185. [PubMed] |
| 26. | Emori Y, Mizushima T, Matsumura N, Ochi K, Tanioka H, Shirahige A, Ichimura M, Shinji T, Koide N, Tanimoto M. Camostat, an oral trypsin inhibitor, reduces pancreatic fibrosis induced by repeated administration of a superoxide dismutase inhibitor in rats. J Gastroenterol Hepatol. 2005;20:895-899. [PubMed] |
| 27. | Stenman M, Ainola M, Valmu L, Bjartell A, Ma G, Stenman UH, Sorsa T, Luukkainen R, Konttinen YT. Trypsin-2 degrades human type II collagen and is expressed and activated in mesenchymally transformed rheumatoid arthritis synovitis tissue. Am J Pathol. 2005;167:1119-1124. [PubMed] |
| 28. | Ikeda O, Egami H, Ishiko T, Ishikawa S, Kamohara H, Hidaka H, Takahashi M, Ogawa M. Signal of proteinase-activated receptor-2 contributes to highly malignant potential of human pancreatic cancer by up-regulation of interleukin-8 release. Int J Oncol. 2006;28:939-946. [PubMed] |
| 29. | Ikeda O, Egami H, Ishiko T, Ishikawa S, Kamohara H, Hidaka H, Mita S, Ogawa M. Expression of proteinase-activated receptor-2 in human pancreatic cancer: a possible relation to cancer invasion and induction of fibrosis. Int J Oncol. 2003;22:295-300. [PubMed] |