修回日期: 2007-09-28
接受日期: 2007-09-28
在线出版日期: 2007-10-18
目的: 探讨外源性CO对IIR所致多器官损伤的防治作用.
方法: ♂Wistar大鼠64只, 随机分为8组. A组: 假手术对照组, 不阻断SMA, 其余手术过程同其他组; B组: IIR组, 吸入空气. C组分为C1亚组与C2亚组, 缺血前10 min吸入浓度分别为100 µL/L、250 µL/L的CO; D组: 分为D1亚组与D2亚组, 再灌注开始时吸入浓度为100 µL/L、250 µL/L的CO; E组: 分为E1亚组与E2亚组, 再灌注60 min时开始吸入浓度为100 µL/L、250 µL/L的CO. 实验结束时取不同组织电镜下观察超微结构变化、 TUNEL法荧光显微镜下观察细胞凋亡情况.
结果: 与A组相比, B组肠和肺组织超微结构损伤严重、 凋亡细胞大量出现, 而肝组织损伤较轻、 肾组织损伤不明显, 他们的凋亡细胞数目变化不明显. 与B组相比, C、D、E组肠、肺、肝组织超微结构损伤表现轻, C组比D组、 E组表现轻, 各组内两亚组表现无明显差别. 肠和肺组织中凋亡细胞数目从多到少依次是: B组, E1组, E2组, D1组, D2组, C1组, C2组, A组(P<0.05).
结论: 外源性CO对大鼠IIR所致多器官损伤具有防治作用, 且浓度为250 µL/L的CO比100 µL/L的CO作用更明显; 缺血前应用比缺血及再灌注后应用作用更明显. 外源性CO对IIR所致器官损伤的防治作用可能是通过调控细胞凋亡实现的.
引文著录: 韩宁, 陈卫民. 外源性一氧化碳对小肠缺血再灌注大鼠不同器官超微结构及细胞凋亡的影响. 世界华人消化杂志 2007; 15(29): 3085-3091
Revised: September 28, 2007
Accepted: September 28, 2007
Published online: October 18, 2007
AIM: To investigate the effects of CO on multiple organ injury induced by intestinal ischemia/reperfusion (IIR) in rats.
METHODS: Sixty-four male Wistar rats, weighing 220-260 g, were randomly allocated into eight groups with eight animals in each. The model of IIR was established by clamping the superior mesenteric artery (SMA) for 60 min and reperfusion for 120 min. Group A, sham operation, no SMA clamping; group B, SMA clamping for 60 min and reperfusion for 120 min; group C1/C2, inhaled 100 µL/L/250 µL/L CO 10 min before SMA clamping; group D1/D2, inhaled 100 µL/L/250 µL/L CO 60 min after SMA clamping; group E1/E2, inhaled 100 µL/L/250 µL/L CO 60 min after reperfusion. The ultrastructure of different tissues was observed by transmission electron microscopy, and apoptosis of different cells was determined by terminal deoxynucleotidyl transferase-mediated nick end labeling (TUNEL).
RESULTS: The extent of ultrastructural damage in the different tissues in group B was intestinal > lung > liver, with no significant change in the kidneys; and in different groups, it was group C < D < E < B, with no significant differences between the 250 µL/L and 100 µL/L groups. Few apoptotic cells were seen in the liver and kidneys, but many in the intestine and lungs; and in different groups, the number of apoptotic cells was group A < C2 < C1 < D2 < D1 < E2 < E1 < B (P < 0.05).
CONCLUSION: Exogenous CO can provide protection against multiple organ injury induced by IIR in rats. The effect of 250 µL/L CO is more significant than that of 100 µL/L CO, and the effect of CO is more significant when it is used before intestinal ischemia than after. Exogenous CO provides protection against multiple organ injury induced by IIR, partly through modulating apoptosis.
- Citation: Han N, Chen WM. Effects of exogenous carbon monoxide on ultrastructure changes and apoptosis of different organs induced by intestinal ischemia/reperfusion in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3085-3091
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3085.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3085
小肠缺血再灌注(IIR, intestinal ischemia-reperfusion)是临床常见的病理生理过程. 他不仅可以引起肠道屏障功能不全, 严重时还能通过激发全身性炎症反应(SIRS, systemic inflammation response syndrome)的同时损伤远隔器官, 导致多器官功能障碍综合征(MODS, mutiple organ dysfunction syndrome)[1-2]. 而发现过去一直认为一氧化碳(CO, carbon monoxide)是一种毒性气体, 现在则发现他作为一种细胞信使在人体各种生理和病理过程中发挥重要调节作用[3-6]. 我们通过建立大鼠IIR模型, 观察外源性应用CO对IIR中不同器官超微结构及细胞凋亡的影响, 探讨外源性CO对IIR所致多器官损伤的防治作用.
64只体质量220-260 g健康的♂Wistar大鼠由中国医科大学实验动物中心提供, 标准一氧化碳气体由大连大特气体有限公司提供(压力9.0 MPa, 浓度250×10-6/100×10-6, 空气平衡), 一步法TUNEL细胞凋亡检测试剂盒由碧云天生物技术研究所提供. 日立H-600-4型透射式电子显微镜、Olympus ML2000型显微镜、NIKON 80IFL-FUW-PF型荧光显微镜由日本提供, 8800型超薄切片机由瑞典提供, B-D微量输液泵、B-D动静脉留置套管针由美国提供.
1.2.1 动物模型制作: 大鼠实验前禁食12 h, 自由饮水. 采用肠系膜上动脉(superior mesenteric artery, SMA)夹闭-开放方式复制IIR模型[7]. 大鼠ip. 乌拉坦(1.0 g/kg)麻醉, 开放股静脉持续微泵输注乳酸钠林格氏液(10 mL/kg•h). 行颈动脉置管(用于测定动脉压及采血), 气管切开插管后接带单向活瓣T型管(活瓣能保证吸入气为所需气体, 呼出气进入大气), 保留自主呼吸. 常规消毒后取腹正中切口3-4 cm, 游离肠系膜上动脉, 血压平稳10 min后行显微手术用无损伤动脉夹关闭SMA起始部, 造成肠缺血; 缝合切口, 60 min后经原切口入腹腔, 去除动脉夹, 恢复小肠血供120 min, 即为IIR模型.
1.2.2 动物分组: 将大鼠随机分为8组, 每组8只. A组: 假手术对照组. 不阻断SMA, 其余手术过程同其他组; B组: 小肠缺血再灌注组, 经T型管吸入空气. C组: 缺血前10 min CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为两个亚组. D组: 再灌注开始时CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为两个亚组. E组: 再灌注后60 min CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为两个亚组.
1.2.3 组织超微结构检查: 实验结束时立刻经颈动脉放血处死动物, 迅速取右下肺、空肠、肝右叶、肾部分组织, 切成1 mm×1 mm×1 mm大小的组织块, 固定于戊二醛磷酸缓冲液(25 g/L)中固定, 4℃保存, 待行透射电镜检查组织超微结构变化. 测定时取标本常规锇酸(10 g/L)固定后, 丙酮逐级脱水, 环氧树脂618包埋, 超薄切片, 醋酸钠-枸橼酸铝双重染色, 透射电镜下观察各组织超微结构的变化.
1.2.4 组织凋亡细胞计数: 另取右下肺、空肠、肝右叶、肾部分组织, 甲醛(100 g/L)固定, 脱水后常规石蜡包埋切片, TUNEL法行免疫荧光染色, 用抗荧光淬灭封片液封片后荧光显微镜下观察. 使用的激发波长范围为450-500 nm, 发射波长范围为515-565 nm(绿色荧光). 凋亡细胞的细胞核呈现绿色荧光, 非凋亡细胞无绿色荧光. 双盲法高倍镜(×400)下随机选择10个视野, 计数凋亡细胞数量并计算平均值.
统计学处理 数据以mean±SD表示. 采用SPSS13.0专业统计软件对数据进行单因素方差分析和t检验, P<0.05为差异有统计学意义.
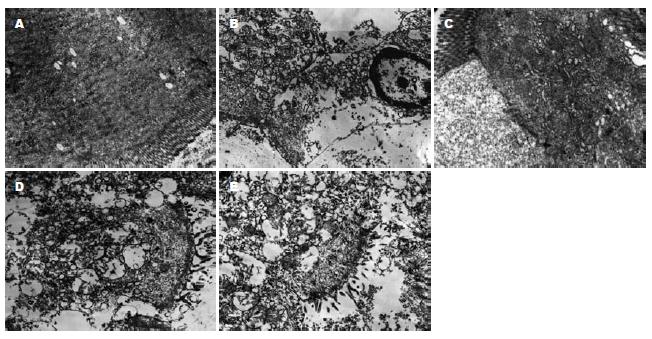
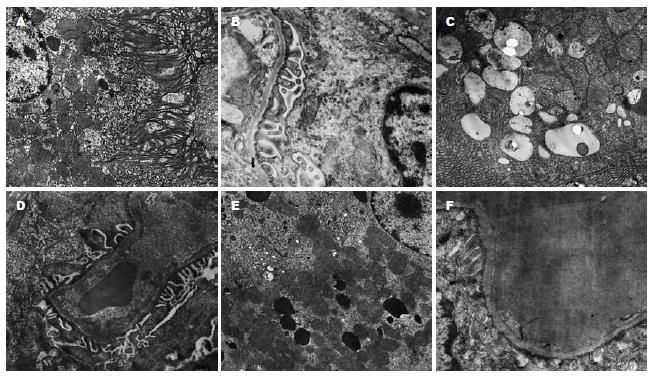
2.1.1 肠: A组(图1A)见正常小肠结构, 上皮表面可见微绒毛, 上皮细胞之间细胞连接完整, 细胞胞质内可见大量线粒体、核糖体及粗面内质网. B组(图1B)结构受损极重, 小肠上皮大量微绒毛脱落, 细胞之间细胞连接松弛, 细胞胞质内大部分线粒体嵴溶解; 胞质有局部溶解, 细胞核内异染色质边集, 核胞间隙增宽. 外源性应用CO各组(图1C-E)肠组织结构损伤程度均好于B组, 特别是C1, C2两组受损较轻, 胞质内线粒体外膜略模糊, 且小肠上皮表面微绒毛部分整齐, 粗面内质网仅轻度扩张; E1, E2两组受损相对较重. C, D, E组内两亚组比较无明显差异.
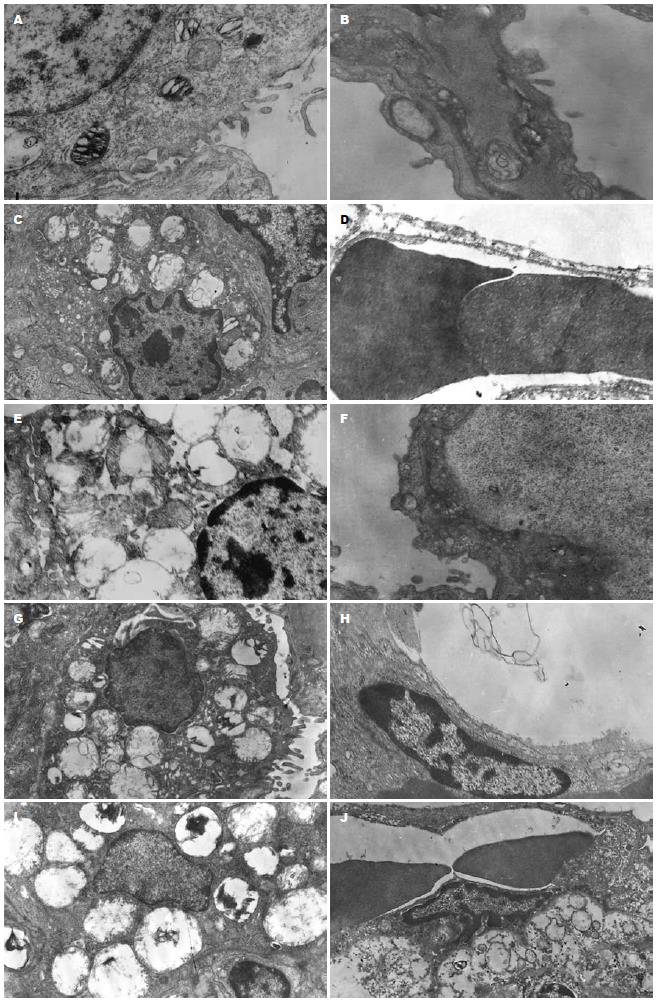
2.1.2 肺: A组(图2A-B)结构基本正常, 血管内皮细胞形态完整, 气血屏障连续且结构清晰, II型上皮细胞表面微绒毛排列整齐, 线粒体结构完好, 板层小体正常存在. B组(图2C-D)结构明显受损, 气血屏障模糊增厚, II型上皮细胞表面微绒毛短小稀疏, 核型不规则, 胞质内多个线粒体空泡变性, 板层小体排空式消失; Ⅰ型上皮细胞部分破损溶解, 血管内皮细胞大面积溶解, 腔内见红细胞. 外源性应用CO各组(图2E-J)肺组织结构损伤程度均好于B组, 特别是C1, C2两组受损较轻, II型细胞表面微绒毛较完整, 部分线粒体完好, 多个板层小体存在; 而E1, E2两组受损相对较重. C, D, E组内两亚组比较无明显差异.
2.1.3 肝: A组(图3A)结构基本正常, 肝细胞核膜完整、核仁清楚, 胞质内线粒体结构完好. B组(图3B)结构略受损, 细胞核膜模糊, 异染色质边集, 胞质部分溶解, 部分线粒体外膜破损. 外源性应用CO各组(图3C)肝组织结构均受损较轻, 细胞核核形较不规则, 少量线粒体外膜有破损. C, D, E各组间及组内两亚组比较无明显差异.
2.1.4 肾: A组(图4A-B)结构正常, 肾小管上皮微绒毛完整, 核形规则, 相邻细胞间见细胞连接; 肾小球基膜薄厚均匀, 足突与内皮细胞清晰. B组(图4C-D)结构受损轻微, 仅见肾小管上皮细胞核核形不规则及存在大小不等的溶酶体和大的吞饮泡增多, 肾小球足突少部分融合. 外源性应用CO各组(图4E-F)肾组织结构均接近正常, 肾小管上皮微绒毛较完整、核形规则; 肾小球基膜连续, 薄厚较均匀, 足突有局部的融合.
小肠缺血再灌注(IIR)是临床常见的病理生理现象, 严重IIR可最终导致多器官功能障碍综合征(MODS)的形成[8-10]. 我们以大鼠SMA夹闭-开放法建立IIR模型, 发现IIR组(B组)肺、肠、肝、肾组织的超微结构与正常对照组(A组)相比都发生了不同程度的变化, 肠和肺组织损伤严重、肝组织损伤较轻、肾组织损伤不明显. 其中小肠上皮大量微绒毛脱落, 细胞之间连接松弛, 胞质内大部分线粒体嵴溶解, 说明小肠屏障功能严重受损; 肺泡II型上皮核形不规则, 胞质内线粒体空泡变性, 板层小体排空式消失, Ⅰ型上皮细胞破损部分溶解, 内皮细胞大面积溶解, 说明肺气血屏障遭到破坏. 这进一步验证了IIR可导致多器官损伤, 且肺是受到影响最大的远隔器官.
IIR导致MODS的发病机制目前尚未完全阐明. 在全身炎症反应过程中大量释放的炎症介质, 可以通过直接与间接的途径促使血管内皮细胞与器官组织细胞发生细胞凋亡, 同时抑制炎症反应过程中单核巨噬细胞、枯否细胞、PMN的凋亡, 从而促进MODS的发生和发展[11-14]. 一方面, 脏器血管内皮细胞凋亡的增加, 可使微血管通透性增加、炎性细胞聚集、炎症反应增强, 是继发性出血、坏死和DIC的原因之一; 另一方面, 器官实质细胞凋亡的大量发生可能直接使器官结构和功能发生损害直至衰竭. 因此认为细胞凋亡可能是MODS发生的一个重要病理生理机制[15-17]. 对于凋亡, 现阶段人们普遍接受的可能机制有死亡受体途径(Fas途径)[18]和线粒体[19]途径两种. 但细胞凋亡并不完全是一个线性通路: 细胞凋亡中信号分子间相互影响, 构成了细胞凋亡的环性通路-死亡环(death cycle). 在这个死亡环里, 半胱氨酸蛋白酶caspases, 原癌基因Bcl-2, 细胞色素C之间相互作用: 细胞色素能激活procaspase, 而有活性的caspase也能刺激线粒体释放细胞色素C. 这样, 上游分子和下游分子的凋亡信号呈级联放大效应. 而Bcl-2既能在细胞色素上游, 又能在其下游发挥作用. 阻断这种环行放大的级联效应, 能有效地抑制细胞凋亡[20]. 我们发现, 与正常对照组(A组)相比, IIR组(B组)肠和肺组织内凋亡细胞大量出现, 而肝、肾组织内凋亡细胞数目变化不明显, 细胞凋亡数目与各组织超微结构损伤的程度一致, 提示细胞凋亡同IIR引起的多器官损伤具有一定的相关性, 与文献报道相符.
如何有效地防治MODS的发生和发展一直是临床工作所关注的重要课题. 近年来已经有越来越多的研究发现, 过去一直认为CO是毒性气体分子, 而现在发现他作为一种细胞信使分子在生物体内具有舒张血管和支气管平滑肌、抑制血小板聚集、抑制炎症反应、抗凋亡、抗增殖等多种生理学作用[21-25], 在神经、呼吸、循环等生理过程和抑制急性肺损伤、脏器缺血再灌注损伤、器官移植排斥反应等病理过程中发挥重要调节作用[26-29]. Zhang et al在大鼠模型中发现, 低浓度CO可以通过抑制Fas/FasL, caspases表达, 抑制细胞色素C释放, 增强Bcl-2表达等从多方面抑制肺缺血再灌注时肺动脉内皮细胞的凋亡[30]. 本研究有效地探索了外源性应用CO对大鼠IIR所致多器官损伤防治的作用. 与B组相比, C, D, E组肠, 肺, 肝组织超微结构损伤表现轻说明, 外源性应用两种不同浓度CO对大鼠IIR过程中多器官损伤均有防治作用; 而与B组相比, C, D, E组肠, 肺, 肝组织内凋亡细胞数目少说明, CO可以部分通过调控细胞凋亡的发生而达到防治器官损伤的作用; 组织超微结构损伤程度C组比D组, E组表现轻, 表明CO对器官损伤的防治作用在IIR发生过程中早期应用效果更好, 特别是在小肠缺血前应用最为明显; 但从各组内两亚组的组织超微结构损伤的表现程度来看, 100 μL/L与250 μL/L两种不同浓度CO的作用并无明显差异, 从凋亡细胞出现数目比较, 250 μL/L比100 μL/L CO对器官损伤的防治作用强. 我们认为, CO在小肠缺血前应用可能是通过对某种途径的调控早期抑制Fas/FasL、caspases表达, 抑制细胞色素C释放并增强Bcl-2表达, 从而抑制IIR中组织细胞大量凋亡的发生, 预防组织器官在结构和功能上进一步的损害, 实现对器官损伤的防治作用; 而在缺血及再灌注后应用, 虽然CO也能通过这种途径对器官损伤起到治疗作用, 但由于损害已经部分发生, 因此CO的这种作用减弱.
小肠缺血再灌注是临床常见的病理生理过程, 严重时可导致多器官功能障碍综合征形成, 而人们发现一直被认为是一种具有毒性的气体一氧化碳, 作为一种细胞信使在生物体各种生理和病理过程中发挥重要调节作用.
现已发现CO在生物体内具有舒张血管和支气管平滑肌、抑制血小板聚集、抑制炎症反应、抗凋亡、抗增殖等多种生理学作用, 在神经、呼吸、循环等生理过程中和抑制急性肺损伤、脏器缺血再灌注损伤、器官移植排斥反应等病理过程中发挥重要调节作用.
本文发现, 外源性CO对大鼠ⅡR所致多器官损伤具有防治作用, 且浓度为250 μL/L的CO比100 μL/L的CO作用更明显; 缺血前应用比缺血及再灌注后应用作用更明显, 外源性CO对ⅡR所致器官损伤的防治作用可能是通过调控细胞凋亡实现的.
本文通过建立大鼠IIR模型, 观察外源性应用CO对IIR中不同器官超微结构及细胞凋亡的影响, 探讨外源性CO 对IIR所致多器官损伤的防治作用, 为临床治疗MODS提供新的参考.
本文紧密结合临床常见问题, 设计合理, 实验方法先进, 数据可靠, 结果可信, 论述较全面, 对临床上防治小肠缺血再灌注损伤有参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Stallion A, Kou TD, Latifi SQ, Miller KA, Dahms BB, Dudgeon DL, Levine AD. Ischemia/reperfusion: a clinically relevant model of intestinal injury yielding systemic inflammation. J Pediatr Surg. 2005;40:470-477. [PubMed] |
| 2. | Caty MG, Guice KS, Oldham KT, Remick DG, Kunkel SI. Evidence for tumor necrosis factor-induced pulmonary microvascular injury after intestinal ischemia-reperfusion injury. Ann Surg. 1990;212:694-700. [PubMed] |
| 3. | Kim HP, Ryter SW, Choi AM. CO as a cellular signaling molecule. Annu Rev Pharmacol Toxicol. 2006;46:411-449. [PubMed] |
| 4. | Wu L, Wang R. Carbon monoxide: endogenous production, physiological functions, and pharmacological applications. Pharmacol Rev. 2005;57:585-630. [PubMed] |
| 5. | Farrugia G, Miller SM, Rich A, Liu X, Maines MD, Rae JL, Szurszewski JH. Distribution of heme oxygenase and effects of exogenous carbon monoxide in canine jejunum. Am J Physiol. 1998;274:G350-358. [PubMed] |
| 6. | Ryter SW, Otterbein LE. Carbon monoxide in biology and medicine. Bioessays. 2004;26:270-280. [PubMed] |
| 7. | Koike K, Moore FA, Moore EE, Poggetti RS, Tuder RM, Banerjee A. Endotoxin after gut ischemia/reperfusion causes irreversible lung injury. J Surg Res. 1992;52:656-662. [PubMed] |
| 8. | Schmeling DJ, Caty MG, Oldham KT, Guice KS, Hinshaw DB. Evidence for neutrophil-related acute lung injury after intestinal ischemia-reperfusion. Surgery. 1989;106:195-201; discussion 201-202. [PubMed] |
| 9. | Koike K, Moore EE, Moore FA, Kim FJ, Carl VS, Banerjee A. Gut phospholipase A2 mediates neutrophil priming and lung injury after mesenteric ischemia-reperfusion. Am J Physiol. 1995;268:G397-403. [PubMed] |
| 11. | Efstathopoulos N, Tsaganos T, Giamarellos-Bourboulis EJ, Kaldis P, Nicolaou V, Papalois A, Koutoukas P, Papachristou G, Giamarellou H. Early apoptosis of monocytes contributes to the pathogenesis of systemic inflammatory response and of bacterial translocation in an experimental model of multiple trauma. Clin Exp Immunol. 2006;145:139-146. [PubMed] |
| 12. | Crimi E, Zhang H, Han RN, Sorbo LD, Ranieri VM, Slutsky AS. Ischemia and reperfusion increases susceptibility to ventilator-induced lung injury in rats. Am J Respir Crit Care Med. 2006;174:178-186. [PubMed] |
| 13. | Cavaillon JM, Adrie C, Fitting C, Adib-Conquy M. Reprogramming of circulatory cells in sepsis and SIRS. J Endotoxin Res. 2005;11:311-320. [PubMed] |
| 14. | Semmler A, Okulla T, Sastre M, Dumitrescu-Ozimek L, Heneka MT. Systemic inflammation induces apoptosis with variable vulnerability of different brain regions. J Chem Neuroanat. 2005;30:144-157. [PubMed] |
| 15. | Zhu Q, Qian X, Wang S, Yin T, Yang J, Xue Q, Xu B. A comparison of elderly and adult multiple organ dysfunction syndrome in the rat model. Exp Gerontol. 2006;41:771-777. [PubMed] |
| 16. | Barnett CC, Moore EE, Moore FA, Biffl WL, Smith MF Jr, Carl VS. Intercellular adhesion molecule-1 promotes neutrophil-mediated cytotoxicity. Surgery. 1995;118:171-175; discussion 176. [PubMed] |
| 18. | Lopatinskaya L, Zwemmer J, Uitdehaag B, Lucas K, Polman C, Nagelkerken L. Mediators of apoptosis Fas and FasL predict disability progression in multiple sclerosis over a period of 10 years. Mult Scler. 2006;12:704-709. [PubMed] |
| 19. | Nijhuis EH, Poot AA, Feijen J, Vermes I. Induction of apoptosis by heat and gamma-radiation in a human lymphoid cell line; role of mitochondrial changes and caspase activation. Int J Hyperthermia. 2006;22:687-698. [PubMed] |
| 21. | Otterbein LE, Mantell LL, Choi AM. Carbon monoxide provides protection against hyperoxic lung injury. Am J Physiol. 1999;276:L688-694. [PubMed] |
| 23. | Kohmoto J, Nakao A, Stolz DB, Kaizu T, Tsung A, Ikeda A, Shimizu H, Takahashi T, Tomiyama K, Sugimoto R. Carbon monoxide protects rat lung transplants from ischemia-reperfusion injury via a mechanism involving p38 MAPK pathway. Am J Transplant. 2007;7:2279-2290. [PubMed] |
| 24. | Raman KG, Barbato JE, Ifedigbo E, Ozanich BA, Zenati MS, Otterbein LE, Tzeng E. Inhaled carbon monoxide inhibits intimal hyperplasia and provides added benefit with nitric oxide. J Vasc Surg. 2006;44:151-158. [PubMed] |
| 25. | Otterbein LE, Otterbein SL, Ifedigbo E, Liu F, Morse DE, Fearns C, Ulevitch RJ, Knickelbein R, Flavell RA, Choi AM. MKK3 mitogen-activated protein kinase pathway mediates carbon monoxide-induced protection against oxidant-induced lung injury. Am J Pathol. 2003;163:2555-2563. [PubMed] |
| 26. | Otterbein LE, Bach FH, Alam J, Soares M, Tao Lu H, Wysk M, Davis RJ, Flavell RA, Choi AM. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway. Nat Med. 2000;6:422-428. [PubMed] |
| 27. | Lee S, Suk K. Heme oxygenase-1 mediates cytopro-tective effects of immunostimulation in microglia. Biochem Pharmacol. 2007;74:723-729. [PubMed] |
| 28. | Wen T, Zhao JY, Mei S, Guan L, Zhang YL. Protective effect of heme oxygenase-1 and its reac-tion product, carbon monoxide on acute liver injury induced by carbon tetrachloride in rats. Beijing Da Xue Xue Bao. 2006;38:618-622. [PubMed] |
| 29. | Kohmoto J, Nakao A, Kaizu T, Tsung A, Ikeda A, Tomiyama K, Billiar TR, Choi AM, Murase N, McCurry KR. Low-dose carbon monoxide inhalation prevents ischemia/reperfusion injury of transplanted rat lung grafts. Surgery. 2006;140:179-185. [PubMed] |
| 30. | Zhang X, Shan P, Alam J, Davis RJ, Flavell RA, Lee PJ. Carbon monoxide modulates Fas/Fas ligand, caspases, and Bcl-2 family proteins via the p38alpha mitogen-activated protein kinase pathway during ischemia-reperfusion lung injury. J Biol Chem. 2003;278:22061-22070. [PubMed] |