修回日期: 2007-09-25
接受日期: 2007-09-28
在线出版日期: 2007-10-18
目的: 探讨DMSO诱导处理的HepG2细胞被HBV感染的作用机制.
方法: 将HepG2分为DMSO处理组和对照组,分别用添加或不添加2% DMSO的DMEM培养基培养4 d. 将HBV病毒颗粒(1000拷贝/细胞)加入培养基中于37℃感染12 h. 以蛋白免疫印迹, 免疫荧光染色及共聚焦显微镜观察HBcAg在细胞内的定位. 选择性PCR检测HBV cccDNA, 流式细胞分析仪检测细胞周期.
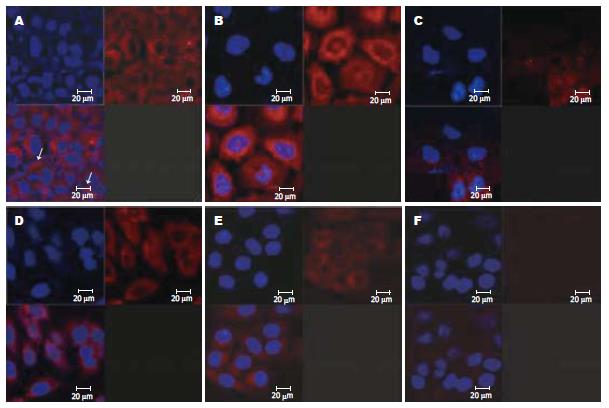
结果: 对照组HepG2细胞在感染HBV阳性血清后, HBcAg在细胞质内分布, 核内呈阴性, 至感染后2 d细胞内核心蛋白消失, 未检出明显的cccDNA信号. 2% DMSO处理后的HepG2细胞感染后12 h细胞质内HBcAg水平明显高于对照组, 感染后24 h HBcAg在核周浓集. 在感染后24 h和48 h核内HBcAg明显增高, 且cccDNA结果阳性. 流式分析结果显示DMSO处理后处于G1/G0和G2/M期的HepG2比例升高, 处于有丝分裂期的HepG2细胞内HBcAg弥散分布于全细胞.
结论: HepG2细胞感染HBV后核心颗粒不能穿过核孔携带HBV DNA进入细胞核可能是其抵制HBV感染的重要原因. DMSO可促进HBV核心颗粒进入细胞核而有助于感染.
引文著录: 潘孝本, 韩进超, 魏来, 高燕, 丛旭. DMSO促进HepG2细胞感染乙型肝炎病毒后核心蛋白入核. 世界华人消化杂志 2007; 15(29): 3079-3084
Revised: September 25, 2007
Accepted: September 28, 2007
Published online: October 18, 2007
AIM: To study the effect of dimethyl sulphoxide on the nuclear entry of hepatitis B virus core protein in infected HepG2 cells.
METHODS: In the DMSO and control groups, HepG2 cells were cultured in DMEM with or without 2% DMSO for 4 d. Then the cells were incubated with HBV (1000 copies per cells) for 12 hours at 37℃. Hepatitis B core antigen (HBcAg) in the infected HepG2 cells was stained by fluorescent immunocytochemistry and observed by confocal microscopy. HBcAg in the cytoplasm and nucleus was respectively extracted and analyzed by Western blotting. HBV covalently closed circular DNA (cccDNA) was detected by ploymerase chain reaction, and cell cycle was analyzed by flow cytometry.
RESULTS: In control HepG2 cells, HBcAg was mostly expressed in cytoplasm and almost absent from the nucleus, and it disappeared from the cells at 2 days post infection (PI). No obvious sign of cccDNA was detected in the control group at 2 days. After DMSO administration, compared with that of control group, a higher level of HBcAg was detected in the cytoplasm at 12 hours PI. HBcAg was accumulated around the nucleus at 24 hours PI. The level of HBcAg in the nucleus obviously increased and cccDNA was present at 24 and 48 hours PI. Flow cytometry showed that DMSO increased the ratio of G1/G0 and G2/M phases of HepG2 cells. HBcAg was distributed throughout the cells in mitosis phase HepG2 cells.
CONCLUSION: In HepG2 cells, blocking the entry of core particles to the nucleus might be an important reason for the cells being refractory to HBV infection. DMSO promotes nuclear entry of core protein/core particles and then facilitates HBV infection.
- Citation: Pan XB, Han JC, Wei L, Gao Y, Cong X. Dimethyl sulphoxide facilitates the nuclear entry of hepatitis B virus core protein in infected HepG2 cells. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3079-3084
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3079.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3079
乙型肝炎病毒(HBV)是嗜肝DNA病毒, 为双层衣壳结构, 包括含表面蛋白(HBsAg)的外包膜和由核心蛋白组成的核衣壳结构. HBV感染细胞的过程大致包括病毒外包膜与细胞表面特异性受体的结合, 随后病毒入胞, 在吞噬泡中脱去外衣壳, 核心蛋白携带HBV DNA进入细胞核并修补为共价闭合环状DNA(cccDNA)[1-5]. 既往建立了许多肝(癌)细胞系可支持HBV复制, 但极少有肝细胞系能稳定支持完整HBV生活周期, 因此目前对HBV的感染细胞过程了解并不透彻[6-9]. HepG2细胞是目前最常用的肝癌细胞系之一, 可支持HBV的复制不被HBV自然感染, 但经DMSO处理的HepG2细胞可被HBV感染[10]. DMSO也能提高鸭乙型肝炎病毒(DHBV)感染鸭原代肝细胞和HBV感染人原代肝细胞模型中的HBV复制水平并延长感染系统的病毒复制时间[11-14]. 近年有研究认为, DMSO处理HepG2细胞可极大提高细胞表面针对HBsAg Pre S1区肽段的病毒受体表达水平, 从而有利于HBV黏附和进入细胞[10,15].
我们对HepG2细胞系进行DMSO处理并进行HBV感染, 采用高灵敏的免疫细胞化学染色及共聚焦显微镜跟踪进入细胞的核心蛋白, 检测细胞内的病毒复制情况. 结果显示, 天然的HepG2细胞在感染HBV时可以摄取病毒颗粒进入胞质, 但未观察到病毒核心颗粒向细胞核内转移的过程. DMSO处理的HepG2细胞增加了摄取病毒颗粒的能力, 并可观察到感染24 h后HepG2细胞核内核心蛋白阳性明显增强, 且与cccDNA的形成时间一致. 我们的研究显示, DMSO处理不仅能增加对HBV的摄取, 同时也有利于HBV的核心蛋白入核, 这为DMSO在HBV细胞模型中的生物学效应提供了新的解释.
HepG2细胞购自中国科学院细胞生物研究所, Dane's颗粒来源于HBV阳性血清(ady亚型), FBS(Hyclone, 美国), DMEM(Sigma, 美国), 抗-HBcAg一抗(1:100稀释, 兔来源, Signet, 美国), 二抗Cy3标记的羊抗兔IgG(1:100, 博士德生物技术公司, 中国), DAPI(Vector, 美国), TCS-NT型激光扫描共聚焦显微镜和Q550IW图象分析仪(Leica, 德国), NE-PERTM胞质胞核蛋白提取试剂盒(Pierce公司, 美国), 兔抗β-actin(1:1000), 鼠抗-HBc抗体(1:200), HRP标记的抗兔IgG和抗鼠IgG(1:1000)均购自于Santa Cruze; X光片(Kodak, 美国), 流式细胞仪(Becton Dickinson, FACS Calibur, 美国).
1.2.1 HepG2细胞分组和感染: 经实时定量PCR检测的HBV DNA阳性血清以无血清DMEM培养基稀释至2.5×1011拷贝/L. HepG2细胞复苏后分为两组, 对照组和DMSO组, 分别以含或不含20 mL/L DMSO的100 mL/L FBS DMEM培养4 d. 细胞接种至6孔板, 生长至铺满60%面积时(约5×105/孔)开始感染试验. 每孔加入2 mL病毒孵育液, 此为感染后0 h, 37℃孵育12 h, 感染完成后用PBS洗两次, 并加入酸洗脱液(50 mmol甘氨酸, 150 mmol NaCl, 加1 mol HCl调节至pH2.2)浸泡2 min后再以PBS洗3次以尽可能去除黏附病毒. 加入相应含或不含2% DMSO含4% FBS DMEM继续培养.
1.2.2 感染后病毒蛋白检测: 细胞接种于预置盖玻片的六孔板. 培养至60%汇合后如上述分组进行HBV感染实验, 于感染后12 h、24 h、48 h取样本进行免疫荧光细胞化学检测, 以监测HBV感染实验后病毒蛋白HBsAg和HBcAg的动态运动过程. 检测方法如下: 感染后HepG2细胞40 g/L多聚甲醛4℃固定过夜, 50 g/L Trinton-PBS透膜10 min. 加抗-HBcAg一抗4℃过夜, 二抗为Cy3标记的羊抗兔IgG, 室温孵育1 h. 以荧光染料500 mg/L DAPI进行细胞核DNA荧光染色, 用TCS-NT型激光扫描共聚焦显微镜和Q550IW图象分析仪观察各蛋白的细胞内分布情况.
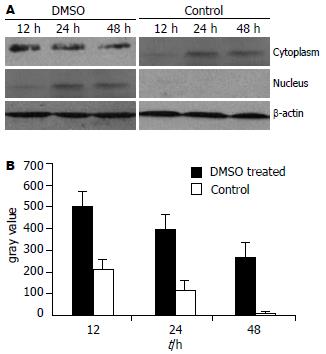
1.2.3 免疫印迹分析: 采用NE-PERTM胞质胞核蛋白提取试剂盒分别提取细胞的胞质和胞核蛋白, SDS-PAGE电泳及转膜, 加入兔抗β-actin(1:1000)和鼠抗-HBc抗体(1:200), HRP标记的抗兔IgG, 抗鼠IgG(1:1000)和ECL显色, 显影于X光片上. 用Umax2100XL扫描及Quantity One图像分析系统测定光密度值(A值).
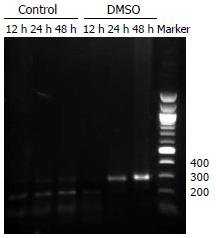
1.2.4 选择性PCR扩增cccDNA: 基于rcDNA的正链和负链上均存在缺口, 设计跨越两个缺口的引物, 使rcDNA不被扩增, 而cccDNA由于有完整的双链可以选择性地扩增. 实验流程及扩增条件按参考文献稍作调整[16-18]: 以酚/氯仿法提取细胞总DNA, 取800 ng的细胞DNA (10 µL)加入10 µL含20 U MBN酶缓冲体系(2 mmol ZnCl2, 100 mmol NaAC, 60 mmol NaCl). 37℃消化30 min后2.5 µL EGTA(100 mmol, pH7.4)终止. 取5 µL样本做第一轮PCR, 取2 µL的第一轮PCR产物进行第二轮PCR. 引物序列见表1. 以含1.2倍HBV DNA全长的pUC18-HBV1.2为阳性对照, 以培养上清中HBV DNA为阴性对照.
| Direction | Primer Sequence (5'3') | Position |
| Sense | ctg aatcccgcggacgaccc | 1441-1460 |
| Antisense | acccaaggcacagcttgg agg | 1889-1869 |
| Sense | gtctgtgccttctcatctgcc | 1551-1571 |
| Antisense | agatgattaggcagaggtgaa aaa | 1844-1821 |
1.2.5 流式细胞仪分析细胞周期: 对照组及DMSO处理4 d后的HepG2细胞以0.025 g/L胰酶消化得到单细胞悬液. 细胞计数取1×106细胞, 体积调至1 mL. 加700 mL/L冷乙醇2.5 mL混匀, 固定破膜4℃过夜, 以含1% BSA的PBS缓冲液洗后, 加入900 µL含有1% BSA的PBS缓冲液重悬细胞. 加终浓度为50 mg/L RNA酶37℃孵育30 min, 冰浴终止RNA酶作用. 加入100 µL浓度为500 mg/L的PI暗处4℃ 30 min. 300目筛网过滤, 流式细胞仪进行细胞周期分析.
统计学处理 对照组和DMSO处理组胞质中的核心蛋白水平以SPSS10.0软件(SPSS公司, 美国)进行统计学处理.
在对照组, 感染后12 h及24 h可见胞质内有核心蛋白呈均匀分布, 但胞核内未见; 到第48 h胞质内核心蛋白基本消失, 胞核内仍阴性. 在DMSO处理组, 感染后12 h胞质内HBcAg信号较强, 核心蛋白在细胞多呈均匀分布, 胞核内未见明显阳性信号. 在感染后24 h核心蛋白在核膜周边明显浓集, 核内可见有明显HBcAg阳性信号. 至感染后48 h胞质中核心蛋白水平明显减弱, 胞核中核心蛋白水平明显增强. 约5%-10%的HepG2细胞被阻滞于有丝分裂期, 染色体浓集, 核心蛋白分布在整个细胞(图1).
Western blot对胞质和胞核中的核心蛋白定量分析结果显示, 在对照组, 感染后12 h和24 h的细胞质中虽可检出有明显核心蛋白灰度信号, 但胞核内信号基本阴性, 感染后48 h胞质中HBcAg信号基本消失. 在DMSO处理组, 感染后12 h胞质中的核心蛋白水平约为对照组2-3倍, 感染后24 h和48 h在胞核中可检出核心蛋白信号(图2).
PCR扩增产物长度为294 bp. 对照组HepG2细胞中cccDNA感染后24 h和48 h仅有微弱阳性信号, DMSO处理组感染后24 h和48 h则均有较强的阳性信号(图3).
由于缺乏良好的HBV细胞感染模型, HBV感染肝细胞的过程迄今为止并不十分清楚. 一般认为, HBV感染细胞后通过其核心蛋白C末端核定位序列(NLS)的功能引导HBV DNA进入细胞核, 释放出HBV DNA并最终转化为cccDNA以完成病毒的感染[5,19]. 是核心颗粒先在胞质中解聚而后HBV DNA进入细胞核, 还是核心颗粒以完整的形式运输HBV DNA进核后再解聚, 一直有所争议[20-21]. 既往研究显示, 能通过核孔运输物质的最大直径不超过26 nm[22], 而核心颗粒的直径为32 nm或36 nm, 因此不能支持核心颗粒直接入核. 但Pante et al[23]认为核孔摄取颗粒的直径最高可达39 nm, 核心颗粒可以以完整的颗粒形式穿过细胞核孔进入胞核. 在转基因小鼠的研究中则显示核膜对完整的核心颗粒构成限制, 核心蛋白在核内可以以浓度依赖的方式重新组装[24-25].
免疫细胞化学结果显示, 在无DMSO预处理情况下, HepG2细胞感染HBV后也可以观察到核心蛋白在细胞质内均匀分布, 核内则未检出. 这显示天然的HepG2细胞具有与HBV结合并摄取病毒进入胞质的能力, 与既往研究结果相似[26]. 核心蛋白胞质内均匀分布而核内无分布, 提示入胞后的病毒核心颗粒可能保持完整颗粒形式, 且其核定位序列并没有很好的暴露, 因而并未进入细胞核. 而感染后48 h核心蛋白基本消失, 可能因核心蛋白为细胞内蛋白酶消化所致. 在DMSO处理组, 感染后HepG2细胞的胞质内核心蛋白水平明显高于对照组, 显示DMSO处理后有更多的病毒颗粒进入细胞, 这一结果与既往研究显示DMSO处理能提高HepG2细胞病毒特异性受体表达, 增加病毒颗粒的摄取相似[10]. 此外, DMSO处理组HepG2细胞感染后24 h核心蛋白明显聚集于核膜周边, 而感染后24 h和48 h核内信号明显阳性, 提示DMSO可能通过某种方式促进核心蛋白核定位信号的暴露, 从而发挥其核定向功能使HBcAg向细胞核周聚集. 既往研究显示, 在HBV的生活周期中核心蛋白的磷酸化和去磷酸化有助于核心颗粒的核定位序列的暴露及HBV DNA的解离和pgRNA的包装[5,27-30]. DMSO是否也可通过提高核心蛋白的磷酸化水平, 促进其入核并最终发挥其运输HBV DNA入核的功能, 有待进一步研究. 感染后24 h和48 h细胞核内核心蛋白阳性, 同时也可检出cccDNA, 推测cccDNA的形成可能与DMSO促进核心蛋白入核, 从而携带HBV DNA入核有关. 相对于对照组感染后48 h胞质中核心蛋白已近阴性而DMSO组为阳性, 推测感染后细胞已有新的核心蛋白产生.
从流式细胞分析的结果来看, DMSO对细胞周期产生了明显影响, 更多的细胞停留于G1/G0期或被阻滞于M期. 既往研究显示, G1期的细胞有较多的核心蛋白进入细胞核, 有助于rcDNA定位于细胞核[31], 与我们的观察一致. 此外, 由于在有丝分裂期细胞核膜溶解, 使得核膜隔离效应消除, 这显然也消除了核心颗粒入核障碍, 而细胞核可能提供了促使核心颗粒解聚的微环境, 从而有助于核心颗粒内HBV DNA的释放. 在对照组细胞感染后24 h及48 h亦可检出有微弱的cccDNA, 推测这些cccDNA的形成亦可能来源于少量处于有丝分裂期的HepG2细胞.
总之, 我们的研究显示, 在HepG2感染HBV后, 存在核心颗粒入核障碍可能是其抵制HBV感染的重要原因. DMSO可能因有利于核心蛋白入核而携带HBV DNA进入细胞核, 从而完成病毒的感染过程.
迄今为止缺乏良好的HBV感染细胞模型, 这极大的限制了对HBV生活周期的了解. 经DMSO诱导处理可使HepG2细胞被HBV感染, 但其作用机制并不十分明确.
当前研究认为HBV感染细胞后通过其核心蛋白C末端核定位序列(NLS)的功能引导HBV DNA进入细胞核, 释放出HBV DNA并最终转化为cccDNA以完成病毒的感染. 但是核心颗粒先在胞质中解聚而后HBV DNA进入细胞核, 还是核心颗粒以完整的形式运输HBV DNA进核后再解聚, 一直有所争议.
既往研究显示, 能通过核孔运输物质的最大直径不超过26 nm, 而核心颗粒的直径为32 nm或36 nm, 因此不能支持核心颗粒直接入核. 但也有研究认为核孔摄取颗粒的直径最高可达39 nm, 核心颗粒可以以完整的颗粒形式穿过细胞核孔进入胞核. 在HepG2细胞的HBV感染研究中, 有研究结果认为其表面受体表达不足, 但也有研究认为其表面有足够受体表达, 但是存在病毒核心颗粒的入核障碍.
本研究发现HepG2细胞感染HBV核膜对核心蛋白入核构成障碍, DMSO可促进HBV核心颗粒进入细胞核而有助于感染. 这对DMSO有助于HBV复制和感染的机制提出了新的解释.
本文对DMSO促进核心蛋白入核的观察有助于HBV核心颗粒入核机制的研究.
1 cccDNA: 共价闭合环状的HBV DNA, 是HBV成功感染细胞的标志, 在胞核中形成, 是乙型肝炎病毒转录和复制的模板.
2 NLS: 核定位序列, 是一段比较保守的蛋白序列, 其可以与细胞内的importins蛋白结合, 与病毒蛋白进入细胞核有关.
本文内容具有一定的创新性, 论证有据, 图片清晰, 有很好的参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | CSeeger C, Mason WS. Hepatitis B virus biology. Microbiol Mol Biol Rev. 2000;64:51-68. [PubMed] |
| 2. | Beck J, Nassal M. Hepatitis B virus replication. World J Gastroenterol. 2007;13:48-64. [PubMed] |
| 3. | Bruss V. Hepatitis B virus morphogenesis. World J Gastroenterol. 2007;13:65-73. [PubMed] |
| 4. | Kock J, Kann M, Putz G, Blum HE, Von Weizsacker F. Central role of a serine phosphorylation site within duck hepatitis B virus core protein for capsid trafficking and genome release. J Biol Chem. 2003;278:28123-28129. [PubMed] |
| 5. | Rabe B, Vlachou A, Pante N, Helenius A, Kann M. Nuclear import of hepatitis B virus capsids and release of the viral genome. Proc Natl Acad Sci U S A. 2003;100:9849-9854. [PubMed] |
| 6. | zu Putlitz J, Roberts EA, Wieland S, Kono Y, Blum HE. Hepatitis B virus replication and viral antigen synthesis in hepatocyte lines derived from normal human liver. Virus Res. 1997;52:177-182. [PubMed] |
| 7. | Fellig Y, Almogy G, Galun E, Ketzinel-Gilad M. A hepatocellular carcinoma cell line producing mature hepatitis B viral particles. Biochem Biophys Res Commun. 2004;321:269-274. [PubMed] |
| 8. | Gripon P, Rumin S, Urban S, Le Seyec J, Glaise D, Cannie I, Guyomard C, Lucas J, Trepo C, Guguen-Guillouzo C. Infection of a human hepatoma cell line by hepatitis B virus. Proc Natl Acad Sci U S A. 2002;99:15655-15660. [PubMed] |
| 9. | Guha C, Mohan S, Roy-Chowdhury N, Roy-Chowdhury J. Cell culture and animal models of viral hepatitis. Lab Anim (NY). 2004;33:37-46. [PubMed] |
| 10. | Paran N, Geiger B, Shaul Y. HBV infection of cell culture: evidence for multivalent and cooperative attachment. EMBO J. 2001;20:4443-4453. [PubMed] |
| 11. | Gripon P, Diot C, Theze N, Fourel I, Loreal O, Brechot C, Guguen-Guillouzo C. Hepatitis B virus infection of adult human hepatocytes cultured in the presence of dimethyl sulfoxide. J Virol. 1988;62:4136-4143. [PubMed] |
| 12. | Pugh JC, Summers JW. Infection and uptake of duck hepatitis B virus by duck hepatocytes maintained in the presence of dimethyl sulfoxide. Virology. 1989;172:564-572. [PubMed] |
| 13. | Rumin S, Gripon P, Le Seyec J, Corral-Debrinski M, Guguen-Guillouzo C. Long-term productive episomal hepatitis B virus replication in primary cultures of adult human hepatocytes infected in vitro. J Viral Hepat. 1996;3:227-238. [PubMed] |
| 14. | Glebe D, Berting A, Broehl S, Naumann H, Schuster R, Fiedler N, Tolle TK, Nitsche S, Seifer M, Gerlich WH. Optimised conditions for the production of hepatitis B virus from cell culture. Intervirology. 2001;44:370-378. [PubMed] |
| 15. | Ruvoletto MG, Tono N, Carollo D, Vilei T, Trentin L, Muraca M, Marino M, Gatta A, Fassina G, Pontisso P. Surface expression of squamous cell carcinoma antigen (SCCA) can be increased by the preS1(21-47) sequence of hepatitis B virus. J Gen Virol. 2004;85:621-624. [PubMed] |
| 16. | Hagelstein J, Fathinejad F, Stremmel W, Galle PR. pH-independent uptake of hepatitis B virus in primary human hepatocytes. Virology. 1997;229:292-294. [PubMed] |
| 17. | Stoll-Becker S, Repp R, Glebe D, Schaefer S, Kreuder J, Kann M, Lampert F, Gerlich WH. Transcription of hepatitis B virus in peripheral blood mononuclear cells from persistently infected patients. J Virol. 1997;71:5399-5407. [PubMed] |
| 18. | Mazet-Wagner AA, Baclet MC, Loustaud-Ratti V, Denis F, Alain S. Real-time PCR quantitation of hepatitis B virus total DNA and covalently closed circular DNA in peripheral blood mononuclear cells from hepatitis B virus-infected patients. J Virol Methods. 2006;138:70-79. [PubMed] |
| 19. | Kann M, Sodeik B, Vlachou A, Gerlich WH, Helenius A. Phosphorylation-dependent binding of hepatitis B virus core particles to the nuclear pore complex. J Cell Biol. 1999;145:45-55. [PubMed] |
| 20. | Ning B, Shih C. Nucleolar localization of human hepatitis B virus capsid protein. J Virol. 2004;78:13653-13668. [PubMed] |
| 21. | Kann M, Lu X, Gerlich WH. Recent studies on replication of hepatitis B virus. J Hepatol. 1995;22:9-13. [PubMed] |
| 22. | Dworetzky SI, Lanford RE, Feldherr CM. The effects of variations in the number and sequence of targeting signals on nuclear uptake. J Cell Biol. 1988;107:1279-1287. [PubMed] |
| 23. | Pante N, Kann M. Nuclear pore complex is able to transport macromolecules with diameters of about 39 nm. Mol Biol Cell. 2002;13:425-434. [PubMed] |
| 24. | Guidotti LG, Martinez V, Loh YT, Rogler CE, Chisari FV. Hepatitis B virus nucleocapsid particles do not cross the hepatocyte nuclear membrane in transgenic mice. J Virol. 1994;68:5469-5475. [PubMed] |
| 25. | Guidotti LG, Matzke B, Chisari FV. Hepatitis B virus replication is cell cycle independent during liver regeneration in transgenic mice. J Virol. 1997;71:4804-4808. [PubMed] |
| 26. | Qiao M, Macnaughton TB, Gowans EJ. Adsorption and penetration of hepatitis B virus in a nonper-missive cell line. Virology. 1994;201:356-363. [PubMed] |
| 27. | Roseman AM, Berriman JA, Wynne SA, Butler PJ, Crowther RA. A structural model for maturation of the hepatitis B virus co00re. Proc Natl Acad Sci U S A. 2005;102:15821-15826. [PubMed] |
| 28. | Perlman DH, Berg EA, O'connor PB, Costello CE, Hu J. Reverse transcription-associated dephosphorylation of hepadnavirus nucleocapsids. Proc Natl Acad Sci U S A. 2005;102:9020-9025. [PubMed] |
| 29. | Melegari M, Wolf SK, Schneider RJ. Hepatitis B virus DNA replication is coordinated by core protein serine phosphorylation and HBx expression. J Virol. 2005;79:9810-9820. [PubMed] |
| 30. | Basagoudanavar SH, Perlman DH, Hu J. Regulation of hepadnavirus reverse transcription by dynamic nucleocapsid phosphorylation. J Virol. 2007;81:1641-1649. [PubMed] |
| 31. | Yeh CT, Chiu HT, Chu CM, Liaw YF. G1 phase dependent nuclear localization of relaxed-circular hepatitis B virus DNA and aphidicolin-induced accumulation of covalently closed circular DNA. J Med Virol. 1998;55:42-50. [PubMed] |