修回日期: 2007-09-27
接受日期: 2007-09-28
在线出版日期: 2007-10-08
目的: 探讨多发性胃肠间质瘤的克隆性及其不同瘤体之间的关系.
方法: 15个大小不同的瘤体均经中性甲醛固定, 石蜡包埋, HE染色和免疫组织化学染色观察确诊后, 应用显微切割技术分离病变及病变周围纤维结缔组织, 提取基因组DNA, 经甲基化敏感的HpaⅡ或HhaⅠ消化, 巢式聚合酶链式反应(PCR)扩增磷酸甘油酸激酶(PGK)和雄激素受体(AR)基因. 通过BstⅪ消化和琼脂糖电泳显示PGK基因单核苷酸多态性; 应用变性聚丙烯酰胺凝胶电泳显示AR基因CAG重复序列长度多态性.
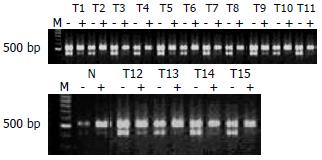
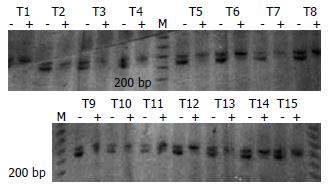
结果: 光镜下瘤细胞主要为梭形, 呈束状、编织状或旋涡状排列; 胞质丰富, 嗜酸性; 细胞核杆状或长梭形. 免疫组化标记瘤细胞表达CD117和CD34强阳性. 克隆性分析结果显示, 所有分析的组织在PGK和AR位点的凝胶电泳图上均表现为两条带, 具有多态性. 其中15个肿瘤组织酶切后下带均消失, 只保留上带, 显示出X染色体失活嵌合性丢失, 证明为肿瘤性病变. 而周围纤维结缔组织在酶切前后两条带密度无明显改变.
结论: 胃肠间质瘤属于单克隆性, 多发性胃肠间质瘤起源相同, 即起源于同一个细胞.
引文著录: 巩丽, 张伟, 李艳红, 王旭霞, 朱少君, 韩秀娟, 苏勤. 多发性胃肠间质瘤的克隆性及其临床病理. 世界华人消化杂志 2007; 15(28): 3001-3005
Revised: September 27, 2007
Accepted: September 28, 2007
Published online: October 8, 2007
AIM: To elucidate the clonality status of multiple gastrointestinal stromal tumors (GISTs) and the relationships among them.
METHODS: Fifteen different tumors were examined by histopathology, immunohistochemistry and clonality assays based on X-chromosomal inactivation mosaicism in female somatic tissues and microdissection. Genomic DNA was isolated from the lesions and the surrounding fibrous connective tissue as controls, pretreated with the methylation-sensitive restriction enzyme HpaⅡor HhaⅠ, and amplified via nested polymerase chain reaction (PCR) using primer pairs specific for the genes encoding phosphoglycerate kinase (PGK) and androgen receptor (AR). A single nucleotide polymorphism (SNP) was identified at the PGK locus by incubation with Bst Ⅺ and agarose gel electrophoresis, and a CAG repeat length polymorphism was revealed at the AR locus on denaturing polyacrylamide gels, and visualized by silver staining.
RESULTS: Microscopically, each sample showed typical histological characteristics. Lesions were composed of spindle cells with abundant cytoplasm, arranged in cords, knit and whirlpool patterns. The nuclei were staff-like or fusiform. Mitosis was widely observed. The tumor tissues showed positive reactions for CD117 and CD34, but not for desmin, S-100, SM-actin and NF. The clonality assays demonstrated polymorphisms at PGK and AR loci, and these were seen on gels containing the PGK and AR PCR products. DNA samples of tissue analyzed without HpaⅡ digestion showed two groups of bands, with equal intensity. When the DNA samples of the lesion tissue were digested with HpaⅡ or HhaⅠ, the lower bands exhibited obviously reduced intensity or disappeared. Monoclonality was demonstrated for the lesion, suggesting that they were neoplastic lesions. However, the intensities of the two bands were equal for the surrounding fibrous connective tissue treated with or without HpaⅡ or HhaⅠ.
CONCLUSION: Gastrointestinal stromal tumors are monoclonal as well as most of tumors, suggesting that they originate from a single cell.
- Citation: Gong L, Zhang W, Li YH, Wang XX, Zhu SJ, Han XJ, Su Q. Clonality status and clinicopathological features of multiple gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2007; 15(28): 3001-3005
- URL: https://www.wjgnet.com/1009-3079/full/v15/i28/3001.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i28.3001
胃肠间质瘤(gastrointestinal stromal tumors, GISTs)是胃肠道最常见的间叶性肿瘤, 起源于表达c-kit(CD117)的Cajal间质细胞[1]. GISTs通常单个发生, 但近年来, 神经纤维瘤病Ⅰ型(NF-1)患者发生GISTs有增长的趋势. NF-1又称为多发性神经纤维瘤病, 是最常见的人单个基因紊乱引起的疾病之一, 可累及全世界范围内100万人和多种组织, 如皮肤、神经组织、骨和软组织[2]. 在NF-1的GISTs临床病理学特征不同于单发的GISTs病例; 其中大多数病例都发生于小肠, 并且c-kit基因的突变或血小板衍生的生长因子受体A(PDGFRA)是很罕见的[3-5]. GISTs只有一部分发生于胃肠道, 其中大部分来自于胃(39%), 小肠(32%)和大肠(15%)[6]. 极少部分见于十二指肠甚至腹腔内的网膜、肠系膜. 近年来, 随着分子生物学和免疫组化技术的不断发展, 对GISTs的认识日渐深入, 并且有了一些显著的进展. 但关于胃肠外多发性GISTs克隆性的研究却未见报道. 我们就发生于一位女性患者的胃肠外多发性GISTs的特殊病例, 探讨其克隆性以及不同瘤体之间的相关性.
患者, 女, 34岁, 间断性腹痛7 d. 查体: 左上腹及左下腹可触及一直径分别约10 cm和7 cm的肿块, B超和CT均提示子宫体、脾脏、子宫与膀胱间、胃胰皱襞间、肝脏右叶、腹腔壁腹膜等处多个囊实性占位. 血AFP<10 µg/L, CEA<7.0 µg/L, CA125<10 µg/L, 均在正常范围. 手术摘除所有可见肿瘤约15个, 并全部送病检.
1.2.1 免疫组织化学: 应用链霉菌抗生物素蛋白-过氧化酶(SP)试剂盒(KIT9730, 福州迈新生物技术开发有限公司), 按厂家说明书进行. 所用第一抗体包括针对CD34、结蛋白(Desmin)、神经特异性烯醇化酶(NSE)、神经纤维(NF)、胶质纤维酸性蛋白(GFAP)的鼠抗人mAb和CD117、S-100蛋白、平滑肌肌动蛋白(SM-actin)及HMB45的兔抗人多克隆抗体以及波形蛋白(vimentin)的鼠抗猪mAb. 以上试剂均购自迈新公司.
1.2.2 显微切割和DNA提取: 所有标本石蜡包埋后制备10 µm切片8张, 经HE染色后, 用100%甘油覆盖组织, 在倒置光显微镜4倍物镜下用4号半注射器针头将病变组织剔出, 收集到装有无水乙醇的1.5 mL Eppendorff管内. 同时分离相同面积的病变旁纤维结缔组织, 作为阴性对照. 经3次无水乙醇洗涤后, 室温放置, 待组织干燥后, 应用QIAamp DNA提取试剂盒(Qiagen GmbH, Germany)按照说明书提取基因组DNA.
1.2.3 克隆性检测PGK和AR位点: 基于女性体细胞组织的X染色体失活嵌合性, 即所有女性体细胞的2条X染色体中的1条在胚胎发育早期必须通过永久甲基化而随机灭活, 另一条保持遗传活性[7]. PGK基因多态性表现为在甲基化位点下游有一个可以被BstⅪ识别的单核苷酸多态性位点, 可经琼脂糖凝胶电泳显示[8]. AR基因多态性表现为其第一外显子的CAG串联重复序列(short-tandem repeat, STR)的长度不同, 即(CAG)n的n值有差别(11-31), 通过变性聚丙烯酰胺凝胶电泳显示[9]. 具有多态性位点的女性个体中正常和多克隆增生的组织显示两条带, 而肿瘤性病变仅显示一条带或以一条带为主[10]. 克隆性检测参照以前的方法进行[11-12]. PGK位点所用序列如下: PGK1A, 5'-CTG TTC CTG CCC GCG CGG TGT TCC GCA TTC-3'; PGK1B, 5'-ACG CCT GTT ACG TAA GCT CTG CAG GCC TCC-3'; PGK2A, 5'-AGC TGG ACG TTA AAG GGA AGC GGG TCG TTA-3'; PGK2B, 5'-TAC TCC TGA AGT TAA ATC AAC ATC CTC TTG-3'. DNA样品经HpaⅡ消化3 h后, 巢式PCR扩增. 第1轮反应含有引物对PGK1A/PGK1B, 97℃ 7 min预变性, 94℃变性40 s, 58℃淬火50 s, 72℃延长1 min, 共35个循环, 72℃延长15 min. 反应产物1:20稀释后, 取5 µL加入第2轮反应体系, 其中含有引物对PGK2A/PGK2B, 除淬火温度为56℃外, 余条件与第1轮相同. 第2轮反应产物再经BstⅪ酶48℃消化8-10 h后, 20 g/L琼脂糖凝胶电泳, 溴化乙锭染色显示结果. AR位点所用序列如下: AR1A, 5'-GAC GAG CTT TCC AGA ATC TG-3'; AR1B, 5'-CAT GGG CTT GGG GAG A-3'; AR2A, 5'-TCC AGA ATC TGT TCC AGA GC-3'; AR2B, 5'-TGG GGA GAA CCA TCC TCA CC-3'. DNA样品在37℃水浴锅内经HhaⅠ消化3 h后, 62℃灭活10 min, 巢式PCR扩增. 第1轮反应和第2轮反应的引物对分别为AR1A/AR1B和AR2A/AR2B, 淬火温度均为56℃, 25个循环. 第1轮反应产物1:100稀释后, 取1 µL加入第2轮反应, 余反应参数同PGK位点的扩增反应. 以上步骤的每一轮PCR都设定阳性对照和水作为阴性对照. 琼脂糖凝胶(20 g/L)电泳评价AR基因扩增效果. 然后将4 µL产物和等体积的上样缓冲液混匀后, 加到厚度为0.8 mm的变性聚丙烯酰胺(100 g/L, 含尿素8 mol/L), 应用miniVE电泳系统(Amersham-Pharmacia Biotech, USA)120 V泳动4 h, 按以前描述的方法[10]进行银染. 电泳结果观察分别用UVP凝胶分析系统(UVP, Cambridge, UK)和光学照相记录数据, 用相应软件(LabWorksTM, UVP)比较HpaⅡ或HhaⅠ消化前后一对等位基因扩增产物的强度差异, 其中1条带可比强度减弱达50%以上时才被认为有意义, 即X染色体失活嵌合性丢失[12].
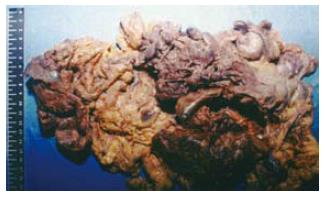
送检肠系膜及大小不等肿物组织一堆, 总体积20 cm×16.5 cm×13 cm, 其中可见肿物约15个, 最大体积10 cm×8.5 cm×7 cm, 最小体积2.8 cm×2.5 cm×2 cm. 大部分肿瘤包膜完整, 切面灰黄, 质中, 局部有出血(图1). 光镜下瘤细胞主要为梭形, 呈束状、编织状或旋涡状排列; 胞质丰富, 嗜酸性; 细胞核杆状或长梭形, 核分裂像易见. 免疫组化标记瘤细胞表达CD117, CD34, S-100, GFAP和vimentin, 余标记物CD30, CD20, CD45RO, CK, EMA, HMB-45, NF, desmin, SM-actin和SC-actin均为阴性.
所有检测组织在PGK和AR位点的凝胶电泳图上均表现为2条带, 有多态性. 其中15个肿瘤组织酶切后下带均消失, 只保留上带, 均显示出X染色体失活嵌合性丢失, 证明为肿瘤性病变. 而周围纤维结缔组织在酶切前后两条带密度无明显改变(图2-3). 这表明, 所有肿瘤组织均为单克隆性病变, 并且起源于同一个细胞.
胃肠间质瘤是一种发生于消化道少见肿瘤. Mazur et al[13]1983年首先提出, 他是指一类既无雪旺氏细胞免疫组化特点又无平滑肌细胞超微结构的胃肠道非上皮细胞性肿瘤. 以往由于病理技术的限制, 以及胃肠道许多梭形细胞肿瘤中残存有平滑肌或神经束, 而认为他是一种平滑肌源性或神经源性肿瘤, 并归类于平滑肌瘤, 平滑肌母细胞瘤或平滑肌肉瘤. 现认为其起源于控制胃肠蠕动的Cajal间质细胞, 有着特殊的免疫表型及组织学特点, 具有向平滑肌, 神经分化或不定向分化的多向分化特征, 是一种具有潜在恶性潜能的胃肠道肿瘤. 国外文献报道每年发病约为10-20/100万, 多发生在40岁以上, 儿童罕见, 男女之比为3:1[6]. 且GISTs只有一部分发生于胃肠道, 其中大部分来自于胃(39%), 小肠(32%)和大肠(15%), 极少数发生于胃肠外.
GISTs通常单个发生, 且大多数都发生在胃, 其次是小肠, 大肠, 食管, 肛门, 胆道和肠外软组织罕见. 然而, 在一些家族性疾病中可多灶性发生, 如Ⅰ型神经纤维瘤病, 并且认为与KIT或血小板衍生的生长因子受体A(PDGFRA)种系的突变有关[14-17]. 由于这些患者的肿瘤常位于小肠, 因此推论可能与Cajal间质细胞的增生有关, 并有相关的临床表现, 如皮肤的色素沉着和肥大细胞的紊乱. GISTs的诊断主要依赖于组织病理学和免疫组化表型, 其中最主要的免疫组化特点就是肿瘤细胞CD117和CD34染色阳性. 根据文献报道, 大约90%-95%的GISTs表达CD117, 60%-70%的GISTs表达CD34, 30%-40%的GISTs表达SM-actin, 而只有5%的GISTs表达S-100蛋白. 当然, vimentin总是阳性的. 通过这些免疫组化特点, 即可与其他间叶性肿瘤, 如雪旺氏细胞瘤或平滑肌瘤相鉴别. 我们对此例也进行了详细的组织病理学观察和免疫组织化学染色, 除了具有典型的形态学特点外, 其肿瘤细胞还强表达CD117和CD34, 多发性GISTs的诊断应该不容置否, 但根据文献报道, 多发性GISTs一般都见于Ⅰ型神经纤维瘤病患者. 为了进一步明确之间的相关性, 我们对这些大小不等的瘤体分别进行了克隆性检测.
克隆性增生是多数肿瘤性病变的特征[18], 通过克隆性分析技术, 即可判断一个病变的性质. PGK和AR位点的克隆性检测是基于女性体细胞组织的X染色体失活嵌合性, 即所有女性体细胞的2条X染色体中的一条在胚胎发育早期必须通过永久甲基化而随机灭活, 另一条保持遗传活性[7]. PGK基因多态性表现为在甲基化位点下游有一个可以被BstⅪ识别的单核苷酸多态性位点, 酶切后可经琼脂糖凝胶电泳显示[8]. AR基因多态性表现为其第一外显子的CAG短串联重复序列(short-tandem repeat, STR)的长度不同, 即重复次数有差别(n = 11-31), 可通过变性聚丙烯酰胺凝胶电泳显示[9]. 具有多态性位点的女性个体中正常组织以及反应性增生的组织都属于多克隆性细胞构成, 显示两条带, 而肿瘤性(单克隆)病变仅显示一条带或以一条带为主[10].
GISTs是近年提出的一种间叶性肿瘤, 关于其克隆起源, 文献上未见报道. 大多数肿瘤是单克隆性增生, 只有一小部分肿瘤是多克隆性增生. 这一点已得到公认. 那么, GISTs是怎样的呢? 多发性GISTs又是怎样的呢? 他们之间存在什么样的关系? 他们与NF-1之间又是什么样的关系呢? 这一系列问题都值得我们进一步探讨. 本实验结果证明, GISTs属于单克隆性, 而大小不等的15个肿瘤酶切后均表现为同一条X染色体失活的嵌合性丢失, 为同一起源, 并且可能是由于侵袭性生长所形成的. 而多发性神经纤维瘤病不同瘤体之间是各自独立的. Wang et al[19]曾分析了28例共82个子宫平滑肌瘤, 证实所有瘤结节均为单克隆起源. 同时对1例高分化平滑肌肉瘤的7个看似独立的瘤结节进行了检测, 结果均显示相同的酶切带型, 证明他们起源于同一个细胞, 属于肿瘤的子宫内侵袭. 而有4例仅有2个结节的多发性平滑肌瘤却显示不同的失活等位基因, 他们之间完全独立; 另有一部分多发性平滑肌瘤, 部分酶切后显示相同的带型, 而其他的则表现为另一条带型, 并由此认为, 多发性子宫平滑肌瘤的各瘤结节的关系, 并不像以前的作者所认为的那么简单, 可能包括完全独立, 局部侵袭和二者的混合型3种类型. 由此我们推论, 此例多发性GISTs可能是肿瘤广泛侵袭形成的, 至于所有的多发性GISTs是否都像上述结果描述的那样, 还需要对更多的病例进行进一步研究证实.
多数肿瘤由单克隆细胞组成, 而正常组织和反应性增生的病变是多克隆的, 利用克隆性分析方法探讨具有同一组织学特征并且同时发生的不同结节性病变的克隆构成, 以区别其是否为肿瘤和同一起源. 这项技术不但对于阐明某些未知病变的性质有重要价值, 而且对于探讨多发性肿瘤的起源、明确他们之间的关系具有重要的意义.
随着分子生物学和免疫组化技术的不断发展, 对 GIST的认识日渐深入, 并且有了一些显著的进展, 但关于胃肠外多发性GISTs克隆性的研究却未见报道, 本文就发生于一位女性患者的胃肠外多发性GISTs的特殊病例, 探讨其克隆性以及不同瘤体之间的相关性.
本文在国内率先运用女性体细胞中PGK位点和AR位点多态性的克隆性分析方法, 探讨多发性胃肠间质瘤的克隆性及其不同瘤体之间的关系, 阐明了他们的本质及其相互关系.
本文探讨多发性胃肠间质瘤的克隆性及其不同瘤体之间的关系, 以阐明其本质, 提供与多发性神经纤维瘤病鉴别的一种可靠手段, 并为进一步阐明多发性胃肠间质瘤的病理发生机制和治疗提供帮助.
本文内容新颖, 语言流畅, 图片清晰, 有一定的科学性和可读性.
编辑: 何燕 电编:何基才
| 1. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33:459-465. [PubMed] |
| 2. | Tsukuda K, Ikeda E, Takagi S, Miyake T, Muraoka T, Watanabe K, Hirai R, Moriyama S, Nawa S, Kunitomo T. Multiple gastrointestinal stromal tumors in neurofibromatosis type 1 treated with laparoscopic surgery. Acta Med Ok. ayama. 2007;61:47-50. [PubMed] |
| 3. | Miettinen M, Fetsch JF, Sobin LH, Lasota J. Gastrointestinal stromal tumors in patients with neurofibromatosis 1: a clinicopathologic and molecular genetic study of 45 cases. Am J Surg Pathol. 2006;30:90-96. [PubMed] |
| 4. | Takazawa Y, Sakurai S, Sakuma Y, Ikeda T, Yamaguchi J, Hashizume Y, Yokoyama S, Motegi A, Fukayama M. Gastrointestinal stromal tumors of neurofibromatosis type I (von Recklinghausen's disease). Am J Surg Pathol. 2005;29:755-763. [PubMed] |
| 5. | Kinoshita K, Hirota S, Isozaki K, Ohashi A, Nishida T, Kitamura Y, Shinomura Y, Matsuzawa Y. Absence of c-kit gene mutations in gastrointestinal stromal tumours from neurofibromatosis type 1 patients. J Pathol. 2004;202:80-85. [PubMed] |
| 6. | Resorlu B, Baltaci S, Resorlu M, Kankaya D, Savas B. Coexistence of papillary renal cell carcinoma and gastrointestinal stromal tumor in a case. Turk J Gastroenterol. 2007;18:47-49. [PubMed] |
| 7. | Lyon MF. X-chromosome inactivation and developmental patterns in mammals. Biol Rev Camb Philos Soc. 1972;47:1-35. [PubMed] |
| 8. | Gilliland DG, Blanchard KL, Levy J, Perrin S, Bunn HF. Clonality in myeloproliferative disorders: analysis by means of the polymerase chain reaction. Proc Natl Acad Sci U S A. 1991;88:6848-6852. [PubMed] |
| 9. | Allen RC, Zoghbi HY, Moseley AB, Rosenblatt HM, Belmont JW. Methylation of HpaII and HhaI sites near the polymorphic CAG repeat in the human androgen-receptor gene correlates with X chromosome inactivation. Am J Hum Genet. 1992;51:1229-1239. [PubMed] |
| 12. | Wang SF, Liu Q, Zhang W, Liu J, Su Q. Clonality of uterine leiomyomas, an assay using X chromosome polymorphism at the phosphoglycerate kinase locus. Di-Si Junyi Daxue Xuebao. 2001;22:1576-1582. |
| 13. | Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-519. [PubMed] |
| 14. | Beghini A, Tibiletti MG, Roversi G, Chiaravalli AM, Serio G, Capella C, Larizza L. Germline mutation in the juxtamembrane domain of the kit gene in a family with gastrointestinal stromal tumors and urticaria pigmentosa. Cancer. 2001;92:657-662. [PubMed] |
| 15. | Hirota S, Okazaki T, Kitamura Y, O'Brien P, Kapusta L, Dardick I. Cause of familial and multiple gastrointestinal autonomic nerve tumors with hyperplasia of interstitial cells of Cajal is germline mutation of the c-kit gene. Am J Surg Pathol. 2000;24:326-327. [PubMed] |
| 16. | Hirota S, Nishida T, Isozaki K, Taniguchi M, Nishikawa K, Ohashi A, Takabayashi A, Obayashi T, Okuno T, Kinoshita K. Familial gastrointestinal stromal tumors associated with dysphagia and novel type germline mutation of KIT gene. Gastroenterology. 2002;122:1493-1499. [PubMed] |
| 17. | Isozaki K, Terris B, Belghiti J, Schiffmann S, Hirota S, Vanderwinden JM. Germline-activating mutation in the kinase domain of KIT gene in familial gastrointestinal stromal tumors. Am J Pathol. 2000;157:1581-1585. [PubMed] |
| 19. | Wang S, Su Q, Zhu S, Liu J, Hu L, Li D. Clonality of multiple uterine leiomyomas. Zhonghua Bing Li Xue Za Zhi. 2002;31:107-111. [PubMed] |