修回日期: 2007-09-14
接受日期: 2007-09-28
在线出版日期: 2007-10-08
目的: 观察改良蛋氨酸胆碱缺乏饮食(MCD)建立的脂肪性肝炎大鼠模型肝脏的脂肪变性和炎症情况.
方法: 大鼠26只随机分为4组, 分别喂养MCD饮食和胆碱添加饮食(CS). 3-8 wk后处死, 肝脏标本在甲醛中固定和石蜡包埋. HE染色和Masson染色后对脂肪变性、炎症和纤维化进行评分. 血清ALT, AST, CH, LDL等指标通过生化分析仪进行测定.
结果: MCD喂养组3 wk可以看见肝脂肪变性和炎症, 肝指数显著增加, ALT和AST显著升高, 8 wk可见纤维形成.
结论: 可通过改良的蛋氨酸胆碱缺乏(MCD)饮食建立非酒精性脂肪肝动物模型.
引文著录: 钱晓武, 范竹萍, 汪晓红, 盛黎, 奚志峰, 邱德凯. 改良蛋氨酸胆碱缺乏饮食喂养的非酒精性脂肪性肝炎大鼠模型的建立. 世界华人消化杂志 2007; 15(28): 2983-2989
Revised: September 14, 2007
Accepted: September 28, 2007
Published online: October 8, 2007
AIM: To establish nonalcoholic steatohepatitis (NASH) rat models with modified methionine-choline-deficient (MCD) diets. Hepatic steatosis and inflammation would be expected in these rats.
METHODS: Rats were randomly divided into 4 groups. Rats were fed with MCD or with choline-supplemented (CS) diets. Weight and food intake were determined. After 3 and 8 weeks, rats were sacrificed; liver specimens were fixed overnight in buffered formaldehyde (40 g/L) and embedded in paraffin. HE-stained and Massion-stained sections were graded blindly for the degree of fatty change, inflammation, fibrosis and necrosis. Serum was measured for biochemical markers.
RESULTS: After 3 weeks on an MCD diet, steatosis and inflammation could be seen in rat livers. The liver index was increased significantly by the MCD diet. Serum ALT and AST levels were also increased significantly, whereas TG levels decreased. After 8 weeks on the diet, fibrogenesis could be seen.
CONCLUSION: Rat NASH models can be established using modified MCD diets.
- Citation: Qian XW, Fan ZP, Wang XH, Sheng L, Xi ZF, Qiu DK. Establishment of nonalcoholic steatohepatitis rat models with modified methionine-choline-deficient diets. Shijie Huaren Xiaohua Zazhi 2007; 15(28): 2983-2989
- URL: https://www.wjgnet.com/1009-3079/full/v15/i28/2983.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i28.2983
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)在美国、澳大利亚、欧洲、亚太地区很多国家内引起慢性肝功能异常最为常见的原因[1-5], 也是隐源性肝硬化的常见原因[6-7]. 非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)是NAFLD的一种病理类型[8], 是进展性疾病[9-10], 可以发展为肝硬化、肝功能衰竭和肝癌等终末期肝病[11-13], 其病理生理机制尚不完全清楚. 疾病的发病机制只有通过与疾病相似的合适动物模型才可以得到阐明, 关于NASH的最新实验数据大部分来源于2种动物模型, 1种是通过基因敲除方法获得的动物模型如ob/ob小鼠; 另一种就是由蛋氨酸胆碱缺乏饮食(methionine-choline deficient, MCD)引起的脂肪性肝炎模型[14-15].
MCD饮食最初由Shinozuka et al[16]提出, 是用于探讨饮食因素对肝脏肿瘤形成的影响, 后来发现在短期内可以引起脂肪性肝炎. 在该模型中, 脂肪性肝炎发展速度快, 3 wk左右可见明显的脂肪性肝炎病变, 10 wk可见明显的肝纤维化, 且引起的脂肪性肝炎病变与人类NASH类似[14]. 使用MCD饮食制造NASH模型是国外进行脂肪性肝炎研究常用的方案, 但因为MCD饮食价格昂贵, 配方复杂, 国内尚没有应用这种饮食造模的报道. 我们通过改良的MCD饮食建立了NASH动物模型.
我们根据实际情况, 在Shinozuka et al[16]配方基础上进行了改良, 具体成分(g/kg): 大豆分离蛋白147.0, 纤维素10.0, 玉米淀粉121.0, 糊精100.0, 蔗糖426.0, 酪蛋白, 不含维生素10.0, 胱氨酸2.0, 善存片2片(每片1.5 g, 含维生素A 7500国际单位, 维生素E 60国际单位, 维生素C 120 mg, 叶酸400 μg, 维生素B1 1.5 mg, 维生素B2 1.7 mg, 烟酰胺20 mg, 维生素B6 2 mg, 维生素B12 6 mg, 维生素D 400国际单位, 生物素30 μg, 泛酸10 mg, 钙162 mg, 磷109 mg, 碘150 μg, 铁9 mg, 镁100 mg, 铜3 mg, 锌22.5 mg, 锰2.5 mg, 钾80 mg, 氯72 mg, 铬65 μg, 铝150 μg, 硒20 μg), NaCl 2.9, CaHPO4 16.6 g, MgSO4 1.6 g, 柠檬酸钾9.9 g, 玉米油50.0 g, 氢化植物油100.0 g, 总计1000.0 g. 大豆分离蛋白购自南通光合生物技术有限公司, 玉米淀粉购自上海绿苑淀粉有限公司, 纤维素购自Sigma公司, 善存片、蔗糖、玉米油购自易初莲花超市, 氢化植物油购自南海油脂工业有限公司, 糊精、酪蛋白、胱氨酸、柠檬酸钾、CaHPO4, NaCl, MgSO4, 氯化胆碱等均为分析纯, 购自国药集团化学试剂有限公司. 添加胆碱饮食为胆碱缺乏饮食基础上每千克饮食减去蔗糖8 g, 添加氯化胆碱8 g. 上述成分充分混匀后高温灭菌后使用, 饮食每周配制1次.
♂清洁级SD大鼠26只(120-140 g), 由中科院上海实验动物中心提供. 普通饲料喂养1 wk后随机分为4组. 1, 2组为正常对照组, 每组5只, 喂养添加胆碱饮食(choline supplemented CS). 3, 4组为模型组, 每组8只, 喂养胆碱缺乏饮食(choline deficient CD). 1, 3组大鼠在3 wk处死, 2, 4组大鼠8 wk处死. 大鼠饲养于仁济医院动物中心, 每笼4-5只, 保持恒温于20-22℃, 12 h光照和黑夜循环, 水和食物均为随意摄取.
1.2.1 一般情况: 大鼠编号后每周称1次体质量, 每2周连续3 d称进食质量. 处死前称体质量, 观察食欲行为、状态、毛发情况. 处死前大鼠隔夜禁食, 第2天称体质量, 麻醉后固定, 从下腔静脉取血, 迅速切下肝脏, 称湿质量, 计算肝指数(肝湿质量/体质量×100%). 从肝右叶切除1 cm×2 cm大小, 用中性甲醛液固定, 石蜡包埋, 切片用HE染色和Masson染色, 光镜下评估肝脂肪变性和炎症活动情况, Masson染色评估肝纤维化情况. 血标本取血清置于-70℃冰箱中保存. 其他肝脏和脂肪组织迅速置于液氮中冻存.
1.2.2 血清生化及肝脏TG测定: 血清ALT, AST, TG等的测定在Bayer Advia 1650全自动生化分析仪上进行. 肝脏TG测定: 精确称量肝脏0.5 g, 制成匀浆后, 加入异丙醇5 mL, 混匀后静置2 h, 2500 r/min 离心30 min后, 取上清测定肝脏TG含量, 测定仪器同上.
1.2.3 病理学检查: HE切片光镜下评估肝脏脂肪变性和炎症活动情况. 肝脏脂肪变性标准按肝小叶内含脂滴细胞数/总细胞数之比值分为0(-), 计分为0, <1/3(+), 计分为1, 1/3-2/3(++), 计分为2, >2/3(+++), 计分为3, = 1(++++)计分为4. NASH的病理诊断标准采用亚太地区非酒精性脂肪性肝病诊断与治疗共识所推荐的美国国立卫生研究院NASH临床研究网络病理委员会2005年所定指南[17], 根据其制定的NAFLD活动度积分(a NAFLD activity score, NAS)进行评估. NAS组织学评分系统观察了14项病理改变. 3项指标进行了半定量评估计分: 肝脂肪变(发生脂肪变性实质细胞<5%, 5%-33%, 33%-66%, >66%分别计0-3分)、小叶内炎症[无病灶、<2(每×200视野)、2-4(×200视野)、>4(×200视野)分别计0-3分]、肝细胞气球样变(无、少量气球样细胞、较多/显著气球样变分别计0-2分), NAS≥5者可明确NASH的诊断, NAS<3可排除NASH, 两者之间者为NASH可能. 其余观察指标包括小泡性脂肪变性、大脂质肉芽肿、嗜酸小体、门脉炎症、色素沉着巨噬细胞等以"有或无(1/0)"表示. HE切片使用Olympus摄像系统进行观察和摄片. Masson染色切片使用Leica DM5000B摄像系统进行观察和摄片.
统计学处理 计数资料用mean±SD表示, 两组之间的比较用独立t检验, 统计学显著性用双侧检验P<0.05. 使用SPSS11.5软件包进行统计学分析.
各组大鼠均无死亡, 习性、毛发、活动均无异常. 在开始的2 wk内, 各组大鼠的进食量无明显差异, 从11.8到15.6 g/d, 以后进食量逐渐增加, 恒定至约22.4至25.3 g/d, 对照组大鼠进食量稍多, 但是与模型组相比无明显差异(P>0.05). 处死时, 模型组大鼠的体质量低于对照组 (3 wk, P = 0.089; 8 wk, P = 0.07); 模型组大鼠的体质量增加低于对照组, 但是无显著差异(3 wk, P = 0.66, 8 wk, P = 0.073). 3 wk处死的1, 3组大鼠的肝指数有显著性差异(P<0.01); 8 wk处死的2, 4组大鼠的肝指数亦有显著性差异(P<0.01)(表1).
| 分组 | ||||
| 对照组(n = 5) | 模型组(n = 8) | |||
| 组1 | 组2 | 组3 | 组4 | |
| 开始时体质量(g) | 131.4±9.1 | 129.6±7.4 | 127.5±9.7 | 127.4±7.6 |
| 处死时体质量(g) | 224.0±13.2 | 456.8±18.4 | 208.9±14.8 | 440.2±11.6 |
| 体质量增加量(g) | 92.6±11.0 | 327.2±14.9 | 88.2±19.4 | 312.8±11.3 |
| 肝指数(%) | 3.2±0.2b | 3.2±0.2d | 7.5±0.5 | 5.6±0.8 |
| TG(mmol/L) | 1.5±0.7b | 1.2±0.2d | 0.6±0.1 | 0.5±0.1 |
| ALT(U/L) | 76.2±17.9b | 57.6±13.4d | 162.6±27.8 | 93.1±18.6 |
| AST(U/L) | 135.6±15.9b | 105.6±19.5d | 466.8±133.4 | 206.8±54.2 |
| 肝脏TG量(mg/g) | 15.4±6.5b | 16.1±4.2d | 114.8±15.7 | 121.0±14.0 |
与1, 2组相比, 3, 4组大鼠的血清ALT, AST均有显著升高(P<0.05). 3, 4组血清TG显著低于1, 2组(P<0.05). 3, 4组肝脏TG含量显著高于1, 2组(P<0.01), 3, 4组之间无差异(P>0.05)(表1).
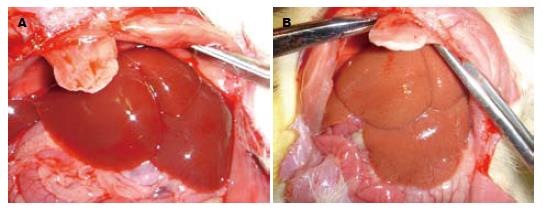
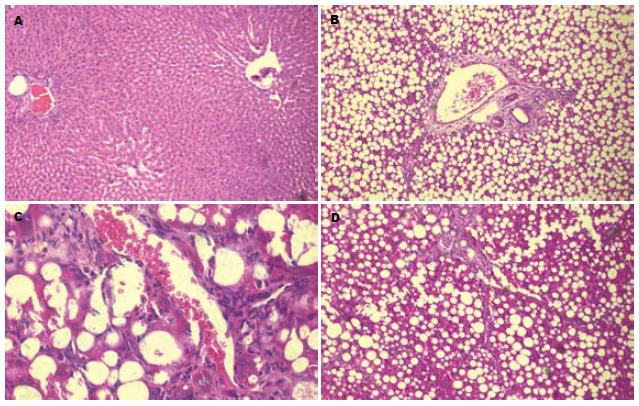
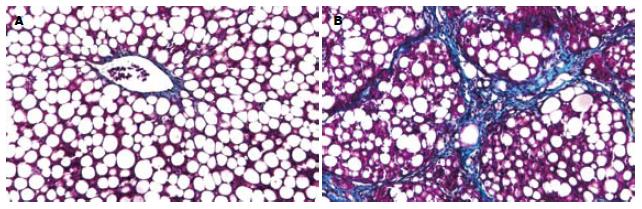
3 wk时, 正常对照组大鼠处死后, 其肝脏外观表现为无肿胀增大, 色泽深红色, 有光泽, 质软, 边缘锐利, 密度正常(图1A), HE切片可见肝细胞大小正常, 未见脂肪浸润, 无小叶和汇管区炎症(图2A), Masson染色无纤维组织形成. 模型组大鼠肝脏外观表现为肿胀增大, 色泽土黄, 边缘钝, 标本漂浮于中性甲醛液面上(密度降低)(图1B). 切片表现为脂滴弥漫浸润入肝细胞中, 肝小叶内含脂滴细胞数/总细胞数大于2/3, 脂变肝细胞极度肿胀呈圆形, 体积较正常明显增加, 胞质内充满大量脂肪空泡. 汇管区和小叶内可见少量炎性细胞浸润, 炎症细胞以单核细胞、淋巴细胞为主(图2B-C). Masson染色未见明显纤维形成(图3A). 8 wk时, 对照2组大鼠肝脏外观及病理与1组相似. 模型4组大鼠肝脏外观表现为肝脏肿大, 色泽暗黄, 密度较前增加, 肝脏表面颗粒样感觉, 质韧. 切片HE染色可见小叶内含脂滴细胞数/总细胞数大于2/3, Masson染色可见纤维组织增多, 部分有假小叶形成(图2D, 3B). 两种饮食特点比较见表2.
| 标准MCD | 改良MCD | |
| 成分 | 复杂, 难以自行配制 | 相似, 改良后配制方便 |
| 能量蛋白质 | 满足生长所需要 | 满足生长所需要 |
| 来源 | 多购买自MP medicals等公司 | 自行配制 |
| 价格 | 昂贵 | 价廉 约为国外同类产品的1/20 |
| 造模时间 | 3 wk左右可见明显的脂肪性肝炎病变, 10 wk可见明显的肝纤维化 | 2-3 wk可见明显脂肪浸润及炎症, 3-6 wk可见明显脂肪性肝炎, 8 wk可见纤维化 |
| 体质量 | 较CS饮食组有显著下降 | 较CS饮食组有临界性下降 |
| 血清ALT、AST | 较CS饮食组显著升高 | 显著升高 |
| 血清TG | 较CS饮食组降低 | 降低 |
| 肝脏脂肪浸润 | 2 wk可见 | 相似 |
| 肝脏炎症 | 显著 | 相似 |
国内进行脂肪性肝病研究时, 多采用高脂或高糖等高能量饮食建立动物模型. 高能量饲料喂养大鼠建立单纯性脂肪变性肝病模型一般需要6-8 wk, 如果要发展为脂肪性肝炎, 还需要延长时间, 而且脂肪性肝炎的发生率低. 我们用改良MCD饮食喂养的大鼠, 与正常添加胆碱(CS)饮食喂养的大鼠相比, 3 wk肝脏可见明显的脂肪浸润, 密度下降, 并可见炎性细胞浸润, 脂肪变性评分与CS饮食喂养的大鼠脂肪变性评分有着显著差异, 且NAS≥5; 同时血清中ALT, AST显著升高, TG显著降低, 肝脏中TG含量增加, 均与文献记载的相同[16]. 随着造模时间的延长, 可以见到肝脏炎症进一步发展, 肝脏内纤维组织逐渐增加, 密度也逐渐增加. 而随着纤维组织的增加, ALT和AST有逐渐下降的趋势, 但较对照组仍然显著升高, 符合MCD模型的特点, 表明使用改良MCD饮食制造NASH模型成功. 但国外MCD饮食喂养大鼠体质量较对照组显著下降[14-15], 而我们使用改良MCD饮食喂养后, 模型组大鼠体质量也较对照组下降, 但仅有临界性差异. 我们认为可能与饮食改良有关, 同时可能样本量较小也有一定关系.
使用MCD饮食制造NASH模型是国外进行脂肪性肝炎研究常用模型之一, 国外都是购买成品, 但是因为价格昂贵, 国内很少应用. 我们通过改良后成本只有外国的1/20, 同样可以获得满意的NASH模型效果. 此种饮食提供的能量和蛋白质均能充分满足生长需要. 酒精萃取的花生粉, 主要是来源于花生压榨后, 他缺乏赖氨酸, 大约含有45%的蛋白质, 但是因为无法获得, 我们用增加大豆分离蛋白来替代. 大豆分离蛋白含有丰富的蛋白质(约90%), 这种蛋白质是经过精心挑选的, 含有充足的蛋白质只有极少量的蛋氨酸(0.2%). 由于大鼠体内可以充分有效地通过蛋氨酸合成胆碱, 因此, 从这个角度来讲, 该胆碱缺乏饮食也是蛋氨酸胆碱缺乏饮食(MCD)[16].
蛋氨酸是一种必需氨基酸, 在体内提供甲基合成胆碱. 当蛋氨酸缺乏时, 胆碱合成障碍[18]. 胆碱又称为VitB4, 是卵磷脂、乙酰胆碱等物质的组成成分. 当缺少胆碱时, 肝脏合成磷脂减少, 不能有效地合成脂蛋白, 特别是极低密度脂蛋白(VLDL); 而VLDL是运输内源性甘油三酯出肝的主要形式, 从而使甘油三酯在肝脏内积聚, 迅速沉积, 形成脂肪肝. 积累在肝的甘油三酯代谢生成甘油二酯, 胆碱与甘油二酯生成卵磷脂减少会导致甘油二酯积累, 结果细胞膜中的卵磷脂会被代谢以提供胆碱, 引起肝细胞膜损伤.
胆碱和蛋氨酸缺乏, 导致活性甲基缺乏, 使肝脏内严重缺乏抗氧化物, 因此MCD饮食使抗氧化屏障机制受损并增加氧应激[19]. 氧应激可以导致细胞多种功能和结构损伤, 还可以诱导TNFα和其他促炎症细胞因子活化[20]. MCD饮食喂养的大鼠, 2 d后就可以发现肝脏TNFα水平升高[21]. 肥胖的NASH患者也存在着TNFα表达增加的情况, 而同样肥胖但是无NASH者则没有TNFα表达增加[22]. 氧应激和TNFα还可以激活IKKβ途径, IKKβ激活核因子κB(NF-κB), 而NF-κB是一个可以诱导TNFα合成的转录因子. 因此, 一旦激活, IKKβ-TNFα循环就可以不断的自我增强, 导致胰岛素抵抗和慢性炎症状态持续存在, 肝脏炎症细胞浸润和肝脏纤维化很快就会出现.
MCD饮食引起的NASH模型还存在CYP2E1[14]上调, CYP2E1是引起氧应激的主要因素, 可以导致羟自由基、超氧阴离子等的产生. 自由基的大量形成可造成肝细胞膜等多部位和成分的广泛损伤和肝纤维化. CYP2E1和其异构体表达增加在人和动物NASH模型中均可以见到[23]. 最近Schattenberg et al[24]报道了CYP2E1的过度表达可以使肝脏胰岛素信号通路受损, 导致肝脏胰岛素抵抗. 且MCD饮食大鼠血浆内β羟丁酸浓度不升高[14], 提示MCD饮食喂养大鼠的肝脏线粒体β氧化受损. 因此MCD饮食引起的NASH模型, 除了在组织学上引起的脂肪性肝炎病变与人类NASH类似之外, 也同样可以产生氧应激、TNFα升高、脂质过氧化等人类NASH中常见的危险因素.
MCD饮食模型有着严重的脂肪浸润、氧应激及TNFα升高, 有着严重的炎症, 并可能存在着胰岛素抵抗. 但是Rinella1 et al[25]使用MCD饮食喂养FVB/NJ小鼠后, 糖耐量试验、胰岛素耐量试验和定量胰岛素敏感测定表明, MCD饮食引起的NASH模型中不存在胰岛素抵抗, 相反还有胰岛素敏感性增高现象. 而Tahan et al[26]却发现, 短期或长期MCD饮食喂养的Wistar大鼠, 均表现出糖耐量受损和胰岛素耐量下降, 而没有出现胰岛素敏感性增加的现象. 他认为这可能与大鼠的种属差异性有关. 结合以上谈到的氧应激、TNFα和CYP2E1的作用, 我们认为MCD饮食模型是否存在全身性胰岛素抵抗尚有争议, 但肝脏的局部胰岛素抵抗是存在的. 我们应该注意到, 虽然大部分NASH患者均存在中心性肥胖和胰岛素抵抗, 但是仍有约10%-20%的NASH患者是瘦的, 并无胰岛素抵抗[27], 而这部分人有可能就存在着局部的胰岛素抵抗.
MCD饮食模型在发病过程中与人类非肥胖患者的NASH发病过程很相似, 因为此模型强调在肝脏脂肪变性和脂肪性肝炎的发病机制中, 氧应激独立于肥胖之外的对于NASH发病的重要性, 而且存在着肝脏局部的胰岛素抵抗. 近来发现, 抑癌基因p53, PTEN(phosphotase and tensin homology deleted on chromosome ten)等在脂肪性肝炎的发展中起重要作用, 而氧应激可以诱导这些基因的表达[28], 对于进一步探讨p53, PTEN在NASH中的机制是有重要意义的.
总之, 我们通过改良MCD饮食建立了NASH模型, 本模型是研究NASH的发病机制及筛选防治方案的良好实验材料.
NAFLD是发达国家最为常见的引起肝功能异常的原因, 也是隐源性肝硬化的常见原因. NAFLD包括肝脏单纯脂肪变性、NASH、肝纤维化和肝硬化等一系列的病理变化, 单纯脂肪变性是相对静止性疾病, 而NASH则是进展性疾病, 可以发展为肝硬化、肝功能衰竭和肝癌, 与全球的肥胖化趋势同步, NAFLD和NASH的发病率逐渐升 高, 对于NASH机制和防治的研究成为近年来的热点.
对NASH的研究需要有合适的动物模型. 国内外的NASH动物模型有十余种, 近年来仍有不断有新的基因敲除模型和 饮食模型报道, 但尚没有一种能完全和人类的机制吻合.
基因敲除产生的 ob/ob小鼠、具有脂质萎缩特点的SREBP-1小鼠和通过MCD饮食建立的动物模型是国外研究最多和最具有代表性的NASH模型, 但是由于价格原因, 国内均很少, 本文通过改良MC D饮食配方成功建立起与国外相似的MC D动物模型, 有利于国内对NASH机制进一步研究.
本文的改良MCD 饮食只有国外同类产品价格的1/2 0, 但同样可以获得满意的效果, 对以后国内NASH的研究提供了很好的模型, 填补了国内空白.
1 NAFLD: 非酒精性脂肪性肝病是一种病变主体在肝小叶, 以肝细胞脂肪变性和脂肪贮积为病理特征但无过量饮 酒史的临床综合征, 包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝硬化三种主要类型. 2 NASH: 为NAF-LD的一种病理类型. 指血清ALT水平高于正常值上限的2倍, 持续时间大于4 wk, 影像学表现符合脂肪肝诊断标准或肝脏组织学表现符合脂肪性肝炎诊断标准.3 MCD饮食: 蛋氨酸胆碱缺乏饮食, 导致VLD L合成障碍, 使内源性甘油三脂出肝受阻, 从而使甘油三酯在肝脏内积聚, 迅速沉积, 形成脂肪肝.
本文研究内容较新颖, 行文流畅, 方法使用较恰当, 结果结论较可信, 为试验研究提供了一良好的动物模型, 有一定的参考价值.
编辑: 何燕 电编:马文华
| 1. | Clark JM, Brancati FL, Diehl AM. The prevalence and etiology of elevated aminotransferase levels in the United States. Am J Gastroenterol. 2003;98:960-967. [PubMed] |
| 2. | Farrell GC. Non-alcoholic steatohepatitis: what is it, and why is it important in the Asia-Pacific region? J Gastroenterol Hepatol. 2003;18:124-138. [PubMed] |
| 3. | Ruhl CE, Everhart JE. Relation of elevated serum alanine aminotransferase activity with iron and antioxidant levels in the United States. Gastroenterology. 2003;124:1821-1829. [PubMed] |
| 4. | Chen CH, Huang MH, Yang JC, Nien CK, Yang CC, Yeh YH, Yueh SK. Prevalence and etiology of elevated serum alanine aminotransferase level in an adult population in Taiwan. J Gastroenterol Hepatol. 2007;22:1482-1489. [PubMed] |
| 5. | Malik A, Cheah PL, Hilmi IN, Chan SP, Goh KL. Non-alcoholic fatty liver disease in Malaysia: a demographic, anthropometric, metabolic and histological study. J Dig Dis. 2007;8:58-64. [PubMed] |
| 6. | Caldwell SH, Oelsner DH, Iezzoni JC, Hespenheide EE, Battle EH, Driscoll CJ. Cryptogenic cirrhosis: clinical characterization and risk factors for underlying disease. Hepatology. 1999;29:664-669. [PubMed] |
| 7. | Maheshwari A, Thuluvath PJ. Cryptogenic cirrhosis and NAFLD: are they related? Am J Gastroenterol. 2006;101:664-668. [PubMed] |
| 8. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] |
| 9. | Mulhall BP, Ong JP, Younossi ZM. Non-alcoholic fatty liver disease: an overview. J Gastroenterol Hepatol. 2002;17:1136-1143. [PubMed] |
| 10. | Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nona-lcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980;55:434-438. [PubMed] |
| 11. | Matteoni CA, Younossi ZM, Gramlich T, Boparai N, Liu YC, McCullough AJ. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology. 1999;116:1413-1419. [PubMed] |
| 12. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] |
| 13. | McCullough AJ. Update on nonalcoholic fatty liver disease. J Clin Gastroenterol. 2002;34:255-262. [PubMed] |
| 14. | Leclercq IA, Farrell GC, Field J, Bell DR, Gonzalez FJ, Robertson GR. CYP2E1 and CYP4A as microsomal catalysts of lipid peroxides in murine nonalcoholic steatohepatitis. J Clin Invest. 2000;105:1067-1075. [PubMed] |
| 15. | Weltman MD, Farrell GC, Liddle C. Increased hepatocyte CYP2E1 expression in a rat nutritional model of hepatic steatosis with inflammation. Gastroenterology. 1996;111:1645-1653. [PubMed] |
| 16. | Shinozuka H, Lombardi B, Sell S, Iammarino RM. Early histological and functional alterations of ethionine liver carcinogenesis in rats fed a choline-deficient diet. Cancer Res. 1978;38:1092-1098. [PubMed] |
| 17. | Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41:1313-1321. [PubMed] |
| 18. | Ghoshal AK, Ahluwalia M, Farber E. The rapid induction of liver cell death in rats fed a choline-deficient methionine-low diet. Am J Pathol. 1983;113:309-314. [PubMed] |
| 19. | Hensley K, Kotake Y, Sang H, Pye QN, Wallis GL, Kolker LM, Tabatabaie T, Stewart CA, Konishi Y, Nakae D. Dietary choline restriction causes complex I dysfunction and increased H(2)O(2) generation in liver mitochondria. Carcinogenesis. 2000;21:983-989. [PubMed] |
| 20. | Diehl AM. Cytokine regulation of liver injury and repair. Immunol Rev. 2000;174:160-171. [PubMed] |
| 21. | Diehl AM, Goodman Z, Ishak KG. Alcohollike liver disease in nonalcoholics. A clinical and histologic comparison with alcohol-induced liver injury. Gastroenterology. 1988;95:1056-1062. [PubMed] |
| 22. | Crespo J, Cayon A, Fernandez-Gil P, Hernandez-Guerra M, Mayorga M, Dominguez-Diez A, Fernandez-Escalante JC, Pons-Romero F. Gene expression of tumor necrosis factor alpha and TNF-receptors, p55 and p75, in nonalcoholic steatohepatitis patients. Hepatology. 2001;34:1158-1163. [PubMed] |
| 23. | Sanyal AJ, Campbell-Sargent C, Mirshahi F, Rizzo WB, Contos MJ, Sterling RK, Luketic VA, Shiffman ML, Clore JN. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001;120:1183-1192. [PubMed] |
| 24. | Schattenberg JM, Wang Y, Singh R, Rigoli RM, Czaja MJ. Hepatocyte CYP2E1 overexpression and steatohepatitis lead to impaired hepatic insulin signaling. J Biol Chem. 2005;280:9887-9894. [PubMed] |
| 25. | Rinella ME, Green RM. The methionine-choline deficient dietary model of steatohepatitis does not exhibit insulin resistance. J Hepatol. 2004;40:47-51. [PubMed] |
| 26. | Tahan V, Yavuz D, Imeryuz N, Avsar E, Tozun N. Oral glucose tolerance deteriorates in rats fed with methionine choline deficient diet. J Hepatol. 2004;41:352; author reply 353. [PubMed] |
| 27. | Pagano C, Soardo G, Esposito W, Fallo F, Basan L, Donnini D, Federspil G, Sechi LA, Vettor R. Plasma adiponectin is decreased in nonalcoholic fatty liver disease. Eur J Endocrinol. 2005;152:113-118. [PubMed] |
| 28. | Yahagi N, Shimano H, Matsuzaka T, Sekiya M, Najima Y, Okazaki S, Okazaki H, Tamura Y, Iizuka Y, Inoue N. p53 involvement in the pathogenesis of fatty liver disease. J Biol Chem. 2004;279:20571-20575. [PubMed] |