修回日期: 2007-09-19
接受日期: 2007-09-28
在线出版日期: 2007-10-08
目的: 研究维生素E、硒对非酒精性脂肪肝大鼠肝细胞色素P4501A1及脂质过氧化的干预作用.
方法: ♂SD大鼠, 随机均分为5组: 对照组(普通饲料)、模型组(高脂饲料)、VE干预组、Se干预组、VE+Se干预组, 建模5 wk处死全部大鼠. 生化方法检测血清及肝组织超氧化物歧化酶(SOD)和丙二醛(MDA)含量的变化, 逆转录聚合酶链反应(RT-PCR)测定肝细胞色素P4501A1 mRNA表达的变化, 免疫组化方法测定肝组织中肿瘤坏死因子-α(TNF-α)、核因子-κB(NF-κB)表达的变化.
结果: 与对照组比较, 模型组血清及肝组织中SOD显著降低(312.72±49.51 kU/L vs 583.23±63.37 kU/L; 8.13±0.63 U/mgprot. vs 13.99±2.33 U/mgprot., P<0.01), MDA增高(13.40±4.24 mmol/L vs 6.43±1.76 mmol/L; 9.79±0.94 nmol/mgprot. vs 6.80±0.97 nmol/mgprot. P<0.01), 细胞色素P4501A1 mRNA表达水平, 肝组织TNF-α、NF-κB蛋白表达明显增强(0.628±0.116 vs 0, 0.230±0.013 vs 0.03±0.006, 0.069±0.01 vs 0.003±0.001; P<0.05). 与模型组比较VE组、Se组的血清及肝组织中SOD增高, MDA降低, 细胞色素P4501A1 mRNA表达水平略下降; 肝组织TNF-α、NF-κB蛋白表达下降(P<0.05). VE+Se组与模型组比较, 血清SOD明显增高, 其值接近对照组水平; 细胞色素P4501A1 mRNA表达水平显著下降(0.324±0.070 vs 0.628±0.116, P<0.05).
结论: 非酒精性脂肪肝的脂质过氧化损伤及相关因子的表达可能与肝细胞色素P4501A1表达上调有关. VitE和硒能提高机体的抗氧化能力, 对非酒精性脂肪肝有保护作用, 二者联合作用更明显.
引文著录: 谭丽, 管小琴. 维生素E、硒对非酒精性脂肪肝大鼠肝细胞色素P4501A1及脂质过氧化的干预作用. 世界华人消化杂志 2007; 15(28): 2977-2982
Revised: September 19, 2007
Accepted: September 28, 2007
Published online: October 8, 2007
AIM: To study the effects of vitamin E and Se on cytochrome P4501A1 and lipid peroxidation in nonalcoholic fatty liver diseases in rats.
METHODS: Forty male SD rats were randomly divided into 5 groups: normal control group, model group, VE group, Se group and VE + Se group. Each subgroup comprised 8 rats, which were respectively fed with normal diets, fat-rich diets and interfering diets (VE, Se, VE + Se). All animals were sacrificed at the end of the 5th week. Superoxide dismutase (SOD) and malondialdehyde (MDA) levels in the serum and liver were detected by biochemical analysis. The expression levels of cytochrome P4501A1 mRNA in liver tissue were measured by reverse transcription polymerase chain reaction (RT-PCR). The levels of tumor necrosis factor alpha (TNF-α) and nuclear factor kappa B (NF-κB) proteins in hepatic tissue were examined by immunohistochemistry.
RESULTS: Compared with the control group, MDA levels in the serum and livers of model group animals were elevated (serum, 13.40 ± 4.24 mmol/L vs 6.43 ± 1.76 mmol/L; liver, 9.79 ± 0.94 nmol/mgprot. vs 6.80 ± 0.97 nmol/mgprot., P < 0.01), while SOD levels were decreased (serum, 312.72 ± 49.51 kU/L vs 583.23 ± 63.37 kU/L; liver, 8.13 ± 0.63 U/mgprot. vs 13.99 ± 2.33 U/mgprot.; P < 0.01). The levels of NF-κB and TNF-α proteins and cytochrome P4501A1 mRNA in liver tissue were significantly increased in model group animals (0.069 ± 0.01, 0.230 ± 0.013 and 0.628 ± 0.116, respectively) compared with control animals (0.003 ± 0.001, 0.03 ± 0.006, and 0, respectively; P < 0.05). Compared with the model group, in the VE group and Se group, MDA decreased in serum and liver while SOD heightened, levels of cytochrome P4501A1 mRNA in liver tissue also decreased. Expression of NF-κB and TNF-α proteins also decreased (P < 0.05). The SOD levels in the serum of VE + Se group animals clearly increased, and approached the levels of the control group, compared with those in model group animals, whereas the levels of cytochrome P4501A1 mRNA in liver tissue significantly decreased (0.324 ± 0.070 vs 0.628 ± 0.116; P < 0.05).
CONCLUSION: Lipid peroxidation and the expression of some correlation factors in nonalcoholic fatty liver diseases is probably relevant to the up-regulation of cytochrome P4501A1 mRNA in liver tissue. Vitamin E and Se can protect against nonalcoholic fatty liver diseases owing to their antioxidant capabilities. The function of the administration of both Vitamin E and Se combined was significantly larger than those of vitamin E and sodium selenite alone.
- Citation: Tan L, Guan XQ. Vitamin E and Se interfere in cytochrome P4501A1 and lipid peroxidation in nonalcoholic fatty liver diseases in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(28): 2977-2982
- URL: https://www.wjgnet.com/1009-3079/full/v15/i28/2977.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i28.2977
非酒精性肝病(nonalcoholic fatty liver disease, NAFLD)发病率逐年提高, 然而其发病机制至今尚未完全阐明, 目前在临床上亦缺乏十分有效的防治手段. Day et al提出的"二次打击学说"认为氧应激及脂质过氧化在脂肪肝发生发展过程中处于主导地位, 许多发病因素通过增加氧化活性和脂质过氧化作为共同致病途径对肝脏实施二次打击, 导致脂肪肝发生及其后病变进展[1-3]. 本实验采用高脂饮食动物模型, 通过检测脂质过氧化与抗氧化的标志物超氧化物歧化酶(SOD)和丙二醛(MDA)及肝细胞色素P4501A1(cytochrome P4501A1, CYP1A1)和相关细胞因子TNF-α、NF-κB, 探讨脂肪肝的脂质过氧化及与CYP1A1、TNF-α、NF-κB的相关性, 进而观察维生素E(VE)和亚硒酸钠(Se)对脂肪肝损伤程度及上述各项指标的干预作用, 以期为脂肪肝的发生和治疗提供理论基础.
♂SD大鼠40只, 质量200 g左右, 购自重庆医科大学实验动物中心. Vit E为厦门鱼肝油厂产品, 亚硒酸钠为北京市朝阳区中联化工试剂公司产品(分析纯), 超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所, 兔抗大鼠TNF-α、NF-κB p65多克隆抗体、SABC免疫组化试剂盒、DAB显色试剂盒购自武汉博士德生物工程公司, TRIzol试剂购自美国Promega公司, 总RNA抽提试剂盒购自大连宝生物公司, RT-PCR试剂盒购自日本TaKaRa试剂公司, DNAmarker及PCR引物由成都天泰生物工程公司生产合成.
大鼠正常喂养1 wk后随机分成对照组、模型组、VE干预组、Se干预组、VE+Se干预组, 每组8只, 分笼饲养. 对照组以普通饲料喂养, 模型组以高脂饲料喂养(2%胆固醇+0.5%胆酸钠+0.2%丙硫氧嘧啶+5%蔗糖+10%猪油+82.3%普通饲料), VE干预组在高脂饲料中添加VitE(250 mg/kg饲料)喂养, Se干预组在高脂饲料中添加亚硒酸钠(0.5 mg/kg饲料)喂养, VE+Se干预组在高脂饲料中同时添加上述同等剂量的VitE和亚硒酸钠喂养. 建模5 wk后处死, 处死前禁食12 h, 以10 g/L的戊巴比妥钠溶液3.0 mL/kg BW ip麻醉, 眶静脉采血, 置37℃恒温水浴20 min, 红细胞沉降后, 取血清-20℃保存待检. 打开腹腔, 取出肝脏, 观察组织大体形态、颜色及质地. 取部分肝组织按常规制备石蜡切片, 根据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组"非酒精性脂肪肝诊断标准"[4], 对各组大鼠肝脂变程度进行分级; 剩余组织置液氮中保存备用.
1.2.1 血清及肝组织SOD、MDA含量的检测: 血清SOD、MDA检测方法按试剂盒说明书进行, 采用752分光光度计比色, 波长分别为550 nm、532 nm; 肝组织SOD、MDA测定: 取肝组织1 g剪碎, 加冰生理盐水至总体积为10 mL, 制备10%肝匀浆; 4000 r/min、4℃离心10 min, 取上清液; 比色方法与血清相同.
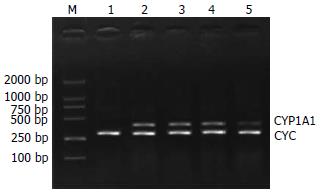
1.2.2 RT-PCR检测CYP1A1 mRNA的表达: (1)根据genbank中查阅的mRNA全长序列, 用Primer3引物设计软件设计CYP1A1和内对照亲环素CYC的引物; CYP1A1上游序列: 5'-CTGGTTCTGGATACCCAGCTG-3', 下游序列: 5'-CCTAGGGTTGGTTACCAGG-3', 其产物长度为332 bp; 内对照亲环素CYC上游序列: 5'-CTTCGACATCACGGCTGATG-3', 下游序列5'-CAGGACCTGATGCTTCAGG-3', 其产物长度为266 bp; (2)肝脏总RNA提取和cDNA合成按试剂盒标准步骤操作; PCR反应体系: cDNA 3 μL, 10 mmol/L dNTP 2.5 μL, 25 mmol/L Mg2+ 5 μL, 10×PCR缓冲液5 μL, DEPC水3 μL, Taq酶0.5 μL, CYPlA1、CYC引物各1.5 μL. CYP1A1 PCR循环为95℃变性2 min, 58℃退火l min, 72℃延伸1.5 min, 循环35次. CYC PCR循环为95℃变性l min, 58℃退火50 s, 72℃延伸l min, 循环35次; (3)10 g/L琼脂糖凝胶电泳检测PCR扩增产物, EB染色; 采用Quantity One凝胶图像分析系统对RT-PCR产物电泳条带进行密度分析, 测定目的带及CYC条带的V值(Volume = 平均吸光密度值×条带面积), 目的带表达强度RV = V目的带/CYC.
1.2.3 免疫组化TNF-α、NF-κB p65蛋白的表达: 一抗稀释浓度分别为1:300, 1:200, 肝组织切片经常规脱蜡至水, 30 mL/L过氧化氢孵育消除内源性过氧化物酶活性; 微波修复, 冷却后PBS洗涤1-2次; 50 mL/L正常山羊血清封闭20 min; 滴加一抗, 阴性对照以PBS代替, 4℃过夜; 加入生物素化二抗, 室温孵育20 min; 滴加SABC 20 min, DAB显色, 苏木素复染, 中性树胶封片. 400倍光镜下观察, 每张切片摄取3个高倍(×400)视野, 输入计算机, 应用金盘图像处理系统自动分析得出平均光密度(AIOD)值.
统计学处理 应用统计学分析软件包SPSS11.0进行统计学分析, 检验水准a = 0.05.
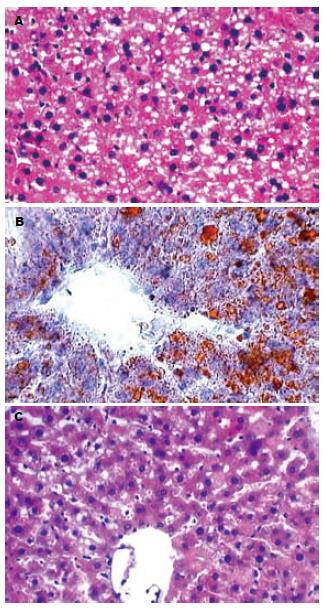
至造模结束, 各组大鼠均无死亡. 模型组大鼠肝脏体积较对照组增大, 颜色变黄, 包膜紧张, 切面触之有油腻感. HE染色光镜下观察, 与对照组比较, 模型组肝细胞体积增大, 排列紊乱, 细胞内充满大小不等的空泡(经苏丹Ⅳ特殊染色显示为橘红色, 证实为脂滴), 部分区域伴炎症细胞浸润及灶性坏死; 与模型组比较, 各干预组肝脂肪变程度有所减轻, 尤以VE+Se组最为显著, 炎症及坏死不明显(图1). 脂变程度分级见表1.
模型组血清及肝组织中SOD较对照组明显降低, 各干预组较模型组有不同程度的增高, 尤以VE+Se组增高最为显著, 其值接近对照组水平. 相反, 模型组血清及肝组织中MDA较对照组明显增高, 各干预组较模型组不同程度降低, 以VE+Se组降低最为显著(表2).
| SOD | MDA | |||
| 血清(U/L) | 肝组织(U/mgprot.) | 血清(mmol/L) | 肝组织(nmol/mgprot.) | |
| N组 | 583.23±63.37 | 13.99±2.33 | 6.43±1.76 | 6.80±0.97 |
| M组 | 312.72±49.51d | 8.13±0.63d | 13.40±4.24d | 9.79±0.94d |
| VE组 | 356.03±69.05a | 9.87±0.05a | 12.83±2.45a | 9.13±0.06a |
| Se组 | 393.79±42.95a | 10.01±0.05a | 12.46±0.65a | 8.87±0.08a |
| VE+Se组 | 528.23±53.72b | 12.79±1.15b | 8.51±1.33b | 7.53±0.40b |
| F | 33.63 | 31.72 | 25.33 | 29.98 |
| P | <0.0001 | <0.0001 | <0.0001 | <0.0001 |
RT-PCR检测显示, 对照组CYP1A1 mRNA无表达, 与对照组相比模型组CYP1A1 mRNA表达显著增加; 各干预组中VE、Se单独使用时CYP1A1 mRNA表达水平略下降, 无统计学意义; VE+Se组CYP1A1 mRNA表达水平较模型组明显降低(P<0.05)(图2, 表3).
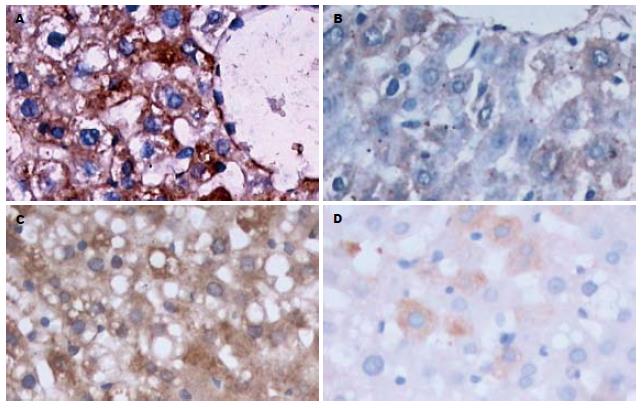
对照组肝细胞内TNF-α几乎不表达, Kupffer细胞见少量表达; 模型组肝细胞内TNF-α阳性表达明显增强, 其阳性程度与脂变程度一致; 各干预组TNF-α阳性表达较模型组有不同程度的减弱, 以VE+Se组最为显著(表3, 图3A-B). 对照组肝细胞内NF-κB p65有少量表达, 主要位于肝细胞胞质; 模型组肝细胞NF-κB p65表达较对照组明显增强, 胞质及胞核均有表达, 其阳性程度与脂变程度一致; 各干预组NF-κB p65阳性表达较模型组有减弱, 其中VE+Se组仅个别肝细胞见阳性表达, 大部分肝细胞不表达(表3, 图3C-D).
脂质过氧化在脂肪肝发生发展过程中处于主导地位, 肝细胞脂肪变性及其伴存或继发的胰岛素抵抗(IR)、游离脂肪酸(FFA)增多、肝细胞内甘油三脂(TG)氧化增多、肝细胞色素P450酶系表达增强、肝细胞能量贮备不足等均可通过诱发氧应激导致脂质过氧化损伤[5]. 本文通过测定脂质过氧化与抗氧化的标志物MDA和SOD及CYP1A1、TNF-α、NF-κB等相关因子, 结合组织病理学的变化, 对非酒精性脂肪肝发病及其演变过程中, 氧应激脂质过氧化损伤及细胞防御机制改变之间作用及其相互关系进行探讨, 进而观察Vit E和亚硒酸钠两种抗氧化剂对高脂饮食大鼠脂肪肝损伤程度及上述指标的干预作用.
肝细胞色素P450系统是一组广泛存在于机体内, 但主要存在于肝细胞内质网上的混合功能氧化酶系, 该酶系主要包括有CYP1A、2E、3A, 其中CYP1A1不仅参与药物的代谢, 而且还能催化许多前致癌物和前毒物的活化过程[6]. Shertzer et al[7]提出, CYP1A1参与脂肪肝发病中的脂质过氧化反应, 且与羟自由基的生成增多有关. 羟自由基是脂质过氧化反应的启动剂, 高脂饮食可增加线粒体或微粒体对脂肪酸的氧化而导致氧应激, 故脂肪酸可诱导细胞色素P450酶系的产生. 本研究结果显示, 高脂饮食诱导的NAFLD大鼠肝细胞微粒体CYP1A1 mRNA表达上调, 肝脏及血清中脂质过氧化物终产物MDA含量显著增高, 抗氧化及清除自由基的SOD含量明显降低; 提示高脂饮食模型组大鼠体内脂质过氧化反应增强, 其机制一方面可能由于CYP1A1表达增加, 使微粒体还原型辅酶Ⅱ(NADPH)依赖的脂质过氧化反应增强, 另一方面可能是由于增多的FFA为氧应激脂质过氧化提供足够的反应基质.
本研究中所有NAFLD模型组大鼠均处于早期及单纯性脂肪肝向脂肪性肝炎过渡阶段, 免疫组化结果显示大鼠肝细胞TNF-α、NF-κB蛋白阳性表达较正常对照组显著增强; 提示TNF-α、NF-κB因子的表达参与NAFLD的发生与进展. NAFLD形成时, 氧应激、FFA增多、CYP1A1、CYP2EI表达增加及IR等因素可促使大量的活性氧(ROS)生成, 通过促使NF-κB活化和结合蛋白-1(AP-1)在核内移位, 进而刺激枯否氏细胞生成TNF-α增加, 增多的TNF-α又使ROS生成增多; 另一方面还通过激活IKKβ使KB抑制蛋白(Iκβ)降解, 从而活化NF-κB, ROS-NF-κB-TNF-α三者之间形成恶性循环, 进一步促使脂质过氧化反应加剧[8]. 国内外较多研究均提出, 脂质过氧化反应可能是单纯性脂肪肝诱导脂肪性肝炎和肝纤维化的重要机制, 除非及时阻止炎症-坏死循环, 否则将难避免脂肪性肝炎和肝纤维化的发生[9-10].
VitE和硒是两种重要的抗氧化剂, 前者的抗氧化功能依赖其自身结构, 他可以插入到细胞膜的脂质双分子层之间, 与多价不饱和脂肪酸形成膜结构的一部分, 并与结合在膜上的能产生氧自由基的酶(如混合功能氧化酶)紧密相邻, 在氧自由基攻击多不饱合脂肪酸前将其捕获和清除, 阻断其氧化过程, 防止和抑制了膜上磷脂形成脂质过氧化; 硒是机体必须的微量元素之一, 为谷胱甘肽过氧化物酶(GSH-Px)活性中心的必须组成成分. 体内SOD、GSH-Px可直接拮抗自由基的毒性作用, 清除脂质过氧自由基和羟自由基, 羟自由基是脂质过氧化的启动剂. 故VitE是防止脂质过氧化的第一道防线, 含硒的GSH-Px起着第二道防线的作用[11], 二者在防止细胞膜脂质的过氧化反应、保护细胞膜、肝线粒体及内质网膜的稳定性方面具有互补作用. 本实验结果显示, 膳食中适量补充VitE和亚硒酸钠, 可有效防止脂质过氧化反应的发生, 减少对P4501A1的诱导和肝组织中TNF-α、NF-κB蛋白的表达, 进而阻止炎症-坏死循环, 对病变的进展起到有效的干预作用. 二者联合应用对增强抗氧化能力作用更显著, 这为临床上脂肪肝的治疗提供了一定的理论和实验依据.
非酒精性脂肪性肝病(NAFLD)是一种无过量饮酒史, 以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征, 目前在欧美发达国家已成为最普遍的肝脏疾病, 近年来在我国发病率逐年升高, 据现有流行病学研究结果显示, 北京、上海、杭州职员发病率分别为11. 0 %、12.8%、5.2%.
NAFLD发病机制至今尚未完全阐明. 目前较为公认的“二次打击学说”认为氧应激及脂质过氧化在脂肪肝发生发展过程中处于主导地位, 脂肪性肝炎是单纯性脂肪肝从机体适应性反应向进展性病理状态发展的转折点, 其预后与单纯性脂肪肝截然不同. 目前认为脂质过氧化反应可能是单纯性脂肪肝诱导脂肪性肝炎和肝纤维化的重要机制.
国外学者Shertzer et al研究报道, 肝微粒体CYP1A1表达增强与羟自由基的生成增多及脂质过氧化有关. 第三军医大学史洪涛 et al学者研究报道, 非酒精性脂肪肝形成时肝CYP1A1 活性明显增强, 其增高 与脂肪肝的严重程度密切相关; 并且认为肝微粒体CYP1A1 表达增强与脂质过氧化及自由基生成增多有关, 随着脂肪变程度的加重, CY1A1活性明显增高, 使脂质过氧化反应加剧, 损害肝细胞结构和功能.
VitE和硒是两种重要的抗氧化剂. 本实验在膳食中单独及联合补充适量VitE和亚硒酸钠, 对脂肪肝损伤程度起到不同程度的干预作用, 二者联合作用更显著, 为临床上脂肪肝的治疗提供了一定的理论和实验依据.
本文层次清楚, 条理分明, 数据可信, 对基础研究有一定的参考意义.
编辑: 程剑侠 电编:何基才
| 1. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] |
| 2. | Day CP. Pathogenesis of steatohepatitis. Best Pract Res Clin Gastroenterol. 2002;16:663-678. [PubMed] |
| 6. | Ioannides C, Parke DV. Induction of cytochrome P4501 as an indicator of potential chemical carcino-genesis. Drug Metab Rev. 1993;25:485-501. [PubMed] |
| 7. | Shertzer HG, Clay CD, Genter MB, Schneider SN, Nebert DW, Dalton TP. Cyp1a2 protects against reactive oxygen production in mouse liver microsomes. Free Radic Biol Med. 2004;36:605-617. [PubMed] |
| 8. | Kaplowitz N. Biochemical and cellular mechanisms of toxic liver injury. Semin Liver Dis. 2002;22:137-144. [PubMed] |
| 9. | 范 建高. 脂肪肝与肝纤维化的关系及其机制. 国外医学消化系疾病分册. 1997;17:92-95. |