修回日期: 2007-09-01
接受日期: 2007-09-11
在线出版日期: 2007-09-18
目的: 观察紫杉醇联合希罗达治疗31例晚期胃癌患者的疗效和副作用.
方法: 紫杉醇175 mg/m2, 静脉滴注3 h, 第1天; 希罗达1000 mg/m2, po, 2次/d, 第1-14天, 每21或28天为1个周期. 每例患者治疗至少2个周期, 2个周期化疗4 wk后评价疗效.
结果: 在可评价疗效的31例患者中, 完全缓解(CR)1例(3.2%), 部分缓解(PR)15例(48.4%), 稳定(SD)10例(32.3%), 进展(PD)5例(16.1%), 总有效率(CR+PR)51.6%, 95%可信区间为33%-70%; 临床获益者(CR+PR+SD)共26例(83.9%), 95%可信区间为66%-94%; 平均肿瘤进展时间(TTP)为5.32±1.85 mo; 平均生存期(MST)为11.40±1.68 mo. 不良反应主要为恶心呕吐、骨髓抑制、腹泻、手足综合征及脱发.
结论: 紫杉醇联合希罗达治疗晚期胃癌疗效好, 副作用小, 患者耐受性好.
引文著录: 伍小平, 庄英帜, 姜浩, 伍尤华, 戴文香, 艾小红, 唐三元. 紫杉醇联合希罗达治疗晚期胃癌31例. 世界华人消化杂志 2007; 15(26): 2844-2846
Revised: September 1, 2007
Accepted: September 11, 2007
Published online: September 18, 2007
AIM: o evaluate the efficacy and adverse effects of a regimen of paclitaxel and Xeloda in the treatment of patients with advanced gastric cancer.
METHODS: Paclitaxel (175 mg/m2) was administered by intravenous drip for 3 h in the first day of the experiment; Xeloda (1000 mg/m2) was administered po, twice between the first day and the fourth day, and then every 21 or 28 d. Each patient was treated for more than two circles and evaluated four weeks later.
RESULTS: Among the 31 evaluable patients, 1 (3.2%) showed complete remission (CR), 15 (48.4%) showed partial remission (PR), 10 (32.3%) showed stable disease (SD) and 5 (16.1%) showed disease progression (PD). The overall response rate was 51.6% with a 95% confidence interval (CI) (range: 33%-70%); and 26 (83.9%) of the patients benefited (CR + PR + SD) from the clinical therapy with a 95% CI (range: 66%-90%). The mean time to tumor progression (TTP) was 5.32 ± 1.85 mo, and the mean survival time (MST) was 11.40 ± 1.68 mo. The main side effects were nausea and vomiting, myelosuppression, diarrhea, hand-foot syndrome and alopecia.
CONCLUSION: A regimen of paclitaxel and Xeloda has a definite effect with acceptable toxicity in the treatment of patients with advanced gastric cancer.
- Citation: Wu XP, Zhuang YZ, Jiang H, Wu YH, Dai WX, Ai XH, Tang SY. Treatment of patients with advanced gastric cancer with paclitaxel combined with Xeloda: an analysis of 31 cases. Shijie Huaren Xiaohua Zazhi 2007; 15(26): 2844-2846
- URL: https://www.wjgnet.com/1009-3079/full/v15/i26/2844.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i26.2844
胃癌是最常见的恶性肿瘤之一, 我国胃癌的死亡率仅低于肺癌, 占各种恶性肿瘤的第2位, 每年约有超过160 000人死于胃癌[1]. 在我国大多数胃癌患者就诊时已是晚期, 失去了手术根治切除的时机. 因此化疗在晚期胃癌的治疗中有重大的临床意义. 本文收集2004-07-01/2006-12-01我科以紫杉醇联合希罗达治疗31例晚期胃癌患者的资料, 现报告如下.
本组31例患者中, 男19例, 女12例, 年龄30-72(中位年龄54)岁. 17例因有远处转移未行手术治疗, 14例为手术后复发转移, 所有患者均通过手术或胃镜活检取得病理确诊, 所有患者的病灶均可通过测量评价疗效, 预计生存期超过3 mo, 都为初次应用化疗, 血常规、心脏、肝肾功能均正常, Karnofsky评分≥60分.
紫杉醇175 mg/m2, 静脉滴注3 h, 第1天, 使用紫杉醇前先行预防过敏反应的预处理; 希罗达1000 mg/m2, po, 每天2次, 第1-14天, 每21或28天为1个周期. 每例患者治疗至少2个周期, 2个周期化疗4 wk后评价疗效. 每个周期化疗前后复查血常规、心电图、肝肾功能. 31例患者共接受142个周期化疗, 每例患者平均疗程数为5(3-8)个周期. 疗效评定根据WHO关于实体瘤的客观疗效评定标准分为: 完全缓解(CR), 部分缓解(PR), 稳定(SD), 进展(PD). 有效率(RR)为CR+PR病例数占可评价疗效的百分数. 不良反应按WHO关于抗癌药物常见毒副反应分级标准分为0-Ⅳ度. 平均肿瘤进展时间(TTP)指治疗开始到肿瘤进展的平均时间; 平均生存期(MST)指化疗开始至死亡的平均时间. 采用电话随访, 最后随访时间2006-12-01, 全部病例均获随访.
统计学处理 数据分析利用SPSS10.0统计软件包进行处理, 计算有效率及临床获益率的95%可信区间、TTP及ST的均数.
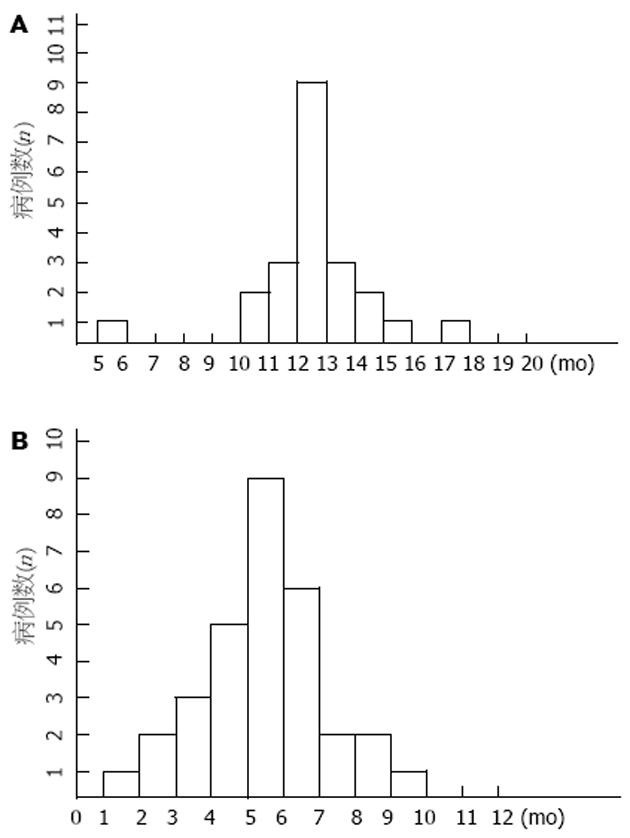
在可评价疗效的31例患者中, CR 1例(3.2%), PR 15例(48.4%), SD 10例(32.3%), PD 5例(16.1%), 总有效率(CR+PR)51.6%, 其95%可信区间为33%-70%; 临床获益者(CR+PR+SD)共26例, 占83.9%, 其95%可信区间为66%-94%. 紫杉醇联合希罗达方案治疗31例晚期胃癌患者的ST, TTP情况见图1. MST为11.40±1.68 mo, TTP为5.32±1.85 mo.
在我国, 胃癌的发病率及死亡率均居恶性肿瘤之首, 每年死于胃癌者达160 000人, 占全部恶性肿瘤死亡人数的23%[2]. 目前我国胃癌的防治现状是"三低一高", 即早期诊断率低, 手术切除率低, 5 a生存率低, 根治术后复发转移率高[3]. 患者在确诊时大多数已存在不同程度的转移, 术后很快复发或根本失去手术机会, 晚期胃癌难以治愈, 故晚期胃癌的治疗是以达到延长生存期, 提高生活质量的姑息治疗为目的. 而全身化疗在晚期胃癌姑息治疗中的作用优于最好支持治疗早有定论, 只进行最佳的支持治疗(BSC)而不接受化疗的晚期胃癌患者MST为3-5 mo, 而接受化疗的晚期胃癌患者的MST可达9-11 mo, 可见化疗较最好支持治疗能明显延长生存期[4]. 然而化疗药物的副作用较大, 而晚期胃癌患者的一般情况较差, 对化疗的耐受性较差, 因此对晚期胃癌患者行联合化疗时要充分考虑到化疗的疗效, 副作用及患者耐受性之间的平衡.
晚期胃癌以全身化疗为主, 胃癌是对化疗相对敏感的恶性肿瘤, 但目前胃癌治疗依然没有所谓的"金标准"化疗方案[5]. 以往化疗基本上是采用以5-FU为主的方案(如FAM、ECF等), 进入21世纪多种新药(如紫杉类、草酸铂、伊立替康及希罗达等)组成联合化疗方案(如TCF、FOLFOX等)来治疗晚期胃癌, 疗效得到了一定的提高, 但副作用大[6], 患者难以耐受, 且方案中的5-FU是采用持续静脉滴注, 要求使用该方案的患者中心静脉置管带化疗泵, 给患者的生活带来诸多不便, 对于姑息治疗的患者来说一般难以接受, 医从性差.
紫杉醇是一种新型抗微管药, 通过促进微管蛋白装配成微管, 并抑制其解聚, 从而影响细胞的有丝分裂和增殖. 1994年美国MDAnderson癌症中心的著名学者Ajani首先报道用于治疗晚期胃癌, 紫杉醇治疗胃癌的单药有效率为20%-24%[7], 联合用药的有效率可达68%[8]. 希罗达通用名是卡培他滨, 化学名N4-戊基羧酸-5'-脱氧-5-氟胞嘧啶, 是新一代po选择性氟尿嘧啶甲氨酸盐抗肿瘤药, 是5-FU的前体药物, po后经胃肠道以原形吸收, 经过独特的3步激活计划, 最后在到达肿瘤组织后转化为5-FU而发挥细胞毒作用, 作用于细胞周期的S期, 对肿瘤细胞具有很强的靶向性, 希罗达每天po两次可保持恒定的血药浓度, 与5-FU相比抗癌作用增强, 毒副作用少[9], 且希罗达是po给药, 可免除使用5-FU时长期静脉置管带泵之不便. 紫杉类药物联合方案化疗增加了疗效, 但骨髓抑制仍是最大问题. 近年人们不断探索其他新药与紫杉醇联用或改变给药方法以期保证疗效或降低毒性, 而5-FU类po药希罗达以其方便、低毒符合晚期胃癌患者的体质特点(消化功能差、耐受性差等)受到关注. 紫杉类药物与希罗达联合应用, 两药作用靶点部位不同, 紫杉醇可上调肿瘤组织内的TP酶而增强希罗达疗效, 虽未加用DDP但临床初步观察其疗效并未降低, 而不良反应明显降低[10]. 所以本方案有充分的理论依据, 方便患者, 疗效并得到本组临床观察的支持.
我组临床观察紫杉醇联合希罗达方案治疗晚期胃癌, 总有效率为51.6%, 95%可信区间为33%-70%; 临床获益率为83.9%, 95%可信区间为66%-94%; 平均TTP为5.32±1.85 mo; MST为11.40±1.68 mo, 化疗的近期有效率高, 化疗后晚期胃癌患者的生活质量得到提高, 生存期明显延长, 且不良反应小, 主要副作用为恶心呕吐、骨髓抑制、腹泻、手足综合征及脱发等, 尤其是患者难以耐受的Ⅲ/Ⅳ度副作用发生率低(主要为骨髓抑制、手足综合症及脱发, 发生率>10%), 副作用经支持对症处理后都能消失, 不影响下一周期化疗的进行, 且患者只需住院1 d输液化疗, 简易方便, 患者医从性好.
总之, 紫杉醇联合希罗达方案对晚期胃癌疗效确切, 副作用小, 患者的化疗耐受性好, 用药简便易行, 患者医从性好, 很好地达到晚期胃癌姑息治疗的目的, 值得临床推广.
在我国, 胃癌发病率及死亡率高, 治愈率低, 每年死于胃癌者达160000人, 占全部恶性肿瘤死亡人数的23%. 我国的胃癌患者在确诊时大多数是晚期, 术后很快复发或根本失去手术机会难以治愈.
化疗在治疗晚期胃癌中的地位已得到公认, 但目前胃癌化疗尚无标准方案. 以往化疗基本上是采用以5-FU为主的方案,进入21世纪多种新药组成联合化疗方案来治疗晚期胃癌, 疗效得到了一定的提高, 但副作用大, 患者难以耐受, 且5-Fu是采用长期持续静脉滴注, 给患者的生活带来诸多不便.
进入21世纪以来, 紫杉类、草酸铂、伊立替康及希罗达等新药用来治疗晚期胃癌,使得晚期胃癌患者的生存期得以明显地改善.
本文采用两种新药联合治疗晚期胃癌, 取得了理想的疗效. 且副作用轻微, 尤其是患者难以耐受的Ⅲ/Ⅳ度副作用发生率低(主要为骨髓抑制、手足综合症及脱发, 发生率>10%), 副作用经支持对症处理后都能消失, 不影响下一周期化疗的进行, 且患者只需住院1 d输液化疗, 简易方便, 患者医从性好.
晚期胃癌患者具有消化功能差、耐受性差等体质特点, 而本文所研究的方案毒副作用小, 应用起来简易方便, 近期及远期疗效好, 值得临床推广使用.
本文阐述了紫杉醇联合希罗达治疗晚期胃癌疗效好, 副作用小, 患者耐受性好, 设计简单, 数据可信,有一定的临床意义.
编辑: 程剑侠 电编:郭海丽
| 2. | 孙 燕. 内科肿瘤学. 第1版. 北京: 人民卫生出版社 2001; 549. |
| 4. | Devita VT Jr, Hellman S and Rosenberg SA. Cancer: Principles and Practice of Oncology (7th edition). Philadalphea: Lippincott Williams &Wilkins 2005; 938. |
| 5. | 储 大同. 当代肿瘤内科治疗方案评价. 第2版. 北京: 北京大学医学出版社 2004; 83. |
| 6. | Wagner AD, Grothe W, Haerting J, Kleber G, Grothey A, Fleig WE. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data. J Clin Oncol. 2006;24:2903-2909. [PubMed] [DOI] |
| 7. | Yamada Y, Shirao K, Ohtsu A, Boku N, Hyodo I, Saitoh H, Miyata Y, Taguchi T. Phase II trial of paclitaxel by three-hour infusion for advanced gastric cancer with short premedication for prophylaxis against paclitaxel-associated hypersensitivity reactions. Ann Oncol. 2001;12:1133-1137. [PubMed] [DOI] |
| 8. | 周 宁宁, 周 中梅, 刘 茂珍, 李 宇红, 徐 瑞华, 腾 小玉, 向 晓娟, 田 维华, 刘 冬耕, 胡 丕丽. 紫杉醇和5-氟尿嘧啶/醛氢叶酸双周疗法治疗晚期胃癌的初步报告. 癌症. 2003;22:867-869. |
| 9. | Schuller J, Cassidy J, Dumont E, Roos B, Durston S, Banken L, Utoh M, Mori K, Weidekamm E, Reigner B. Preferential activation of capecitabine in tumor following oral administration to colorectal cancer patients. Cancer Chemother Pharmacol. 2000;45:291-297. [PubMed] [DOI] |
| 10. | Thuss-Patience PC, Kretzschmar A, Dogan Y, Blau I, Pink D, Lebedinzew B, Micheel S, Dorken B, Reichardt P. Capecitabine and docetaxel for advanced gastric cancer. J Clin Oncol. 2006;24:4068. |