修回日期: 2007-09-03
接受日期: 2007-09-11
在线出版日期: 2007-09-18
目的: 观察低浓度一氧化碳(CO)吸入和腹腔给予在防止脂多糖(LPS)诱导大鼠小肠损伤中的作用, 探讨其可能的信号转导机制.
方法: 6组SD大鼠ip 5 mg/kg体质量LPS或等容量生理盐水1 h后, 对照组(A)吸入室内空气, CO组(B)吸入体积分数为2.5×10-4 CO, CO腹腔组(C)腹腔通入体积分数为2.5×10-4 CO, LPS组(D)吸入室内空气, LPS+CO组(E)吸入体积分数为2.5×10-4 CO, LPS+CO腹腔组(F)腹腔通入体积分数为2.5×10-4 CO. 观察3 h放血处死, 取小肠, 酶联免疫吸附法测定血小板活化因子(PAF)、细胞间黏附分子-1(ICAM-1)水平; 化学比色法测定丙二醛(MDA)含量及髓过氧化物酶(MPO)活性; 流式细胞仪测定细胞凋亡率; 半定量逆转录聚合酶链反应测定血红素氧合酶-1(HO-1)mRNA, 蛋白印迹法测定磷酸化p38 MAPK表达; 光镜观察形态学变化.
结果: E和F组PAF、ICAM-1、MDA、MPO的表达(0.87±0.18 ng/g, 0.82±0.16 ng/g vs 1.15±0.21 ng/g; 2.96±0.39 ng/g, 2.69±0.23 ng/g vs 3.48±0.36 ng/g; 1.74±0.17 mmol/g, 1.71±0.24 mmol/g vs 2.75±0.76 mmol/g; 35.34±14.67 μkat/g, 33.01±12.84 μkat/g vs 68.01±18.67 μkat/g; P<0.05)以及细胞凋亡率均明显低于D组(30.56%±6.33%, 34.45%±5.77% vs 41.52%±3.36%; P<0.05), 而HO-1 mRNA及磷酸化p38 MAPK的表达显著高于D组(6.29±1.56, 7.21±1.78 vs 3.97±1.16, 14219±1724, 13774±1886 vs 10227±1312; P<0.05), E和F组小肠损伤较D组减轻, 组间比较, 差异无统计学意义.
结论: 低浓度CO吸入和腹腔给予通过抗氧化、抗炎、抑制细胞凋亡及上调HO-1表达, 在防止大鼠小肠避免LPS诱导损伤中的保护作用; p38 MAPK可能参与CO保护作用的信号转导.
引文著录: 刘少华, 马可, 许兵, 徐鑫荣. 低浓度一氧化碳在防止大鼠小肠脂多糖诱导损伤中的保护作用. 世界华人消化杂志 2007; 15(26): 2780-2785
Revised: September 3, 2007
Accepted: September 11, 2007
Published online: September 18, 2007
AIM: To observe the effects of the inhalation or intraperitoneal infusion of a low concentration of carbon monoxide (CO) on lipopolysaccharide (LPS)-induced rat small intestine injury, and to identify the roles of the p38 mitogen-activated protein kinase (p38 MAPK) pathway in these effects.
METHODS: Sprague-Dawley rats with small intestine injury induced by a 5 mg/kg LPS intravenous injection or an equal volume of NS were divided into six groups: A, control group (inhalation of room air); B, CO group (inhalation of 2.5 × 10-4V/V CO ); C, CO intraperitoneal infusion group (intraperitoneal infusion of 2.5 × 10-4V/V CO); D, LPS group (inhalation of room air); E, LPS + CO group (inhalation of 2.5 × 10-4V/V CO); and F, LPS + CO intraperitoneal infusion group (intraperitoneal infusion of 2.5 × 10-4V/V CO). Rats were sacrificed by exsanguination and small intestinal tissues were homogenized for testing. The levels of platelet activator factor (PAF) and intercellular adhesion molecule-1 (ICAM-1) were determined by enzyme-linked immunosorbent assay. Maleic dialdehyde (MDA) content and myeloperoxidase (MPO) activity were determined by chemical methods. The extent of cell apoptosis was determined by flow cytometry. The expression level of the heme oxygenase-1 (HO-1) gene was analyzed by semi-quantitative reverse transcription-polymerase chain reaction and the level of phosphorylated p38 mitogen-activated protein kinase (MAPK) activity was determined by Western blot. Pathology was determined by light microscopy.
RESULTS: The levels of PAF, ICAM -1, MDA and MPO (P < 0.05), and the rates of apoptosis, were lower in groups E (0.87 ± 0.18 ng/g, 2.96 ± 0.39 ng/g, 1.74 ± 0.17 mmol/g, 35.34 ± 14.67 μkat/g, 30.56% ± 6.33%) and F (0.82 ± 0.16 ng/g, 2.69 ± 0.23 ng/g, 1.71 ± 0.24 mmol/g, 33.01 ± 12.84 μkat/g, 34.45% ± 5.77%) than in group D (1.15 ± 0.21 ng/g, 3.48 ± 0.36 ng/g, 2.75 ± 0.76 mmol/g, 68.01 ± 18.67 μkat/g, 41.52% ± 3.36%, P < 0.05). The levels of HO-1 mRNA and phosphorylated p38 MAPK were higher in groups E (6.29 ± 1.56, 14 219 ± 1724) and F (7.21 ± 1.78, 13 774 ± 1886) than in group D (3.97 ± 1.16, 10 227 ± 1312; P < 0.05). In contrast to group D rats, the small intestine injury in rats in groups E and F was ameliorated. There were no significant differences between groups E and F.
CONCLUSION: Low-concentration CO inhalation and intraperitoneal infusion exert similar protection against LPS-induced rat small intestine injury via anti-oxidant, anti-inflammatory and anti-apoptotic mechanisms, as well as through the up-regulation of HO-1 expression. This may involve the p38 MAPK pathway.
- Citation: Liu SH, Ma K, Xu B, Xu XR. Low-concentration carbon monoxide protects against lipopolysaccharide-induced rat small intestine injury. Shijie Huaren Xiaohua Zazhi 2007; 15(26): 2780-2785
- URL: https://www.wjgnet.com/1009-3079/full/v15/i26/2780.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i26.2780
我们以前的研究观察到低浓度一氧化碳(CO)吸入可以抑制细菌脂多糖(LPS)诱导的大鼠肺和肠组织过氧化、炎症性损伤及细胞凋亡从而起保护作用[1-3]. 丝裂原活化蛋白激酶p38(p38 MAPK)信号转导通路已被广泛证明参与抑制LPS诱导的炎性损伤及细胞凋亡[4-5]. 因此推测p38 MAPK通路可能参与CO的上述保护作用. 本文在前述研究基础上, 观察CO给予方式改变的影响、及影响过程中磷酸化p38 MAPK表达的变化, 探讨其可能的信号转导机制.
成年健康♂SD大鼠, 南京医科大学动物实验中心提供, 体质量200-250 g, 清洁级, 合格证号: NMXK(苏)2004-0018. LPS (E.coli O111: B4, Sigma公司), 血小板活化因子(PAF)和细胞间黏附因子-1(ICAM-1)测试盒(上海晶美生物公司), 丙二醛(MDA)、髓过氧化物酶(MPO)和考马斯亮兰蛋白定量测试盒(南京建成生物工程有限公司), 膜联蛋白-V-异硫氢酸萤光素(Annexin-V-FITC)、碘化吡啶(PI)(美国BD Pharmingen公司), 流式细胞仪(FACS Vantage SE, 美国BD公司), TRIzol总RNA提取试剂、反转录和PCR扩增所需酶(美国Promega公司), 硝酸纤维素膜(美国Amersham公司), 小鼠抗大鼠actins mAb, FITC-羊抗小鼠IgG(二抗), 均购自美国Santa Cruz公司, DAB显色系统(武汉博士德), CO气体(南京特种气体厂, 储存浓度的体积分数分别为1.0、2.5×10-4, 后者平衡气体为空气).
36只大鼠按照随机数字表法分为对照, CO, CO腹腔, LPS, LPS+CO吸入和LPS+CO腹腔6组. 1 g/L戊巴比妥钠30 mg/kg ip麻醉, 后3组iv 5 mg/kg LPS, 前3组iv等容量生理盐水. 1 h后, 对照组吸入室内空气, CO组吸入体积分数为2.5×10-4 CO, CO腹腔组腹腔通入体积分数为2.5×10-4 CO, LPS组吸入室内空气, LPS+CO吸入组吸入体积分数为2.5×10-4 CO, LPS+CO腹腔组腹腔通入体积分数为2.5×10--4 CO. 采用有明显组织形态学改变为肠道损伤的判断标准.
CO给予参照文献[6]并作改进, 预先准备一只两端开口、充满空气的36 L密闭容器, 向内注入9 mL体积分数为1.0的CO, 充分混匀, 自一端开口以2 L/min持续通入CO体积分数为2.5×10-4的压缩气体, 另一端接管向室外排气; 分别在大鼠右下及左上腹穿刺小孔, 自右下腹孔以2 L/min持续通入体积分数为2.5×10-4CO, 左上腹孔接管向外排气. 实验过程中随机3次气体采样, 经CO浓度测定仪(Interscan Co., CA)证实容器及大鼠腹腔内CO浓度的体积分数基本稳定在2.5×10-4, 继续下列实验.
大鼠置入容器及腹腔内持续通气3 h, 观察结束时, 予10 g/L戊巴比妥钠20 mg/kg ip麻醉, 剖腹自腹主动脉放血处死, 取回盲部上小肠, 4℃生理盐水冲洗干净, 组织匀浆, 离心(3000 r/min, 10 min), 取上清液, 考马斯亮兰法测定蛋白含量, 结果以毫克蛋白中的含量表示.
1.2.1 PAF, ICAM-1, MDA和MPO测定: 肠组织匀浆离心后的上清液, 按测试盒说明书用酶联免疫吸附法测定PAF, ICAM-1含量, 化学比色法测定MDA含量和MPO活性.
1.2.2 细胞凋亡测定: 参照文献[7], 用Annexin-V/PI双染色流式细胞仪法测定. 将制备的单细胞悬液0.5 mL, 在0℃-4℃, 用700 mL/L乙醇固定30 min, 1500 r/min离心4 min, 去除上清液, 加入1 g/L的Rnase 0.2 mL, 37℃孵育30 min, 磷酸盐缓冲液(PBS)清洗1次, 再加入碘化丙啶(PI) 1 mL(浓度50 mg/L), 0℃-4℃暗处放置48 h, 以480 nm氩激光激发, 流式细胞仪双通道接受Annexin-V和PI, 检测10 000个细胞, Mod Fit 2.3分析软件绘制细胞周期分布图, 计算正常二倍体峰前凋亡细胞峰曲线下面积占整个分布曲线下面积的比例, 用百分比表示细胞凋亡程度.
1.2.3 肠组织HO-1 mRNA: 参照文献[7], 用半定量逆转录聚合酶联反应检测. 一步法提取小肠组织匀浆总RNA后先进行逆转录, 扩增(65℃, 10 min)后置于冰上冷却, 再次提取总RNA后扩增 (42℃, 90 min, 94℃, 2 min)及PCR. HO-1上游引物5'-AAGATTGCCCAGAAAGCCCTGGAC-3', 下游引物5'-AACTGTCGCCACCAGAAAGCTGAG-3', 经PCR扩增后, 目的片段长395 bp. β-actin上游引物5'-ATGGATGATGATATCGCCGCG-3', 下游引物5'-TCTCCATGTCGTCCCAGTTG-3', 经PCR扩增后, 目的片段长240 bp. 本实验中, 使用0.5 µg总RNA, HO-1和β-actin PCR的具体循环参数为: HO-1: 94℃×4 min, 94℃×50 s, 63℃×50 s, 72℃×1 min, 32个循环, 末次延伸时间72℃×10 min; β-actin: 94℃×3 min, 94℃×1 min, 55℃×1 min, 72℃×1 min, 72℃×10 min, 32个循环, 取10 µL PCR产物进行电泳, 摄像, 产物半定量用Tiger 920G图像分析系统扫描电泳图的HO-1和相应的β-actin, 测得积分光密度值, 结果以HO-1积分光密度与相应的β-actin积分光密度的比值表示表达强度.
1.2.4 组织形态学观察: 组织经40 g/L多聚甲醛溶液固定24 h, 石蜡包埋, 6 μm切片HE染色, 由本院病理科医师用光镜观察形态学变化.
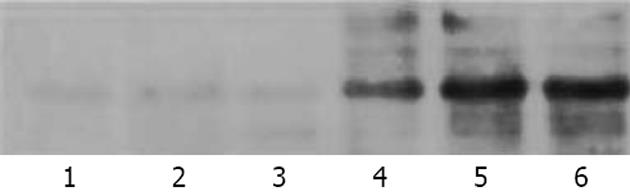
1.2.5 Western blot法检测磷酸化p38 MAPK: 组织采用裂解液4℃下制作匀浆, 12 000 g, 4℃离心30 min, 吸取上清液. 定量蛋白后, 取20 µg样品蛋白行120 g/L SDS-聚丙烯酰胺凝胶电泳(100 V, 4 h)后, 转入硝酸纤维素膜. 用30 g/L的脱脂奶粉(PBS稀释)、室温封闭硝酸纤维素膜30 min, 加入1∶100的磷酸化小鼠抗大鼠mAb, 4℃过夜. PBS洗膜后, 用辣根过氧化物酶标记的羊抗小鼠mAb及DAB显色系统进行反应, 以出现棕黄色条带为阳性结果, 其强度用密度扫描仪并经Chem Image 5500计算机软件(UVP, USA)定量分析(单位: densitometery unit, DU).
统计学处理 数据以mean±SD表示, 经SPSS11.0统计软件处理, 采用单因素方差分析和最小显著法检验.
前3组间比较, 差异无统计学意义; LPS组明显高于前3组(P<0.05); LPS+CO组及LPS+CO腹腔组显著低于LPS组(均P<0.05), 组间比较, 差异无统计学意义(表1).
| 分组 | PAF | ICAM-1 | MDA | MPO | 细胞凋亡率 | HO-1 mRNA | P-p38 MAPK |
| ng/g | ng/g | μmol/g | μkat/g | (%) | (DU) | ||
| 对照 | 0.43±0.08 | 1.69±0.19 | 0.61±0.06 | 27.51±4.67 | 8.02±2.10 | 1.00±0.00 | 2142±539 |
| CO | 0.49±0.04 | 1.71±0.19 | 0.57±0.07 | 26.07±2.67 | 7.71±1.50 | 1.12±0.04 | 3176±420 |
| CO腹腔 | 0.39±0.06 | 1.57±0.21 | 0.58±0.06 | 28.67±5.17 | 10.60±3.16 | 1.08±0.03 | 2347±465 |
| LPS | 1.15±0.21a | 3.48±0.36a | 2.75±0.76a | 68.01±18.67a | 41.52±3.36b | 3.97±1.16b | 10227±1312b |
| LPS+CO吸入 | 0.87±0.18ac | 2.96±0.39ac | 1.74±0.17ac | 35.34±14.67ac | 30.56±6.33bc | 6.29±1.56bc | 14219±1724bc |
| LPS+CO腹腔 | 0.82±0.16ac | 2.68±0.23ac | 1.71±0.24ac | 33.01±12.84ac | 34.45±5.77bc | 7.21±1.78bc | 13774±1886bc |
前3组间比较, 差异无统计学意义; LPS组明显高于前3组(均P<0.01); LPS+CO组及LPS+CO腹腔组显著低于LPS组(均P<0.05), 组间比较, 差异无统计学意义(表1).
前3组间比较, 差异无统计学意义; LPS组高于前3组(均P<0.01). LPS+CO组及LPS+CO腹腔组进一步升高, 高于LPS组(均P<0.05)(表1), 组间比较, 差异无统计学意义.
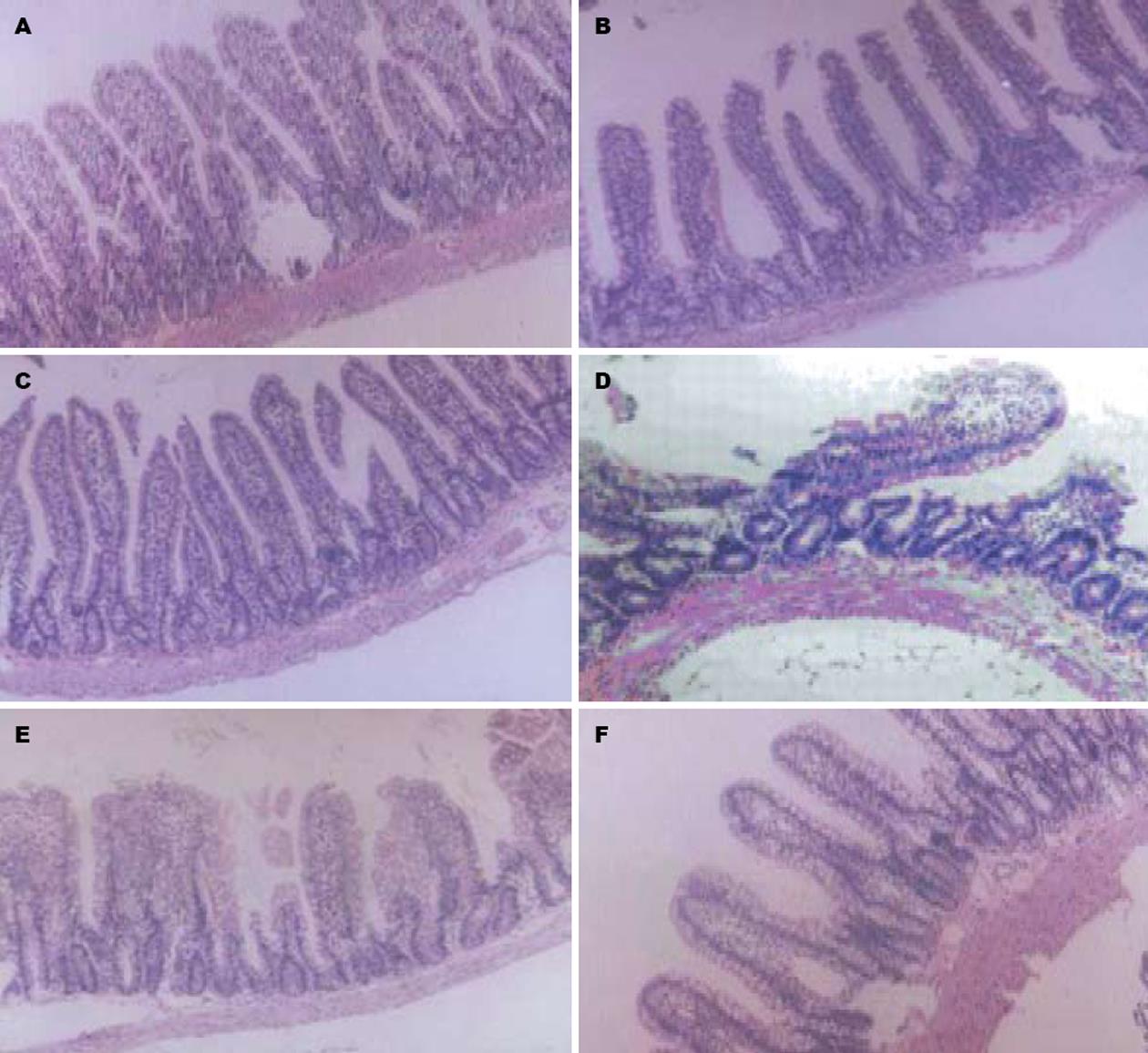
对照组肠绒毛结构完整, 无炎症细胞浸润(图1A); CO吸入及腹腔给予组无明显形态学改变(图1B-C); LPS组大量肠绒毛脱落, 广泛炎症细胞浸润(图1D). LPS+CO组及LPS+CO腹腔组有相似但减轻的形态学改变(图1E-F).
本实验结果显示, LPS诱导大鼠小肠损伤时, 肠组织PAF、ICAM-1、MDA、MPO及细胞凋亡率显著升高, 提示过氧化、促炎介质表达及细胞凋亡增加参与了LPS诱导的肠道损伤; 而给予CO在减轻损伤的同时, 明显降低损伤肠PAF、ICAM-1、MDA、MPO及细胞凋亡率, 这提示CO可抑制LPS诱导的小肠过氧化物、促炎细胞因子产生及细胞凋亡而起保护作用.
肠道既是重症感染最易受损的部位, 又是阻止继发感染和多器官功能障碍的关键. LPS诱导肠道损伤时, 炎症细胞通过呼吸爆发, 产生大量氧自由基, 损伤肠道屏障功能. MDA是氧自由基攻击生物膜中不饱和脂肪酸的代谢产物, 间接反映氧自由基生成量及活性. LPS注入时, MDA升高, 损伤严重[1,3,6,8-10]. 中性粒细胞含有MPO, 他还原过氧化氢, 减少自由基生成. 测定MPO, 反映中性粒细胞数量和活性. LPS诱导肠道损伤时, 肠微循环内扣留粒细胞增多, 活性增强, 使MPO升高[1,3,8-10]. PAF是内源性脂类介质, 可导致微循环血运障碍和通透性增高, 增加炎症细胞及血小板黏附和活化, 介导损伤[6,8,10-12]. ICAM-1参与粒细胞趋化作用及细胞间黏附, 继而引起炎症损伤、血栓形成和细胞凋亡[6,8,10-13]. LPS诱导小肠细胞凋亡增加, 使黏膜萎缩、通透性增高、浅表溃疡形成[1,3,8,10].
CO抗氧化、抗炎症和抑制细胞凋亡作用, 已在我们[1-3]和许多学者研究[6-17]中得到证实. CO阻止氧自由基生成、增加其清除, 降低组织过氧化物含量, 增强对抗自由基诱导的细胞凋亡[1-3,6,8-10]. CO下调促炎介质表达, 增加抗炎细胞因子生成, 抑制白细胞活化及与内皮细胞黏附, 减少炎症细胞浸润和细胞凋亡[1-3,6,9-17]. 许多学者还发现, CO吸入抑制促凋亡基因Fax、Bax和P53的转录, 增加抗凋亡蛋白Bcl-2、IAP等的表达, 抑制凋亡蛋白酶活性, 减少细胞凋亡[6,8-10,14-17]. 吸入CO升高IL-10和SOD, 增强组织抗炎、抗氧化能力[9,18-19]. HO-1的细胞保护作用亦得到研究证实[2,7,20]. 本实验中我们发现, 吸入或腹腔给予CO 3 h, 肠组织HO-1表达增加, 提示CO可反馈上调HO-1, 这与Nakao et al[6]和Moore et al[8]的观察一致. HO-1及其降解血红素代谢产物均具有抗氧化、抗炎作用, 协同增加CO的细胞保护作用[2,7,20].
本研究结果还显示, CO给予使LPS诱导表达增加的磷酸化p38 MAPK进一步增强, 提示p38 MAPK通路可能参与了CO给予后LPS诱导小肠损伤的保护作用. p38 MAPK通路活化参与LPS诱发的氧化、炎症损伤及细胞凋亡[4-5], CO有抗氧化、抗炎及抑制细胞凋亡作用, 因此习惯认为CO可能抑制LPS对p38 MAPK的激活. 但本文及许多学者观察[9,18-28]表明, CO给予活化而非抑制p38 MAPK参与其细胞保护作用. Otterbein et al[19]观察到MKK3/p38 MAPK通路活化, 介导LPS损伤小鼠吸入250 ppm CO后促炎介质产生的抑制和肺细胞凋亡, 增加IL-10合成. Reunanen et al[23]和Ranganathan et al[24]研究发现, p38 MAPK参与CO调控LPS诱导的氧化/抗氧化失衡. Brouard et al[15]认为HO-1源性CO活化p38 MAPK, 抑制TNF-α诱导的内皮细胞凋亡. 结合我们的观察, 有理由相信, CO的抗氧化、抗炎及抑制细胞凋亡依赖MAPK参与. CO给予活化p38 MAPK, 改变后续信号传导通路, 调控介质、酶等的表达[22,25], 或通过能与p38 MAPK活化后启动子区不同反应元件结合的中间分子, 介导不同蛋白合成[26]. Otterbein et al[19]认为CO与p38 MAPK上游激酶内的血红素结构单元结合而起抗炎作用.
总之, 过氧化损伤、促炎介质失控表达及细胞凋亡增多在LPS诱导肠道损伤的发生发展中起重要作用. 外源性低浓度CO吸入和腹腔给予通过抗氧化、抗炎症、抑制细胞凋亡和上调HO-1表达而起相似的保护作用; p38 MAPK信号转导通路可能参与了这一过程.
与一氧化氮类似的一氧化碳(CO)的研究如火如荼,数项动物和人体观察表明, 低浓度CO有重要的细胞保护作用, 但其机制、量时效关系等尚待阐明. 本文观察了CO不同给予方式对脂多糖诱导大鼠小肠损伤的影响、及p38 MAPK信号传导通路的作用.
继一氧化氮作用的全面阐示, 与其有类似作用而非自由基的一氧化碳(CO)的研究成为近年热点. 数项动物和人体观察表明, 低浓度CO有抗氧化、抗炎、抗凋亡作用, 并开始临床应用于脂多糖(LPS)诱导的炎症、高浓度氧及机械通气相关肺损伤、器官移植、血管炎、缺血- 再灌注损伤等, 取得了令人鼓舞的效果. 在动物肺损伤研究中还观察了50-1000 ppm及较长时间(6-72 h)CO吸入有相似的保护作用, 其机制可能与MAPK、JNK的转导有关. 但对LPS诱导肠道损伤的作用及其机制, 量-时-效关系尚未阐明.
本文的创新在于观察了CO不同给予方式对L PS诱导大鼠肠道损伤的影响、及影响过程中p38 MAPK信号转导通路的作用.
1 MAPK: 丝裂原活化蛋白激酶, 是细胞内3条主要信号转导通路(Janus激酶-STAT 、MAPK、NF-kB)之一, 活化后在细胞浆及细胞核内协同或拮抗, 共同完成信号转导, 介导病理生理作用. 2 HO-1: 为3种血红素氧合酶之一(诱导型), 是人类和其他哺乳动物器官和组织中广泛存在的一种加氧酶, 调节细胞内血红素的稳态, 降解血红素为强抗氧化作用的胆绿素、一氧化碳和铁离子, 有重要细胞保护作用.
本文研究了CO在大鼠小肠避免LPS诱导损伤中的保护作用, 研究内容丰富, 采用的方法较恰当, 得出的结果结论较可信, 有一定的学术价值.
编辑: 张焕兰 电编:郭海丽
| 2. | Liu SH, Ma K, Xu B, Xu XR. Carbon monoxide inhalation protects lung from lipopolysaccharide-induced injury in rat. Sheng Li Xue Bao. 2006;58:483-489. [PubMed] |
| 4. | Chang L, Karin M. Mammalian MAP kinase signalling cascades. Nature. 2001;410:37-40. [PubMed] [DOI] |
| 6. | Nakao A, Kimizuka K, Stolz DB, Neto JS, Kaizu T, Choi AM, Uchiyama T, Zuckerbraun BS, Nalesnik MA, Otterbein LE. Carbon monoxide inhalation protects rat intestinal grafts from ischemia/reperfusion injury. Am J Pathol. 2003;163:1587-1598. [PubMed] [DOI] |
| 7. | Lang D, Reuter S, Buzescu T, August C, Heidenreich S. Heme-induced heme oxygenase-1 (HO-1) in human monocytes inhibits apoptosis despite caspase-3 up-regulation. Int Immunol. 2005;17:155-165. [PubMed] [DOI] |
| 8. | Moore BA, Otterbein LE, Turler A, Choi AM, Bauer AJ. Inhaled carbon monoxide suppresses the development of postoperative ileus in the murine small intestine. Gastroenterology. 2003;124:377-391. [PubMed] [DOI] |
| 9. | Wagener FA, Volk HD, Willis D, Abraham NG, Soares MP, Adema GJ, Figdor CG. Different faces of the heme-heme oxygenase system in inflammation. Pharmacol Rev. 2003;55:551-571. [PubMed] [DOI] |
| 10. | Gibbons SJ, Farrugia G. The role of carbon monoxide in the gastrointestinal tract. J Physiol. 2004;556:325-336. [PubMed] [DOI] |
| 11. | Morisaki H, Katayama T, Kotake Y, Ito M, Tamatani T, Sakamoto S, Ishimura Y, Takeda J, Suematsu M. Roles of carbon monoxide in leukocyte and platelet dynamics in rat mesenteric during sevoflurane anesthesia. Anesthesioogy. 2001;95:192-199. [PubMed] [DOI] |
| 12. | Morisaki H, Katayama T, Kotake Y, Ito M, Handa M, Ikeda Y, Takeda J, Suematsu M. Carbon monoxide modulates endotoxin-induced microvascular leukocyte adhesion through platelet-dependent mechanisms. Anesthesiology. 2002;97:701-709. [PubMed] [DOI] |
| 14. | Wang X, Wang Y, Kim HP, Nakahira K, Ryter SW, Choi AM. Carbon monoxide protects against hyperoxia-induced endothelial cell apoptosis by inhibiting reactive oxygen species formation. J Biol Chem. 2007;282:1718-1726. [PubMed] [DOI] |
| 15. | Brouard S, Otterbein LE, Anrather J, Tobiasch E, Bach FH, Choi AM, Soares MP. Carbon monoxide generated by heme oxygenase 1 suppresses endothelial cell apoptosis. J Exp Med. 2000;192:1015-1026. [PubMed] [DOI] |
| 16. | Zuckerbraun BS, McCloskey CA, Gallo D, Liu F, Ifedigbo E, Otterbein LE, Billiar TR. Carbon monoxide prevents multiple organ injury in a model of hemorrhagic shock and resuscitation. Shock. 2005;23:527-532. [PubMed] |
| 17. | Mayr FB, Spiel A, Leitner J, Marsik C, Germann P, Ullrich R, Wagner O, Jilma B. Effects of carbon monoxide inhalation during experimental endotoxemia in humans. Am J Respir Crit Care Med. 2005;171:354-360. [PubMed] [DOI] |
| 18. | Otterbein LE, Bach FH, Alam J, Soares M, Tao Lu H, Wysk M, Davis RJ, Flavell RA, Choi AM. Carbon monoxide has antinflammatory effects involving the mitogen-activated protein kinase pathway. Nat Med. 2000;6:422-428. [PubMed] [DOI] |
| 19. | Otterbein LE, Otterbein SL, Ifedigbo E, Liu F, Morse DE, Fearns C, Ulevitch RJ, Knickelbein R, Flavell RA, Choi AM. MKK3 mitogen-activated protein kinase pathway mediates carbon monoxide-induced protection against oxidant-induced lung injury. Am J Pathol. 2003;163:2555-2563. [PubMed] [DOI] |
| 20. | Silva G, Cunha A, Gregoire IP, Seldon MP, Soares MP. The antiapoptotic effect of heme oxygenase-1 in endothelial cells involves the degradation of p38 alpha MAPK isoform. J Immunol. 2006;177:1894-1903. [PubMed] [DOI] |
| 21. | Ryter SW, Otterbein LE, Morse D, Choi AM. Heme oxygenase/carbon monoxide signaling pathways: regulation and functional significance. Mol Cell Biochem. 2002;234-235:249-263. [PubMed] [DOI] |
| 22. | Zhang X, Shan P, Alam J, Davis RJ, Flavell RA, Lee PJ. Carbon monoxide modulates Fas/Fas ligand, caspases, and Bcl-2 family proteins via the p38alpha mitogen-activated protein kinase pathway during ischemia-reperfusion lung injury. J Biol Chem. 2003;278:22061-22070. [PubMed] [DOI] |
| 23. | Reunanen N, Li SP, Ahonen M, Foschi M, Han J, Kahari VM. Activation of p38 alpha MAPK enhances collagenase-1 (matrixmetalloproteinase (MMP)-1) and stromelysin-1 (MMP-3) expression by mRNA stabilization. J Biol Chem. 2002;277:32360-32368. [PubMed] [DOI] |
| 24. | Ranganathan AC, Nelson KK, Rodriguez AM, Kim KH, Tower GB, Rutter JL, Brinckerhoff CE, Huang TT, Epstein CJ, Jeffrey JJ. Manganese superoxide dismutase signals matrix metalloproteinase expression via H2O2-dependent ERK1/2 activation. J Biol Chem. 2001;276:14264-14270. [PubMed] |
| 25. | Zhang X, Shan P, Otterbein LE, Alam J, Flavell RA, Davis RJ, Choi AM, Lee PJ. Carbon monoxide inhibition of apoptosis during ischemia-reperfusion lung injury is dependent on the p38 mitogen-activated protein kinase pathway and involves caspase 3. J Biol Chem. 2003;278:1248-1258. [PubMed] [DOI] |
| 26. | Zhang X, Shan P, Alam J, Fu XY, Lee PJ. Carbon monoxide differentially modulates STAT1 and STAT3 and inhibits apoptosis via a phosphatidylinositol 3-kinase/Akt and p38 kinase-dependent STAT3 pathway during anoxia-reoxygenation injury. J Biol Chem. 2005;280:8714-8721. [PubMed] [DOI] |
| 27. | Mishra S, Fujita T, Lama VN, Nam D, Liao H, Okada M, Minamoto K, Yoshikawa Y, Harada H, Pinsky DJ. Carbon monoxide rescues ischemic lungs by interrupting MAPK-driven expression of early growth response 1 gene and its downstream target genes. Proc Natl Acad Sci U S A. 2006;103:5191-5196. [PubMed] [DOI] |
| 28. | Kohmoto J, Nakao A, Stolz DB, Kaizu T, Tsung A, Ikeda A, Shimizu H, Takahashi T, Tomiyama K, Sugimoto R. Carbon Monoxide Protects Rat Lung Transplants From Ischemia-Reperfusion Injury via a Mechanism Involving p38 MAPK Pathway. Am J Transplant. 2007;7:2279-2290. [PubMed] [DOI] |