修回日期: 2007-08-18
接受日期: 2007-08-28
在线出版日期: 2007-08-28
目的: 探讨延迟的丙酮酸乙酯(EP)治疗对重症急性胰腺炎(SAP)大鼠血清高迁移率族蛋白1(HMGB1)水平和胰外脏器损伤的影响.
方法: 96只大鼠随机分为3组, 假手术组(Sham组, n = 32)、重症急性胰腺炎组(SAP组, n = 32)和丙酮酸乙酯延迟治疗组(EP组, n = 32), 采用胰胆管逆行灌注人工胆汁的方法复制大鼠SAP模型. EP组建模12, 18, 30 h分别尾静脉注射1次EP溶液30 mg/kg. 建模后24和48 h处死动物取材, 取血清检测HMGB1水平及肝肾功能生化指标, 取肺组织用于肺损伤检测.
结果: 延迟的EP治疗能有效降低SAP大鼠血清HMGB1水平. EP组血清丙氨酸转氨酶(ALT, 446±91 IU/L vs 653±98 IU/L, P<0.01)、天冬氨酸转氨酶(AST, 667±103 IU/L vs 1368±271 IU/L, P<0.01)、尿素氮(BUN, 38±4 mg/dL vs 41±4 mg/dL, P>0.05)和肌酐(Cr, 1.2±0.3 mg/dL vs 1.8±0.3 mg/dL, P<0.01)水平以及肺湿/干比(8.22±0.42 vs 9.76±0.45, P<0.01)和组织学评分(7.1±0.7 vs 8.4±1.1, P<0.01)均明显低于SAP组.
结论: 延迟的EP治疗通过下调血清HMGB1水平减轻SAP大鼠胰外脏器损伤. EP可能是SAP患者抗炎治疗和脏器功能保护的有效选择.
引文著录: 杨智勇, 凌燕, 陶京, 周峰, 熊炯炘, 吴河水, 王春友. 延迟的丙酮酸乙酯治疗对重症急性胰腺炎大鼠胰外脏器损伤的影响及其机制. 世界华人消化杂志 2007; 15(24): 2638-2642
Revised: August 18, 2007
Accepted: August 28, 2007
Published online: August 28, 2007
AIM: To investigate the effects of delayed ethyl pyruvate (EP) delivery on distant organ injury and serum high mobility group box protein 1 (HMGB1) levels in rats with severe acute pancreatitis (SAP).
METHODS: The SAP animal model was induced by retrograde injection of artificial bile into the pancreatic duct in rats. Rats were randomly divided into three groups; sham, AHNP and delayed EP treatment (n = 32 in each group). Rats in the delayed EP treatment group received EP (30 mg/kg) at 12, 18 and 30 hours after induction of SAP. Animals were sacrificed and samples were obtained at 24 and 48 hours after induction of SAP. Levels of serum HMGB1, aspartate aminotransferase (AST), alanine aminotransferase (ALT), blood urea nitrogen (BUN), and creatinine (Cr) were measured. Lung wet-to-dry weight (W/D) ratio and histological score were calculated to evaluate lung injury.
RESULTS: Delayed EP treatment significantly reduced serum HMGB1 levels and protected against liver, kidney and lung injury, with a reduced lung W/D ratio (8.22 ± 0.42 vs 9.76 ± 0.45, P < 0.01), pulmonary histological score (7.1 ± 0.7 vs 8.4 ± 1.1, P < 0.01), serum AST (667 ± 103 IU/L vs 1368 ± 271 IU/L, P < 0.01), ALT (446 ± 91 IU/L vs 653 ± 98 IU/L, P < 0.01), BUN (38 ± 4 mg/dL vs 41 ± 4 mg/dL, P > 0.05) and Cr (1.2 ± 0.3 mg/dL vs 1.8 ± 0.3 mg/dL, P < 0.01) levels.
CONCLUSION: Delayed EP therapy protects against distant organ injury by reducing serum HMGB1 levels in rats with experimental SAP. EP appears to be an effective new therapeutic option against inflammatory responses and multiple organ dysfunction syndrome in SAP patients.
- Citation: Yang ZY, Ling Y, Tao J, Zhou F, Xiong JX, Wu HS, Wang CY. Effects and mechanism of delayed ethyl pyruvate therapy on distant organ injury in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(24): 2638-2642
- URL: https://www.wjgnet.com/1009-3079/full/v15/i24/2638.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i24.2638
重症急性胰腺炎(SAP)患者早期的死亡与多脏器功能不全(MODS)密切相关. 炎症因子过度释放是导致SAP患者发生MODS的重要原因[1]. 这些炎症因子包括肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)等. 针对这些炎症因子的治疗似乎是防治MODS的有效途径. 但TNF-α和IL-1β等细胞因子均在早期释放, 在启动全身炎症反应后又迅速下调, 对其进行针对性治疗的时窗较窄. 在患者诊断明确并开始接受治疗时, 由TNF-α和IL-1β等细胞因子触发的"瀑布样"炎症反应往往已经发生, 因此, 针对上述细胞因子的拮抗治疗往往难以奏效[2].
30年来, 高迁移率族蛋白1(HMGB1)一直被认为是1种DNA结合蛋白, 广泛存在于真核细胞内. 近年来发现, HMGB1作为重要的晚期炎症介质参与了脓毒症的病理生理过程[3]. 脓毒症[3-5], 出血性休克[6], 急性肺损伤[7-8], 风湿性关节炎[9]和弥散性血管内凝血[10]患者血清HMGB1水平均升高. 研究表明, 注射抗HMGB1抗体能提高内毒素血症小鼠的生存率[3]. HMGB1之所以被称为晚期炎症介质, 是因为他在内毒素血症模型中与TNF-α和IL-1β早期释放的特点不同, 具有延迟释放的特征. 内毒素血症小鼠血清HMGB1水平在建模后8-32 h升高, 此时TNF-α和IL-1β的释放高峰已过并已下调[3]. 由此可见, 针对HMGB1的治疗措施(如抗HMGB1抗体和HMGB1拮抗剂等)似乎有治疗与HMGB1过度释放相关疾病的潜力, 而且他延迟释放的动力学特点为治疗提供了较宽的时窗[11].
我们在前期研究中发现, SAP大鼠血清HMGB1水平在建模后12 h开始升高, 一直高水平持续至48 h[12]. 国外有研究显示, SAP患者血清HMGB1水平升高且与疾病严重度相关[13]; 早期使用抗HMGB1抗体可减轻SAP小鼠的脏器损害[14]. 因此, 我们认为下调HMGB1水平是治疗SAP的有效途径, 而且延迟治疗可能对SAP大鼠仍然有效.
丙酮酸乙酯(EP)最早被用于保护缺血再灌注组织损伤的研究[15]. 后续研究表明, EP可提高致死性失血性休克模型的存活率[16-17]; 可抑制脓毒症小鼠TNF-α和IL-1β的释放下调全身炎症反应, 在延迟24 h开始用药仍然有效[18]. 因此, 我们推测延迟的EP治疗可下调SAP大鼠血清HMGB1水平, 减轻脏器损害.
成年♂Wistar大鼠, 体质量200-250 g, 清洁级, 华中科技大学同济医学院实验动物学部); 牛磺胆酸钠(纯度>95%)、丙酮酸乙酯(纯度>99%)(均购自美国Sigma-Aldrich公司); 浓缩纯化离心管(Centricon YM-100、Centricon YM-3,美国Millipore公司); 0.45 μm硝酸纤维素膜(德国Pall公司); 兔抗HMGB1多克隆抗体(美国BD Pharmingen公司); 碱性磷酸酶标记羊抗兔二抗、BCIP/NBT(北京中山生物公司). EP溶液含130 mmol/L Na+, 4 mmol/L K+, 2.7 mmol/L Ca2+, 139 mmol/L Cl-和32 mmol/L EP, pH值为7.0.
1.2.1 动物模型的构建: 大鼠术前禁食12 h, 自由饮水. 参照Aho et al[19]的方法制备SAP模型. 动物以10 g/L戊巴比妥钠(35 mg/kg)ip麻醉, 上腹正中切口进入腹腔, 显露胰胆管, 以血管夹阻断近肝门处胰胆管后, 用4号头皮静脉针于十二指肠乳头附近经十二指肠壁穿刺, 逆行刺入胰胆管, 在十二指肠乳头处用手指捏闭胆总管末端, 恒速注入50 g/L牛磺胆酸钠生理盐水溶液1 mL/kg, 0.06 mL/min. 观察10-20 min, 证实建模成功后关腹. 术后皮下注射生理盐水40 mL/kg行液体复苏.
1.2.2 分组: 96只大鼠随机分为3组(n = 32), 每组分为两个亚组(n = 16)分别在建模后24和48 h杀动物取材. 假手术组(Sham组)开腹后轻揉胰腺, 关腹并sc生理盐水(40 mL/kg); 重症急性胰腺炎组(SAP组)和丙酮酸乙酯延迟治疗组(EP组)建模后sc生理盐水每6 h 1次(40 mL/kg), EP组建模12, 18, 30 h分别尾静脉注射1次EP溶液30 mg/kg. SAP组同时点尾静脉注射等量不含EP的上述溶液. 建模后24和48 h, 乙醚麻醉动物, 下腔静脉采血留置血清检测HMGB1水平及生化指标; 取肺用于肺损伤检测.
1.2.3 Western: blot法检测HMGB1的表达 先用Centricon YM-100浓缩纯化离心管清除血清中的细胞碎片和凝血时形成的大分子复合物, 然后用Centricon YM-3将血清浓缩15倍, 再经120 g/L SDS-PAGE电泳, 并电转至硝酸纤维素膜上, 按常规进行Western blot分析, 兔抗HMGB1多克隆抗体工作浓度为1:800, 4℃过夜, AP-羊抗兔IgG工作浓度1:600, 常温下摇晃1 h, BCIP/NBT显色, 待特异性蛋白带颜色深度达到要求后, 终止显色反应. 拍照分析30 kDa显色条带的光密度值, 以小鼠胸腺核提取物作为阳性对照[3].
1.2.4 血生化指标检测: 血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、血肌酐和尿素氮水平均由临床自动生化分析仪测定.
1.2.5 肺湿/干比(W/D)和组织学评分: 取左肺组织以滤纸吸干, 称得湿质量后置于60℃烘箱中72 h, 待重量恒定时称得干质量. 计算肺湿/干比 = 肺湿质量/干质量. 取右肺组织进行常规石蜡切片, HE染色. 采用Gloor评分系统[20]对肺泡水肿、肺泡出血和中性粒细胞侵润分别进行评分(正常0分、轻度1分、中度2分、重度3分、极重度4分), 结果以总分表示.
统计学处理 实验结果均以mean±SD表示, 采用SPSS10.0软件包分析, 组间比较采用t检验.
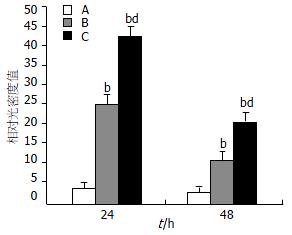
建模后24和48 h, EP组大鼠血清HMGB1水平均低于SAP组(均P<0.01). 延迟的EP治疗明显降低了SAP大鼠血清HMGB1水平(图1).
建模后24 h, SAP组大鼠肺湿/干(g/g)比Sham组明显增高(9.76±0.45 vs 5.43±0.21, P<0.01). EP组大鼠肺湿/干虽然高于Sham组(8.22±0.42 vs 5.43±0.21, P<0.01), 但较SAP组明显降低(P<0.01). EP组大鼠肺组织学评分(7.1±0.7)高于Sham组(0.5±0.1)(P<0.01), 明显低于SAP组(8.4±1.1)(P<0.01).
近年来, 研究显示HMGB1是脓毒症的晚期炎症介质[3,5,21-24]. 我们在前期研究中发现, SAP大鼠血清HMGB1水平在建模后12 h开始升高, 此时TNF和IL-1已过峰值并开始下调[12]. 国外有研究显示, SAP患者血清HMGB1水平升高且与疾病严重度相关[13]; 早期使用抗HMGB1抗体可减轻SAP小鼠的脏器损害[14]. HMGB1延迟释放的动力学特点为SAP的治疗提供了较宽的时窗. EP可通过阻断NF-κB and p38 MAPK信号途径抑制巨噬细胞释放HMGB1, 从而下调脓毒症小鼠血清HMGB1水平[18]. 本研究显示, 即使在建模12 h后开始使用EP治疗, 仍能有效降低SAP大鼠血清HMGB1水平.
重症急性胰腺炎(SAP)患者多死于MODS. 过度激活的单核/巨噬细胞和中性粒细胞释放的炎症因子是导致SAP患者胰外脏器损伤的重要原因[1]. 细胞外HMGB1具有典型的细胞因子活性, 可刺激单核/巨噬细胞、中性粒细胞和血管内皮细胞释放多种炎症介质, 表达黏附分子和趋化因子等[24-27]. 有研究显示早期使用HMGB1抗体可减轻SAP小鼠胰外脏器损伤[14]. 本研究中, 延迟的EP治疗有效降低了SAP大鼠血清AST、ALT和Cr水平, 减轻了肝肾损害. 在EP组, 反映肺水肿的指标肺湿/干比和综合评价肺损伤的指标肺组织学评分均较SAP组低, 显示肺损伤减轻.
本研究显示, 延迟的EP治疗通过下调血清HMGB1水平减轻SAP大鼠胰外脏器损伤, 提示EP可能是SAP患者抗炎治疗和防治MODS的有效药物. 即使错过了最初的治疗时机, 延迟给药可能依然有效.
重症急性胰腺炎发病凶险, 死亡率极高. 其早期死亡多与全身炎症反应所致的多器官功能不全密切相关. 因此早期调控炎症和保护脏器功能具有十分重要的意义.
目前, 重症急性胰腺炎的临床抗炎治疗尚未得到圆满解决. 本研究提出将晚期炎症介质HMGB1作为抗炎靶点, 为重症急性胰腺炎提供了新的治疗策略.
高迁移率族蛋白1具有延迟释放、持续时间长的特点. 针对高迁移率族蛋白1的治疗具有更宽的治疗时窗, 更适合临床应用, 尤其是对于错过了最初治疗时机的患者. 本文针对这一现象进行了深入探讨有一定的新颖性.
丙酮酸乙酯为廉价、使用广泛且无毒的食品添加剂, 若能用于重症急性胰腺炎的治疗, 将具有很好的临床应用前景.
本文与以往针对早期细胞因子治疗胰腺炎不同的是选择延迟释放的HMGB1 为靶点, 通过应用丙酮酸乙酯延迟治疗, 观察到肝肾功能损害较对照组明显减轻, 表明丙酮酸乙酯可通过延迟HMGB1释放来减轻细胞因子对胰外脏器的损伤, 有较好的学术价值和潜在的应用前景.
编辑: 何燕 电编:何基才
| 1. | Lankisch PG, Lerch MM. Pharmacological prevention and treatment of acute pancreatitis: where are we now? Dig Dis. 2006;24:148-159. [PubMed] |
| 2. | Abraham E, Anzueto A, Gutierrez G, Tessler S, San Pedro G, Wunderink R, Dal Nogare A, Nasraway S, Berman S, Cooney R. Double-blind randomised controlled trial of monoclonal antibody to human tumour necrosis factor in treatment of septic shock. NORASEPT II Study Group. Lancet. 1998;351:929-933. [PubMed] |
| 3. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] |
| 4. | Yang H, Ochani M, Li J, Qiang X, Tanovic M, Harris HE, Susarla SM, Ulloa L, Wang H, DiRaimo R. Reversing established sepsis with antagonists of endogenous high-mobility group box 1. Proc Natl Acad Sci U S A. 2004;101:296-301. [PubMed] |
| 5. | Sunden-Cullberg J, Norrby-Teglund A, Rouhiainen A, Rauvala H, Herman G, Tracey KJ, Lee ML, Andersson J, Tokics L, Treutiger CJ. Persistent elevation of high mobility group box-1 protein (HMGB1) in patients with severe sepsis and septic shock. Crit Care Med. 2005;33:564-573. [PubMed] |
| 6. | Ombrellino M, Wang H, Ajemian MS, Talhouk A, Scher LA, Friedman SG, Tracey KJ. Increased serum concentrations of high-mobility-group protein 1 in haemorrhagic shock. Lancet. 1999;354:1446-1447. [PubMed] |
| 7. | Abraham E, Arcaroli J, Carmody A, Wang H, Tracey KJ. HMG-1 as a mediator of acute lung inflammation. J Immunol. 2000;165:2950-2954. [PubMed] |
| 8. | Ueno H, Matsuda T, Hashimoto S, Amaya F, Kitamura Y, Tanaka M, Kobayashi A, Maruyama I, Yamada S, Hasegawa N. Contributions of high mobility group box protein in experimental and clinical acute lung injury. Am J Respir Crit Care Med. 2004;170:1310-1316. [PubMed] |
| 9. | Taniguchi N, Kawahara K, Yone K, Hashiguchi T, Yamakuchi M, Goto M, Inoue K, Yamada S, Ijiri K, Matsunaga S. High mobility group box chromosomal protein 1 plays a role in the pathogenesis of rheumatoid arthritis as a novel cytokine. Arthritis Rheum. 2003;48:971-981. [PubMed] |
| 10. | Hatada T, Wada H, Nobori T, Okabayashi K, Maruyama K, Abe Y, Uemoto S, Yamada S, Maruyama I. Plasma concentrations and importance of High Mobility Group Box protein in the prognosis of organ failure in patients with disseminated intravascular coagulation. Thromb Haemost. 2005;94:975-979. [PubMed] |
| 11. | Yang H, Wang H, Czura CJ, Tracey KJ. HMGB1 as a cytokine and therapeutic target. J Endotoxin Res. 2002;8:469-472. [PubMed] |
| 12. | 杨 智勇, 王 春友, 熊 炯炘, 陶 京, 许 逸卿, 刘 涛. 重症急性胰腺炎大鼠血清高迁移率族蛋白-1水平的时相变化及意义. 华中科技大学学报(医学版). 2004;33:466-468. |
| 13. | Yasuda T, Ueda T, Takeyama Y, Shinzeki M, Sawa H, Nakajima T, Ajiki T, Fujino Y, Suzuki Y, Kuroda Y. Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis. Pancreas. 2006;33:359-363. [PubMed] |
| 14. | Sawa H, Ueda T, Takeyama Y, Yasuda T, Shinzeki M, Nakajima T, Kuroda Y. Blockade of high mobility group box-1 protein attenuates experimental severe acute pancreatitis. World J Gastroenterol. 2006;12:7666-7670. [PubMed] |
| 15. | Sims CA, Wattanasirichaigoon S, Menconi MJ, Ajami AM, Fink MP. Ringer's ethyl pyruvate solution ameliorates ischemia/reperfusion-induced intestinal mucosal injury in rats. Crit Care Med. 2001;29:1513-1518. [PubMed] |
| 16. | Tawadrous ZS, Delude RL, Fink MP. Resuscitation from hemorrhagic shock with Ringer's ethyl pyruvate solution improves survival and ameliorates intestinal mucosal hyperpermeability in rats. Shock. 2002;17:473-437. [PubMed] |
| 17. | Yang R, Gallo DJ, Baust JJ, Uchiyama T, Watkins SK, Delude RL, Fink MP. Ethyl pyruvate modulates inflammatory gene expression in mice subjected to hemorrhagic shock. Am J Physiol Gastrointest Liver Physiol. 2002;283:G212-221. [PubMed] |
| 18. | Ulloa L, Ochani M, Yang H, Tanovic M, Halperin D, Yang R, Czura CJ, Fink MP, Tracey KJ. Ethyl pyruvate prevents lethality in mice with established lethal sepsis and systemic inflammation. Proc Natl Acad Sci U S A. 2002;99:12351-12356. [PubMed] |
| 19. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] |
| 20. | Gloor B, Blinman TA, Rigberg DA, Todd KE, Lane JS, Hines OJ, Reber HA. Kupffer cell blockade reduces hepatic and systemic cytokine levels and lung injury in hemorrhagic pancreatitis in rats. Pancreas. 2000;21:414-420. [PubMed] |
| 21. | Wang H, Yang H, Tracey KJ. Extracellular role of HMGB1 in inflammation and sepsis. J Intern Med. 2004;255:320-331. [PubMed] |
| 22. | Qin S, Wang H, Yuan R, Li H, Ochani M, Ochani K, Rosas-Ballina M, Czura CJ, Huston JM, Miller E. Role of HMGB1 in apoptosis-mediated sepsis lethality. J Exp Med. 2006;203:1637-1642. [PubMed] |
| 23. | Angus DC, Yang L, Kong L, Kellum JA, Delude RL, Tracey KJ, Weissfeld L. Circulating high-mobility group box 1 (HMGB1) concentrations are elevated in both uncomplicated pneumonia and pneumonia with severe sepsis. Crit Care Med. 2007;35:1061-1067. [PubMed] |
| 24. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] |
| 25. | Park JS, Arcaroli J, Yum HK, Yang H, Wang H, Yang KY, Choe KH, Strassheim D, Pitts TM, Tracey KJ. Activation of gene expression in human neutrophils by high mobility group box 1 protein. Am J Physiol Cell Physiol. 2003;284:C870-879. [PubMed] |
| 26. | Treutiger CJ, Mullins GE, Johansson AS, Rouhiainen A, Rauvala HM, Erlandsson-Harris H, Andersson U, Yang H, Tracey KJ, Andersson J. High mobility group 1 B-box mediates activation of human endothelium. J Intern Med. 2003;254:375-385. [PubMed] |