修回日期: 2007-08-19
接受日期: 2007-08-28
在线出版日期: 2007-08-28
目的: 绿色荧光蛋白(EGFP-N1)标记树突状细胞, 示踪树突状细胞的生长并研究EGFP-N1对其表型表达的影响.
方法: 将EGFP-N1质粒转化入感受态菌DH5α中扩增, 经BamHⅠ酶切鉴定后大量扩增, 再提取并纯化质粒将其转染入树突状细胞, 通过荧光显微镜和示踪转染前后树突状细胞的生长及表型表达的变化.
结果: 采用该方法可以获得纯度高的绿色荧光蛋白质粒, 经过培养得到了形态典型的树突状细胞. 质粒绿色荧光蛋白能够在人树突状细胞中长期稳定表达, 转染后细胞表面标志CD80(81.90±2.44 vs 74.52±1.40), CD86(81.49±3.24 vs 78.61±1.64), CD1a(37.42±3.25 vs 18.56±2.36)的表达量明显高于未转染细胞(均P<0.05). 但是转染后细胞活性低于未转染细胞活性(67.41±3.17 vs 95.10±2.20, P<0.05).
结论: 绿色荧光蛋白能够示踪树突状细胞的生长及变化过程, 为进一步研究肿瘤复发转移及治疗提供了一种简便的新方法.
引文著录: 张倩倩, 李春伶, 王运平, 李锦毅. 树突状细胞转染绿色荧光蛋白基因后生长特性和表型的变化. 世界华人消化杂志 2007; 15(24): 2607-2612
Revised: August 19, 2007
Accepted: August 28, 2007
Published online: August 28, 2007
AIM: To trace plasmid EGFP-N1 marking of dendritic cells (DCs), and to follow growth and phenotypic expression.
METHODS: Plasmid EGFP-N1 was transformed into competent bacteria DH5α. Bacteria were then amplified and cut by enzyme BamH1, and finally a plasmid containing EGFP-N1 was successfully constructed. After finishing transfection with pure plasmid EGFP-N1 into DCs, the difference in phenotypic expression of these cells was observed by fluorescence microscopy and flow cytometry.
RESULTS: Pure EGFP-N1 plasmid was successfully obtained. The cultured DCs had typical morphology and green fluorescent protein was effectively expressed in DCs. The DC surface markers such as CD80 (81.90 ± 2.44 vs 74.52 ± 1.40), CD86 (81.49 ± 3.24 vs 78.61 ± 1.64), and CD1a (37.42 ± 3.25 vs 18.56 ± 2.36) in the experimental group were respectively higher than those in the control group (all P < 0.05). However DC viability in the experimental group was lower than that in the control group (67.41 ± 3.17 vs 95.10 ± 2.20, P < 0.05).
CONCLUSION: Green fluorescent protein is an effective approach for investigating DC growth, representing a new method to study metachrosis and tumor therapy because of its tracing ability.
- Citation: Zhang QQ, Li CL, Wang YP, Li JY. Changes of dendritic cell characteristics and phenotypes after green fluorescent protein tracing. Shijie Huaren Xiaohua Zazhi 2007; 15(24): 2607-2612
- URL: https://www.wjgnet.com/1009-3079/full/v15/i24/2607.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i24.2607
树突状细胞(dendritic cell, DC)是目前发现的功能最强大的抗原递呈细胞(antigen presenting cells, APC), 具有强大的T细胞激活能力, 能活化初始T细胞, 刺激B细胞增殖成熟, 刺激Th细胞及NK细胞活化, 并且高表达共刺激因子, 是肿瘤免疫治疗的理想细胞之一[1-2]. 他能够提高机体免疫组织的抗肿瘤效应, 被称为免疫治疗的天然佐剂[3]. 但DC在体内的形成、成熟情况、诱导后能否在体内存活, 特别是在肿瘤患者体内的杀伤作用等方面还缺乏检测手段, 这些问题目前尚不能解决[4]. 绿色荧光蛋白(green fluorescent protein, GFP)在一定波长激发下, 不需外源物质的参与便可发出可见的绿色荧光, 且对细胞无毒性, 可以直接观测外源基因在活体中的表达[5]. GFP已成为细胞生物学和分子生物学中广泛应用的报告基因. GFP转染细胞后, 可以稳定而长时间持续表达, 在荧光显微镜下发出绿色荧光, 直接示踪体内DC的转归, 为检测肿瘤细胞的生长与转移提供了一种简便可行的新方法[6].
RPMI 1640培养基(Gibco公司), 淋巴细胞分离液(天津Tbd公司), rhGM-CSF, rhIL-4; PE标记鼠抗人CD80、CD86、CD1a、IgG mAb (Sigma公司), EGFP-N1质粒(军事医学科学院基础研究所惠赠), 人胃癌细胞SGC7901细胞系(北京大学临床肿瘤学院基础所惠赠), 大肠杆菌DH5α(本研究室保存), 质粒提取试剂盒(金螺生物公司), 转染试剂(Tiangen公司).
1.2.1 EGFP-N1质粒的转化、扩增及提取: 将EGFP-N1质粒转化入感受态菌DH5α中, 培养扩增后提取质粒DNA. 质粒DNA经BamHⅠ酶切, 电泳鉴定. 大量扩增后提取并纯化质粒, 微孔滤膜过滤, 用紫外分光光度计测浓度, 用于树突状细胞的转染.
1.2.2 抗原制备: 取对数生长期的SGC7901细胞, 调整浓度为5×109 个/L, 移入EP管中, 放入-80℃冰箱3 min, 取出放入37℃的水浴箱中3 min, 如此反复4次, 400 g离心10 min, 取上清用0.22 μm微孔滤器过滤, 43℃保存备用.
1.2.3 DC的诱导培养和EGFP-N1质粒转染: 无菌条件下用淋巴细胞分离液(ficoll-hypaque)密度梯度离心, 分离浓缩白细胞中的单核细胞(PBMC), 离心20 min, 取白膜层即为PBMC, 用150 mL/L胎牛血清的RPMI 1640培养基培养2 h, 除去未贴壁细胞(多数为T淋巴细胞), 将获得到的DC前体细胞, 加细胞因子诱导分化, 终浓度为rhGM-CSF 100 μg/L, rhIL-4 50 μg/L. 24 h后, 吸弃上1/3培养液, 补全培养液及细胞因子[7-8]. 培养6 d后的树突状细胞分组为: 未转染组, 不做特殊处理; 抗原刺激组, 按细胞数1:1加肿瘤抗原后培养1 d; pEGFP-N1转染组, 按质粒转染说明书将EGFP-N1质粒转染细胞后培养1 d. 倒置显微镜观察细胞生长状况. 培养6 d的DC用HE染色观察. 转染后的DC用荧光倒置显微镜观察.
1.2.4 流式细胞仪检测DC表型: 各组DC分别用PBS洗涤后重悬, 调整细胞密度为1×109 个/L, 分别装入4个EP管中, 每管200 μL, 然后分别加入PE标记的鼠抗人mAb CD80, CD86, CD1a及阴性对照抗体IgG, 室温孵育15 min, 再用PBS洗涤1遍后加PBS 1 mL稀释, 上机检测细胞表型表达情况.
1.2.5 苔盼蓝计活力: 取0.2 mL细胞悬液, 加等量4 g/L苔盼蓝溶液, 充分混匀, 取上述细胞悬液10 μL加到细胞计数板上, 用低倍镜数200个细胞, 计数蓝染的细胞. 结果示正常细胞不着色, 被染成蓝色的为死细胞. 细胞活力(%) = (总细胞数-着色细胞数)/总细胞数×100%.
统计学处理 采用SPSS11.5统计软件, 结果用mean±SD表示.
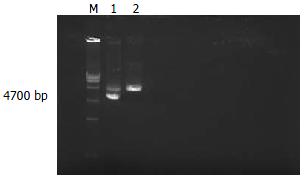
质粒用BamHⅠ酶切电泳后在4700 bp处可见清晰的基因片断条带(图1), 证实质粒EGFP-N1的存在.
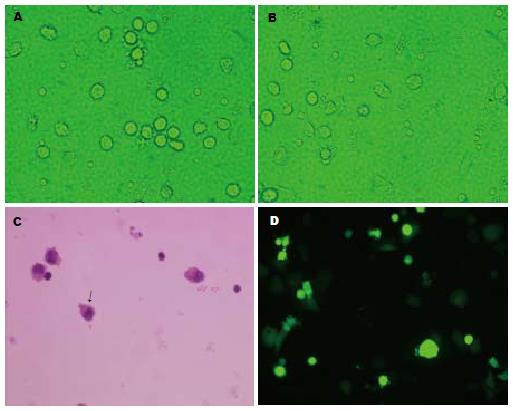
倒置显微镜下可见从浓缩白细胞中分离得到的单核细胞数量多, 呈圆形, 体积小, 悬浮生长. 贴壁筛选后的DC前体细胞为圆形, 体积大, 贴壁生长. 细胞因子诱导后, 细胞体积逐渐增大, 呈细胞集落样生长, 数量增多, 3 d后细胞表面伸出少量毛刺样突起, 此后细胞呈梭形、逗点形等不规则的形状(图2A). 到6 d时, 细胞从集落上脱落, 分布均匀地悬浮生长, 大小不等, 形态极不规则, 有的表面布满毛刺样突起, 有的突起细而长, 形似树枝状, 呈典型的DC形态(图2B). HE染色显示DC胞质染成红色, 核呈蓝色, 刺突仍可见, 周围小体积细胞为T淋巴细胞(图2C). 转染后荧光显微镜下可见绿色的树突状细胞, 数量少, 细胞周围刺突不明显(图2D).
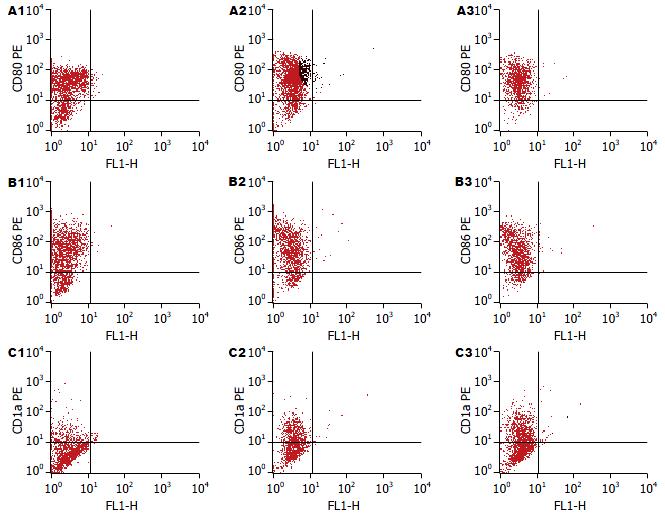
DC表型的流式细胞仪分析结果(图3), 统计分析结果表明肿瘤抗原和EGFP能促使DC成熟, 但EGFP的免疫源性弱于肿瘤抗原(表1).
见表1, 转染组细胞活力与未转染组比较有统计学意义(P<0.05), 与抗原刺激组比较也有统计学意义(P<0.05).
近年来, 树突状细胞的研究取得了很大的进展, 并在肿瘤临床治疗上得到了广泛的应用. 成熟的树突状细胞依赖细胞表面的共刺激因子、黏附分子及MHC类分子等可以诱导特异性CD4+、CD8+ T淋巴细胞活化, 进而杀伤肿瘤细胞, 因此DC在肿瘤临床治疗中的地位和作用就显得非常重要[9-10]. 体外诱导培养的DC能否在体内长期存活? 细胞到底发挥了多大的杀伤效应? 回输的DC在体内作用过程如何? 这些问题一直缺乏直接证据. 寻找一种稳定直观而又不影响细胞功能的标记方法, 是解决这些问题的关键所在.
最近一些研究进一步表明[11-12], 肿瘤患者的DC缺陷不仅发生在肿瘤局部, 而是发生在全身. 早期肿瘤患者外周血中DC的数量比正常人减少一半以上, 晚期相差更甚. 因此, 用G-CSF刺激因子刺激骨髓产生多量的DC前体细胞后再从外周血中分离诱导DC, 从而获得足量的DC[13]. 目前常用的方法是用密度梯度离心法从患者外周血中分离单核细胞, 经短暂培养后选取贴壁细胞在GM-CSF和IL-4作用下培养诱导成DC, 经抗原负载后促使DC成熟[2,14-16]. 此种方法每100 mL外周血一般可得到2×107 个DC. 本实验在改良传统方法的基础上, 制备出了形态典型、高表达表面标志的DC, 达到了临床要求的数量级.
GFP来源于海洋生物水母, 在蓝光或紫光下可发出荧光, 其突变体-EGFP发射的荧光强度比GFP强6倍以上, 无细胞毒性, 可对细胞进行长效标记. 作为报告基因, EGFP在研究基因表达, 细胞分化及蛋白在生物体内定位和转运方面作用显著[17-20]. 本实验利用EGFP的这些特点, 将其DNA片断转化入大肠杆菌, 进行质粒扩增, 克隆出足量的目的DNA片断, 经酶切鉴定证实得到EGFP-N1质粒. 由于绿色荧光蛋白的表达可直接通过荧光显微镜观测, 且其对树突状细胞表型表达和抗肿瘤功能无不良影响, 适合临床研究的展开, 用于监测细胞在体内的分布、分化情况, 分析细胞在组织中的含量及基因和蛋白的表达变化等[21].
质粒转染的方式有病毒载体法和非病毒载体法, 虽然病毒载体的转染率高, 但考虑到病毒载体能在机体内复制且其免疫原性强等安全因素, 目前多采用脂质体等非病毒载体体外转染哺乳动物细胞. GFP质粒脂质体介导转染标记细胞的方式较病毒载体和转基因等方式更有操作方便等优点. 但脂质体有一定的细胞毒性, 本试验中转染组细胞活力明显降低也证实了这点, 并且由于分化后的DC是悬浮生长细胞, 这使得转染难度增加, 转染率很难提高. 因此, 从DC疫苗应用方面考虑, 需探索更有利的转染媒介. 近来有人采用葡聚糖磁性纳米颗粒作为载体连接绿色荧光蛋白pEGFP-C1报告基因在体内转染DC[22], 此实验证明, 在细胞毒性方面葡聚糖磁性纳米颗粒较脂质体而言, 有一定的优势.
机体中的DC存有3种不同的分化状态, 即DC前体细胞、未成熟DC和成熟DC. 成熟DC能刺激初始T细胞成为细胞毒性T淋巴细胞, 是最有效的刺激2次T细胞反应的细胞[23]. 成熟DC的特征包括MHC-Ⅱ类分子表达的明显增高, 共刺激分子的高表达(如CD54、CD80、CD86、CD83等), 以及IL-12等细胞因子的分泌; 同时吞噬功能(如胞吞、胞饮、吞噬等)明显下调; DC成熟后对炎性刺激分子的反应能力减弱, 而对趋化因子的反应增强. 本实验中转染后的细胞形态较未转染细胞形态无明显变化, 但在pEGFP-N1导入DC后, 其成熟标志CD80(81.90±2.44), CD86(81.49±3.24)和CD1a(37.42±3.25)与未转染细胞相比有明显的统计学差异, 该结果提示EGFP-N1质粒作为外源基因增强了DC的成熟度, 使其抗原呈递能力得到了促进, 具有更强的激活T淋巴细胞增殖的能力. 这与Re et al[24]的研究中, GFP-肿瘤抗原负载和转染后的DC在加强肿瘤特异性T细胞表达方面均强于单纯抗原刺激的DC相符. 由于GFP的促DC成熟能力, 使用绿色荧光蛋白标记的DC在研究抗原提呈加工的过程及DC迁移成熟发展过程的同时, 提高了DC的作用效能. GFP是1种理想的示踪标志物, 有良好的应用前景.
另外, 肿瘤抗原的选择对能否诱导肿瘤免疫反应十分重要[25-27], 本实验的阳性对照选用了胃癌细胞SGC7901的冻融抗原, 优点在于此种抗原包含了多种表位肽甚或是整个肿瘤的抗原库, 能使机体的MHC类分子从抗原的氨基酸序列中自行选择相匹配的表位肽, 从而启动针对多种肿瘤抗原的免疫反应, 是目前应用较广的方法之一.
树突状细胞是目前发现的功能最强大的抗原递呈细胞, 是肿瘤免疫治疗的理想细胞之一. 他能够提高 机体免疫组织的抗肿瘤效应, 被称为免疫治疗的天然佐剂. 但DC在体内的形成、成熟情况、诱导后能否在体内存活, 特别是在肿瘤患者体内的杀伤作用等方面还缺乏检测手段. 绿色荧光蛋白在一定波长激发下, 不需外源物质的参与便可发出可见的绿色荧光, 可以直接观测外源基因在活体中的表达. 为检测肿瘤细胞的生长与转移提供了1种简便可行的新方法.
目前研究的热点和重点仍集中在多效肿瘤疫苗的研发及其在体内免疫效力的监测等方面. 亟待研究的问题主要是如何使输注的效应细胞特异性地到达靶部位及如何使其穿越肿瘤细胞周围的重重屏障而保证数量、功效不衰减等问题.
Dauer et al2003年报道, 用与常规方法同样的细胞因子组合培养外周血CD14+细胞48 h便可成功获得成熟DC, 称fastDC,并且此种方法所获得DC与常规培养所得的DC具有同样的形态学特点, 其表达的免疫表型分子的百分率相似. 亦能诱导抗原特异性T细胞反应, 刺激IFN-γ产生及活化自身初始型T细胞.
DC在体内的形成、成熟及诱导后能否在体内存活, 特别是在肿瘤患者体内的杀伤作用等方面还缺乏检测手段, 这些问题目前尚不能解决. 绿色荧光蛋白在一定波长激发下, 不需外源物质的参与便可发出可见的绿色荧光, 且对细胞无毒性, 可以直接观测外源基因在活体中的表达. 本文将GFP转染细胞后,可以稳定而长时间的持续表达, 在荧光显微镜下发出绿色荧光, 直接示踪体内DC的转归, 为检测肿瘤细胞的生长与转移提供了1种简便可行的新方法.
绿色荧光蛋白的表达可直接通过荧光显微镜观测, 且其对树突状细胞表型表达和抗肿瘤功能无不良影响, 适合临床研究的展开, 用于监测细胞在体内的分布、分化情况, 分析细胞在组织中的含量及基因和蛋白的表达变化等.
脂质体转染法:是Felgner et al于1987年首次报道的1种基因转移方法, 多用于转染真核细胞. 其优点是: 转化效率较 高, 细胞毒性低, 所需的细胞数少于电穿孔法; 转染细胞类型广泛, 几乎可转染己试用的所有类型细胞和细胞系; 操作十分简便易行. 影响阳离子脂质体转染成功的主要因素是: 脂质体浓度、DNA浓度和脂质体复合物的孵育时间.
本文探讨了绿色荧光蛋白基因转染树突状细胞的方法和绿色荧光蛋白基因转染后染树突状细胞的生长和表型变化, 设计合理, 采用的方法较得当, 图片较清晰, 内容较丰富, 得出的结论对同行有一定的参考意义.
编辑: 何燕 电编:何基才
| 1. | Walter T, Lee MD, Keiji Shimizu MD, Hide Kuriyama MD, Hiro Tanaka MD, Jorgen Kjaergaard PhD and Suyu Shu PhD. Tumor-dendritic cell fusion as a basis for cancer immunotherapy. Otolaryngology-Head and Neck Surgery. 2005;132:755-764. |
| 2. | Cai YG, Fang DC, Chen L, Tang XD, Chen T, Yu ST, Luo YH, Xiong Z, Wang DX, Yang SM. Dendritic Cells Reconstituted with a Human Heparanase Gene Induce Potent Cytotoxic T-Cell Responses against Gastric Tumor Cells in vitro. Tumour Biol. 2007;28:238-246. [PubMed] |
| 3. | Keto GB, West SE, Steiger S, Beck HP, Weiss N, Hynes NE. A DNA delivery system targeting dendritic cells for use in immunization against malaria: a rodent model. Tanzan Health Res Bull. 2005;7:142-148. [PubMed] |
| 4. | Manickam A, Sivanandham M, Tourkova IL. Immunological role of dendritic cells in cervical cancer. Adv Exp Med Biol. 2007;601:155-162. [PubMed] |
| 5. | Chen X, Wu R, Feng S, Gu B, Dai L, Zhang M, Zhao X. Single cell derived murine embryonic stem cell clones stably express Rex1-specific green fluorescent protein and their differentiation study. Biochem Biophys Res Commun. 2007;. [PubMed] |
| 6. | Zhong F, Zhong ZY, Liang S, Li XJ. Transfection of GFP mRNA in dendritic cells and analysis of some factors involved. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2006;22:716-719. [PubMed] |
| 7. | Mu LJ, Kyte JA, Kvalheim G, Aamdal S, Dueland S, Hauser M, Hammerstad H, Waehre H, Raabe N, Gaudernack G. Immunotherapy with allotumour mRNA-transfected dendritic cells in androgen-resistant prostate cancer patients. Br J Cancer. 2005;93:749-756. [PubMed] |
| 8. | Jarnjak-Jankovic S, Hammerstad H, Saeboe-Larssen S, Kvalheim G, Gaudernack G. A full scale comparative study of methods for generation of functional Dendritic cells for use as cancer vaccines. BMC Cancer. 2007;7:119. [PubMed] |
| 9. | Donaghy H, Stebbing J, Patterson S. Antigen presentation and the role of dendritic cells in HIV. Curr Opin Infect Dis. 2004;17:1-6. [PubMed] |
| 10. | Homma S, Matai K, Irie M, Ohno T, Kufe D, Toda G. Immunotherapy using fusions of autologous dendritic cells and tumor cells showed effective clinical response in a patient with advanced gastric carcinoma. J Gastroenterol. 2003;38:989-994. [PubMed] |
| 11. | Yilmaz T, Gedikoglu G, Celik A, Onerci M, Turan E. Prognostic significance of Langerhans cell infiltration in cancer of the larynx. Otolaryngol Head Neck Surg. 2005;132:309-316. [PubMed] |
| 12. | Nakayama Y, Inoue Y, Minagawa N, Katsuki T, Nagashima N, Onitsuka K, Tsurudome Y, Sako T, Hirata K, Nagata N. Relationships between S-100 protein-positive cells and clinicopathological factors in patients with colorectal cancer. Anticancer Res. 2003;23:4423-4426. [PubMed] |
| 14. | Jiang S, Tsang J, Game DS, Stevenson S, Lombardi G, Lechler RI. Generation and expansion of human CD4+ CD25+ regulatory T cells with indirect allospecificity: Potential reagents to promote donor-specific transplantation tolerance. Transplantation. 2006;82:1738-1743. [PubMed] |
| 15. | Kurlander RJ, Tawab A, Fan Y, Carter CS, Read EJ. A functional comparison of mature human dendritic cells prepared in fluorinated ethylene-propylene bags or polystyrene flasks. Transfusion. 2006;46:1494-1504. [PubMed] |
| 16. | Wijewardana V, Sugiura K, Oichi T, Fujimoto M, Akazawa T, Hatoya S, Inaba M, Ikehara S, Jayaweera TS, Inaba T. Generation of canine dendritic cells from peripheral blood monocytes without using purified cytokines. Vet Immunol Immunopathol. 2006;114:37-48. [PubMed] |
| 17. | Hanawa H, Hematti P, Keyvanfar K, Metzger ME, Krouse A, Donahue RE, Kepes S, Gray J, Dunbar CE, Persons DA. Efficient gene transfer into rhesus repopulating hematopoietic stem cells using a simian immunodeficiency virus-based lentiviral vector system. Blood. 2004;103:4062-4069. [PubMed] |
| 18. | Chen X, Wu R, Feng S, Gu B, Dai L, Zhang M, Zhao X. Single cell derived murine embryonic stem cell clones stably express Rex1-specific green fluorescent protein and their differentiation study. Biochem Biophys Res Commun. 2007;. [PubMed] |
| 19. | Zhong F, Zhong ZY, Liang S, Li XJ. Transfection of GFP mRNA in dendritic cells and analysis of some factors involved. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2006;22:716-719. [PubMed] |
| 20. | Lin Y, Luo E, Chen X, Liu L, Qiao J, Yan Z, Li Z, Tang W, Zheng X, Tian W. Molecular and cellular characterization during chondrogenic differentiation of adipose tissue-derived stromal cells in vitro and cartilage formation in vivo. J Cell Mol Med. 2005;9:929-939. [PubMed] |
| 21. | Malecaze F, Couderc B, de Neuville S, Serres B, Mallet J, Douin-Echinard V, Manenti S, Revah F, Darbon JM. Adenovirus-mediated suicide gene transduction: feasibility in lens epithelium and in prevention of posterior capsule opacification in rabbits. Hum Gene Ther. 1999;10:2365-2372. [PubMed] |
| 23. | Walter Lee MD, presenter, Kenji Shimizu, Hide Kuriyama MD, Hiro Tanaka MD, Jorgen Kjaergaard PhD and Suyu Shu PhD. Tumor-dendritic cell fusion as a basis for cancer immunotherapy. Otolaryngology-Head and Neck Surgery. 2004;131:115-125. |
| 24. | Re F, Srinivasan R, Igarashi T, Marincola F, Childs R. Green fluorescent protein expression in dendritic cells enhances their immunogenicity and elicits specific cytotoxic T-cell responses in humans. Exp Hematol. 2004;32:210-217. [PubMed] |
| 25. | Evans TG, Yamamoto Y, Jeffery WR, Krone PH. Zebrafish Hsp70 is required for embryonic lens formation. Cell Stress Chaperones. 2005;10:66-78. [PubMed] |
| 26. | Mazzolini G, Alfaro C, Sangro B, Feijoó E, Ruiz J, Benito A, Tirapu I, Arina A, Sola J, Herraiz M. Intratumoral injection of dendritic cells engineered to secrete interleukin-12 by recombinant adenovirus in patients with metastatic gastrointestinal carcinomas. J Clin Oncol. 2005;23:999-1010. [PubMed] |