修回日期: 2007-08-10
接受日期: 2007-08-28
在线出版日期: 2007-08-28
目的: 观察启膈散及其活血和化痰两个拆方对人食管癌细胞株Eca109细胞磷脂酶C-γ1(PLC-γ1)介导的细胞信号转导的影响, 以研究启膈散治疗食管癌的作用机制.
方法: 用启膈散(W)及其活血(P)和化痰(R)两个拆方的水提物处理体外培养的人食管癌细胞株Eca109细胞, 测定细胞PLC-γ1、表皮生长因子受体(EGFR)和PKCα蛋白表达水平、蛋白酪氨酸磷酸化(PY99)水平和豆蔻酰化富丙氨酸C激酶底物(MARCKS)(Ser152/156)磷酸化水平、细胞内游离钙离子[Ca2+]i浓度及蛋白激酶C(PKC)活性.
结果: 1 mg/L的启膈散及其拆方明显抑制Eca109细胞PLCγ1蛋白表达(0.31%, 0.42%, 0.20%), 随着药物浓度增加其抑制作用分别增强, 启膈散及其拆方对体外培养的食管癌细胞PLC-γ1、EGFR和PKCα表达、PLC-γ1和EGFR酪氨酸磷酸化、MARCKS磷酸化、[Ca2+]i浓度(169.65±30.54 nmol/L, 145.84±24.12 nmol/L, 214.94±37.14 nmol/L vs 231.86±51.10 nmol/L, P>0.05, P<0.05, P>0.05)及PKC活性均有不同程度的抑制作用, 以P组作用最强.
结论: 启膈散及其拆方通过不同程度的抑制食管癌细胞PLC-γ1介导的信号转导而抑制肿瘤细胞的生长.
引文著录: 司富春, 陈玉龙. 启膈散及其拆方对食管癌细胞Eca109 PLC-γ1介导的细胞信号转导的影响. 世界华人消化杂志 2007; 15(24): 2583-2588
Revised: August 10, 2007
Accepted: August 28, 2007
Published online: August 28, 2007
AIM: To study the effects and mechanism of action of qigesan and its constituents on the human esophageal carcinoma cell line Eca 109 in vitro.
METHODS: The human esophageal carcinoma cell line Eca 109 was cultured and treated with different concentrations of qigesan as a whole (W group), water extracts of the constituents of qigesan that promote blood circulation (P group), and other water extracts of the constituents of qigesan that help prevent stasis (R group). Protein expression of phospholipase C (PLC)-γ1, epidermal growth factor receptor (EGFR) and protein kinase C (PKC)α, protein tyrosine phosphorylation level (PY99), intracellular calcium concentration ([Ca2+]i), and PKC activity were measured.
RESULTS: The protein expression levels of PLC-γ1, EGFR and PKCα, EGFR and PLC-γ1 tyrosine phosphorylation level, [Ca2+]i (169.65 ± 30.54 nmol/L, 145.84 ± 24.12 nmol/L, 214.94 ± 37.14 nmol/L vs 231.86 ± 51.10 nmol/L; P > 0.05, P < 0.05, P > 0.05) and PKC activity in the cultured esophageal cancer cells were inhibited by qigesan and its individual constituents at different concentrations. The greatest effects were seen in group P.
CONCLUSION: Qigesan and its individual constituents inhibit esophageal carcinoma cell growth by inhibiting PLC-γ1-mediated signal transduction.
- Citation: Si FC, Chen YL. Effects of qigesan and its constituents on phospholipase-C-γ1-mediated signaling in esophageal carcinoma cell line Eca109. Shijie Huaren Xiaohua Zazhi 2007; 15(24): 2583-2588
- URL: https://www.wjgnet.com/1009-3079/full/v15/i24/2583.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i24.2583
多种生长因子及其受体参与了食管癌的发生发展, 其中表皮生长因子受体(EGFR)在食管癌细胞中高度表达, 表达及活性的强度与食管癌的恶性程度、耐药性及发展和预后相关[1-2]. 磷脂酶C-γ1(phospholipase C-γ1, PLC-γ1)是多种细胞生长因子信号传导的细胞内效应分子, 在细胞信号转导中起关键作用. PLC-γ1水解磷脂酰肌醇-4, 5-二磷酸(PIP2)产生第二信使三磷酸肌醇(IP3)和甘油三酯(DAG), IP3能引起细胞内钙库的释放, DAG能激活蛋白激酶C(PKC), 通过这2条通路和其他未知通路从而激活多种细胞反应. PLC-γ1在肿瘤发生和发展中起关键作用, 其超量表达和激活引起肿瘤发生、浸润和转移[3-5]. 我们研究发现, 食管癌组织内PLC-γ1超量表达, 说明EGFR-PLC-γ1介导的信号通路在食管癌发生发展中起着很重要的作用. 启膈散及其拆方对食管癌细胞Eca109生长具有不同程度的抑制作用, 为了进一步研究其作用的机制, 我们观察了启膈散及其拆方对食管癌细胞Eca109 PLC-γ1介导的细胞信号转导的影响.
丹参、郁金、砂仁壳、沙参、贝母、茯苓购于河南中医学院第三附属医院. 分为全方组(W)、活血组(P)(丹参、郁金、砂仁壳)、化痰组(R)(沙参、贝母、茯苓), 每味药各10 g, 煎煮、浓缩、5000 g离心, 0.22 μm过滤, 取部分干燥称重, 置4℃冰箱备用. 人食管癌细胞株Eca109来自郑州大学医学院组胚教研室. DMEM高糖培养基(Gibco公司), 胎牛血清(Hyclone公司), PMSF与Leupeptin(Amresco公司), 丙烯酰胺(Biomol公司), 胰蛋白酶与山羊抗小鼠IgG-HRP(华美公司), ECL试剂盒(Santa Cruz公司), PLC-γ1 mAb(韩国浦项科技大学国家信号传导网络实验室惠赠), EGFR mAb(Santa Cruz公司), PKCa多克隆抗体(Santa Cruz公司), Fura-2/AM(Sigma公司), 抗磷酸化酪氨酸mAb PY99(Santa Cruz公司), 抗磷酸化MARCKS(Ser152/156)多克隆抗体(Cell signal公司), 考马斯亮蓝G250(Amresco公司). Heraeus细胞培养箱(德国Kendro公司); 倒置显微镜(Zeiss公司), 紫外分光光度计(Thermo公司), SG-603生物安全柜(Bake公司), ELx800型酶标仪(Bio-Tek公司), 蛋白电泳系统(Bio-Rad公司), 荧光分光光度计(Shimadzu公司), 液体闪烁仪(Packard公司), 1470γ-计数器(Perkin Elmer公司), 低温台式离心机(Sigma公司). 细胞生长于含100 mL/L胎牛血清的DMEM培养液中, 置于37℃, 50 mL/L CO2培养箱, 每间隔48 h更换1次培养基, 待细胞生长至70%汇合率时, 用胰蛋白酶溶液[D-Hans液配制, 含2.5 g/L胰蛋白酶, 0.2 g/L乙二胺四乙酸二钠(EDTA), pH8.3]消化, 按实验要求接种于96孔培养板中或Φ100培养皿中.
1.2.1 ELISA法测定细胞PLC-γ1蛋白表达抑制率: 对数生长期的贴壁肿瘤细胞, 胰酶消化后, 调至1×108 个/L的细胞悬液, 接种在96孔培养板中, 每孔200 μL, 37℃, 50 mL/L CO2, 培养24 h, 分别加入W, R和P, 浓度分为1, 10, 20, 50, 100, 200, 400和800 mg/L 8个梯度, 每组3个复孔, 继续培养8 h, 每孔用40 g/L的中性甲醛125 μL固定15 min; 双蒸水洗涤3次, 加入20 g/L BSA 250 μL, 37℃温育1 h; 双蒸水洗涤3次, 加入PLC-γ1抗体, 室温反应4 h; 双蒸水洗涤3次, 加入羊抗鼠抗体IgG-HRP, 室温反应2 h; 双蒸水洗涤5次, 每孔加入底物邻苯二胺(O-PhenPhenylenediamine, OPD, 2 g/L)50 μL, 室温20 min, 每孔加硫酸25 μL, 酶标仪上492 nm测定光密度值. 按下式计算药物对肿瘤细胞PLC-γ1抑制率. 肿瘤细胞PLC-γ1抑制率% = (1-实验组光密度值/对照组光密度值)×100%.
1.2.2 Western: blot检测肿瘤细胞PLC-γ1、EGFR和PKCα蛋白表达、蛋白酪氨酸磷酸化(PY99)水平和豆蔻酰化富丙氨酸C激酶底物(MARCKS)(Ser152/156)磷酸化水平 对数生长期的贴壁肿瘤细胞, 胰酶消化后, 调至1×108 个/L的细胞悬液, 接种10 mL在Φ100培养皿, 24 h后弃上清, 分别加入浓度为800 mg/L含W, R和P的培养基10 mL, 继续培养48 h, 收获细胞, 提取蛋白, 10 μg/孔上样, SDS-PAGE凝胶电泳, 转至硝酸纤维素膜, 封闭、洗涤30 min, 加入一抗反应4 h、洗涤30 min, 加入二抗反应2 h, 洗涤30 min, 用增强化学发光(ECL)试剂曝光、显影、定影、洗片[6], 重复3次.
1.2.3 Fura-2/AM荧光标记方法测定细胞内游离钙离子[Ca2+]i浓度: 细胞1×106 个种入皿中, 24 h后加药, Eca109细胞与含W, R和P培养基共同孵育36 h后用Hanks buffer洗2次, Trypsin消化, 离心(1000 g, 10 min)洗1次, 将细胞悬浮于1 mL Hepes缓冲的Hanks+BSA液中, 细胞计数后, 使终浓度为1×(109-1010)/L. 加入0.25 mmol/L Fura-2/AM 20 μL, 使Fura-2/AM浓度为5 μmol/L, 加入细胞悬液中, 37℃培养箱里温育0.5 h. 离心, 然后用Hepes缓冲的Hanks buffer洗涤1次. 使终浓度为2×109/L, 上机检测[7-8], 重复4次.
1.2.4 PKC活性测定: 收集药物处理24 h和对照组细胞(加药时细胞数为6.25×106 个), 冷生理盐水洗涤2次. 加入缓冲液A(150 mmol/L Tris-HCl, pH7.5, 50 mmol/L β-巯基乙醇, 1 mmol/L PMSF, 2 mmol/L EGTA和10 g/L TritonX-100), 将细胞在冰浴中匀浆, 4℃, 100 000 g离心1 h, 将离心所得各上清通过DEAE-Sepharose柱(3.5 cm×0.8 cm), 用平衡缓冲液(120 mmol/L Tris-HCl, 2 mmol/L DTT, 2 mmol/L EDTA, 2 mmol/L EGTA, 0.5 mmol/L PMSF)2 mL洗去杂蛋白, 然后用含0.3 mol/L NaCl的平衡缓冲液洗脱, 收集洗脱液用于测定PKC活性. 反应总体积100 μL, 含30 mmol/L Tris-HCl pH7.5, 5 mmol/L MgCl2, 0.4 mmol/L CaCl2, 0.2 mmol/L EGTA, 0.5 g/L histoneⅢs, 0.1 g/L磷酯酰丝氨酸, 0.1 mmol/L PMA, 部分纯化的酶蛋白10 μg, 最后加0.12 mmol/L[γ-32P]ATP(2×105 cpm)启动反应, 在30℃准确温育10 min后, 迅速加入冷250 mL/L三氯醋酸1 mL终止反应, 沉淀物转移到微孔滤膜上, 用50 mL/L三氯醋酸洗3次, 烘干滤膜, 加闪烁液, 测cpm值, 重复4次[8].
1.2.5 Bradford法测定蛋白浓度.
统计学处理: 计量资料应用统计软件SPSS 11.0进行单项方差分析.
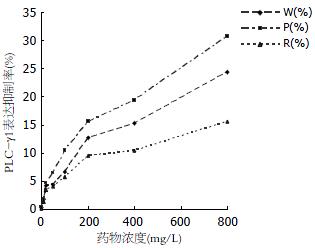
启膈散及其拆方明显抑制Eca109细胞PLCγ1蛋白表达, 随着药物浓度增加其抑制作用增强, 呈剂量-效应依赖关系, 其中以活血组最好, 全方组次之(表1, 图1).
| 浓度(mg/L) | W(%) | P(%) | R(%) |
| 1 | 0.3080 | 0.4217 | 0.2008 |
| 10 | 1.7485 | 1.8924 | 1.3174 |
| 20 | 4.1731 | 4.6275 | 3.5080 |
| 50 | 4.4350 | 6.5410 | 4.0413 |
| 100 | 6.6970 | 10.4546 | 5.7921 |
| 200 | 12.6667 | 15.6000 | 9.5991 |
| 400 | 15.3333 | 19.4363 | 10.4455 |
| 800 | 24.3271 | 30.7853 | 15.6598 |
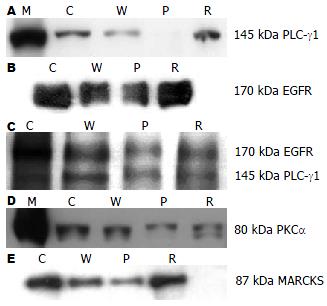
应用启膈散及其拆方处理的Eca109细胞PLC-γ1、EGFR和PKCα蛋白表达水平、PLC-γ1、EGFR和MARCKS磷酸化水平与对照组相比降低, 说明对PLC-γ1和EGFR表达及酪氨酸磷酸化、PKCα表达和PKC磷酸激酶活性具有一定的抑制作用, 其中P组最好, W组次之(图2A-E).
对照组细胞内游离钙离子[Ca2+]i浓度明显高于用药各组, 与活血组相比P<0.05(表2), 说明活血组药物具有明显降低细胞内游离钙离子[Ca2+]i浓度作用.
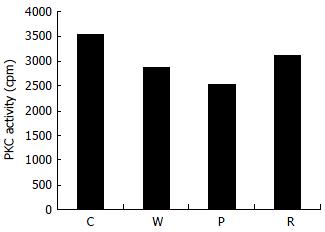
应用启膈散及其拆方处理的Eca109细胞PKC活性明显减弱, 表明启膈散及其拆方对PKC活性具有一定的抑制作用, 其中P组最好, W组次之(图3).
EGFR是原癌基因C-erbB1表达的产物, 为跨膜酪氨酸激酶受体, EGFR与配体结合后可导致受体形成同源二聚体, 也可与其他EGFR家族形成异源二聚体, 促使EGFR胞内区6个特异的受体酪氨酸残基磷酸化, 形成酪氨酸底物结合位点, 使EGFR激活, 再通过识别一系列底物酶将细胞外信号转导至胞内. EGFR主要通过Ras-MAPK、PI3K-Art/PKB、磷酯酶C-γ1-PKC介导的信号通路调节细胞的增殖和分化, 与细胞的再生和肿瘤的发生发展密切相关[2,9]. EGFR在食管癌中常常超量表达, 与食管癌的发生、发展和预后密切相关[1]. 我们以往研究发现, 启膈散及其活血和化痰两个拆方能够不同程度地抑制食管癌细胞株Eca109的生长, 其中P组作用最强, W组次之. 本研究显示食管癌细胞株Eca109表达EGFR, 用启膈散及其拆方干预细胞生长显示, W和P组可明显抑制细胞生长和EGFR表达, P组作用最强, W组作用较P组为次(图2B). 此结果表明, 启膈散及其拆方抑制细胞生长作用与EGFR介导的信号转导通路相关. 为了进一步研究启膈散及其拆方的作用机制, 我们对EGFR介导的PLCγ1-PKC通路相关蛋白分子进行了检测.
PLC分为β、γ、δ 3型, 每1型又分几种亚型, 如PLC-γ分PLC-γ1和PLC-γ2. PLC-γ1由2个SH2(src homology domain)、1个SH3、1个PH(pleckstrin homology domain)和2个催化区等结构域组成. PLC-γ1是以生长因子受体为中心的多级蛋白质复合物的一个重要成员, 其序列中几个酪氨酸能直接被生长因子受体酪氨酸激酶磷酸化而活化. PLC-γ1酶活化后, 催化PIP2分解成产物IP3和DAG作为第二信使物质在细胞内发生作用. IP3能引起细胞内钙库的释放, DAG能激活PKC. PLC-γ1和其他类型PLC同工酶不同, 不仅具有催化分解PIP2的脂酶的功能, 而且也具有作为接合器蛋白的作用. 即PLC-γ1除了由X和Y区构成的酶活性部位外, 还有作为蛋白质相互结合的SH区, 通过这些结构区域与其他信号传导分子的结合, 从而激活多种细胞反应. PLC-γ1在细胞增生性疾病和癌细胞中如上皮过度增生病、家族性肠息肉病、乳腺癌、结肠直肠癌、前列腺癌、卵巢癌等高度超量表达; 用微量注射法将PLC-γ1蛋白注入静止期的小鼠成纤维细胞NIH3T3中即迅速诱导DNA合成; 同样, 用转基因技术造成大鼠成纤维细胞株3Y1细胞超量表达PLC-γ1使该细胞株发生恶性转变, 将该细胞植入裸鼠体内很快形成肿瘤. 这些结果表明PLC-γ1在肿瘤发生和发展中起关键作用[10-13].
由表1和图1可以看出, 启膈散及其活血和化痰两个拆方均能抑制Eca109细胞PLC-γ1蛋白表达, 活血组作用最强, 全方组次之, 化痰组作用最弱, 随着药物浓度增加, 各组对PLC-γ1表达抑制作用呈剂量依赖关系, 其趋势与其对Eca109细胞生长的抑制作用一致. 从图2A也可以知道, 各组对Eca109细胞PLC-γ1表达的抑制作用强弱次序为: P组、W组、R组, 说明各用药组可能是通过下调细胞PLC-γ1表达从而通过其介导的信号转导通路发挥抑制细胞生长作用. 为了观察启膈散及其拆方对EGFR-PLC-γ1信号转导的影响, 我们用能识别EGFR和PLC-γ1酪氨酸磷酸化的抗磷酸化酪氨酸单克隆抗体PY99对蛋白酪氨酸磷酸化水平进行检测, 发现与对照组相比各用药组在EGFR和PLC-γ1分别对应的170 kDa和145 kDa处磷酸化条带减弱(图2C), 即活血组、全方组、化痰组有不同程度地抑制EGFR和PLC-γ1蛋白酪氨酸磷酸化作用, 说明活血组、全方组、化痰组还可以通过抑制EGFR和PLC-γ1的酪氨酸磷酸化降低其活性, 从而减弱EGFR-PLC-γ1信号转导.
细胞内游离钙离子[Ca=]i参与了细胞多种生物行为包括细胞的收缩、运动、生长、分化和分泌. 在外部刺激因子如EGF作用下, Ca2+离子从细胞内钙池内质网中释放出来或者细胞外的Ca2+离子从细胞膜钙离子通道进入, 从而升高[Ca2+]i, 这两种通路虽然不同, 但在同一刺激因子作用下可以协同作用. 从细胞内钙池释放Ca2+需要依赖于IP3与内质网膜上的InsP3Rs结合引起钙通道打开, 很快内质网内Ca2+又通过内质网膜上的Ca2+泵、Na-Ca离子交换器、胞质中钙结合蛋白等作用恢复平衡. 同时细胞膜上依赖于细胞内池Ca2+流的Ca2+通道打开, 引起持续小幅度[Ca2+]i升高. 细胞内的[Ca2+]i作为信号传导的第二信使, 通过Ca2+-CaM和激活PKC等通路引起细胞各种反应. 丝裂素原通过细胞内Ca2+流在细胞增殖中发挥关键作用, 如可抑制Ca2+流以引起细胞在G2/M停滞[14-15]. 在很多组织细胞如淋巴细胞、成纤维细胞、CEO细胞、内皮细胞的增殖依赖于持续的细胞内钙离子信号. 细胞生长因子也可以通过刺激细胞内[Ca2+]i升高而引起细胞增殖, PDGF引起的细胞内[Ca2+]i可以引起小鼠成纤维细胞增殖、FGF可以通过引起[Ca2+]i增高引起内皮细胞增殖等[16-17]. 当这些生长因子和受体结合后主要通过磷酸化激活细胞内效应蛋白如PLC-γ1、PI-3K等引起[Ca2+]i升高[14,18-19]. 本研究发现启膈散及其拆方可以降低Eca109细胞内[Ca2+]i, 其中活血组最强, 和对照组有显著差异(P<0.05), 全方组也可降低[Ca2+]i(均值明显低于对照组), 统计学虽没有意义, 但趋势明显, 可能因为样本少的缘故. 说明启膈散全方和活血方可以通过抑制PLC-γ1及其他效应蛋白引起的[Ca2+]i升高, 从而抑制细胞增殖.
蛋白激酶C(PKC)是PLC介导的细胞信号转导的重要环节, 他是丝氨酸和苏氨酸激酶, 具有多种亚型, PKCα是其中重要的一个. 当特异性配体和受体结合后PLC催化PIP2分解为钙离子动员物IP3和PKC激动剂DAG[3]. DAG促使PKC锚定于质膜, 增强了他对磷脂酰丝氨酸的亲和性, 同时Ca2+也可以增加PKC的C区与阴离子膜的亲和性促使PKC转位. 质膜与PKC的C1和C2区结合产生了足够的能量使PKC发生变构暴露出底物结合区. 研究发现PKCα而不是PKCβ依赖PLC活性. 活化后的PKCα可由胞质中向胞膜转移, 再磷酸化多种底物, 通过raf-MAPK-AP1, bcl-2、p27和RhoA等通路, 发挥其调节细胞生长、分化、细胞周期调控、迁移、基因表达多种功能[20-21]. MARCKS 是PKC的重要底物, 分布于各种细胞中, 参与细胞运动、有丝分裂、膜运输等细胞活动[22], MARCKS停留于细胞膜, 依赖于PKC对其磷酸化往来于膜质之间[23-24], 及调节其与钙调蛋白结合活性和与丝状肌动蛋白交联活性[25], 而其他磷酸激酶都不能催化他, 因此, MARCKS已广泛用于对细胞PKC活性的检测[26]. 本研究采用western blot分析MARCKS磷酸化水平和纯化PKC使HistoneⅢs磷酸化2种体外测定方法检测PKC活性, 结果发现, 启膈散及其拆方对食管癌细胞PKCα的表达和PKC的活性具有抑制作用, 强弱次序为: 活血组、全方组、化痰组. 上述实验结果显示启膈散全方和活血药对 EGFR- PLCγ1-PKC信号通路的蛋白表达具有同步抑制作用, 其中是由于抑制三者中一个表达后, 导致另外两者表达减少, 还是通过另外一种通路调节三者的蛋白表达, 需要进一步研究. 同时, 启膈散及其拆方还对EGFR和PLC-γ1酪氨酸磷酸化及PKC活性具有抑制作用, 并能降低细胞内游离钙离子浓度. 这些都表明启膈散及其拆方可以通过EGFR-PLCγ1-PKC信号转导通路发挥抑制细胞生长的作用.
总之, 通过本实验我们可以知道: (1)启膈散及其拆方对人食管癌Eca109细胞EGFR- PLCγ1-PKC信号转导通路具有抑制作用, 以活血组药物作用最好; (2)启膈散及其拆方可能通过EGFR- PLCγ1-PKC信号转导通路发挥对Eca109细胞生长抑制作用; (3)启膈散及其拆方对EGFR- PLCγ1-PKC信号转导通路的蛋白表达和蛋白磷酸化的同步抑制机制及EGFR激活后EGFR- PLCγ1-PKC具体的信号转导过程需进一步研究.
食管癌是世界上最常见的六大恶性肿瘤之一, 我国是世界上食管癌发病率和病死率最高的国家, 中晚期食管癌患者5 a生存率仅10% 左右, 目前临床上诊断出的食管癌患者中80% 左右均为中晚期, 寻找食 管癌早期诊断的标志物和治疗药物是提高其生存率的关键. 启膈散是清代名医程钟 龄在他的《医学心悟》中为治疗噎膈病所创制的方剂, 临床上治疗食管癌有肯定疗效.
磷脂酶C-γ1介导的信号转导是近 20 a细胞信号转导研究的热点, 其超量表达及信号转导增强促进了肿瘤的发生发展.
EGFR是原癌基因C-erbB1表达的产物, 为跨膜酪氨酸激酶受体, 主要通过Ras-MAPK、PI3K-Art/PKB、磷酯酶C-γ1-PKC介导的信号通路调节细胞的增殖和分化, 与细胞的再生和肿瘤的发生发展密切相关.
本文首次报道了启膈散及其拆方通过抑制PLCγ1介导的信号转导发挥对人食管癌Eca109细胞生长的抑制作用.
本文研究了中药启膈散对食管癌细胞Eca109PLC-γ1介导的细胞信号转导的影响, 从EGFR-PLCγ1-PKC信号转导通路上不同层次、多种方法研究其机制, 具有一定新颖性和创新性, 结果和结论有说服力.
编辑: 何燕 电编:何基才
| 1. | Mukaida H, Toi M, Hirai T, Yamashita Y, Toge T. Clinical significance of the expression of epidermal growth factor and its receptor in esophageal cancer. Cancer. 1991;68:142-148. [PubMed] |
| 2. | Andl CD, Mizushima T, Nakagawa H, Oyama K, Harada H, Chruma K, Herlyn M, Rustgi AK. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. J Biol Chem. 2003;278:1824-1830. [PubMed] |
| 3. | Kim MJ, Si F, Kim SJ, Hong SB, Hwang JI, Lee HJ, Lee SJ, Chang JS, Lee YH, Ryu SH. The SH2-SH2-SH3 domain of phospholipase C-gamma1 directly binds to translational elongation factor-1alpha. Mol Cells. 1999;9:631-637. [PubMed] |
| 4. | Thomas SM, Coppelli FM, Wells A, Gooding WE, Song J, Kassis J, Drenning SD, Grandis JR. Epidermal growth factor receptor-stimulated activation of phospholipase Cgamma-1 promotes invasion of head and neck squamous cell carcinoma. Cancer Res. 2003;63:5629-5635. [PubMed] |
| 5. | Piccolo E, Innominato PF, Mariggio MA, Maffucci T, Iacobelli S, Falasca M. The mechanism involved in the regulation of phospholipase Cgamma1 activity in cell migration. Oncogene. 2002;21:6520-6529. [PubMed] |
| 6. | Sambrook J, Russell DW. Molecular Cloning. third edition. New York. Cold Spring Harbor Laboratory Press. 2001;16:25-26. |
| 7. | Cobbold PH, Rink TJ. Fluorescence and bioluminescence measurement of cytoplasmic free calcium. Biochem J. 1987;248:313-328. [PubMed] |
| 8. | Helfman DM, Barnes KC, Kinkade JM Jr, Vogler WR, Shoji M, Kuo JF. Phospholipid-sensitive Ca2+-dependent protein phosphorylation system in various types of leukemic cells from human patients and in human leukemic cell lines HL60 and K562, and its inhibition by alkyl-lysophospholipid. Cancer Res. 1983;43:2955-2961. [PubMed] |
| 9. | Arteaga CL. Epidermal growth factor receptor dependence in human tumors: more than just expression? Oncologist. 2002;7 Suppl 4:31-39. [PubMed] |
| 10. | Wells A, Grandis JR. Phospholipase C-gamma1 in tumor progression. Clin Exp Metastasis. 2003;20:285-290. [PubMed] |
| 11. | Smith MR, Court DW, Kim HK, Park JB, Rhee SG, Rhim JS, Kung HF. Overexpression of phosphoinositide-specific phospholipase Cgamma in NIH 3T3 cells promotes transformation and tumorigenicity. Carcinogenesis. 1998;19:177-185. [PubMed] |
| 12. | Ye K, Aghdasi B, Luo HR, Moriarity JL, Wu FY, Hong JJ, Hurt KJ, Bae SS, Suh PG, Snyder SH. Phospholipase C gamma 1 is a physiological guanine nucleotide exchange factor for the nuclear GTPase PIKE. Nature. 2002;415:541-544. [PubMed] |
| 13. | Tan L, Xiao BX, Zeng WS, Lin J, Zou ZP, Xu AM, Luo SQ. Antitumour effects on human colorectal carcinomas cells by stable silencing of phospholipase C-gamma 1 with lentivirus-delivered siRNA. Chin Med J (Engl). 2007;120:749-754. [PubMed] |
| 14. | Munaron L. Calcium signalling and control of cell proliferation by tyrosine kinase receptors (review). Int J Mol Med. 2002;10:671-676. [PubMed] |
| 15. | Moolenaar WH, Aerts RJ, Tertoolen LG, de Laat SW. The epidermal growth factor-induced calcium signal in A431 cells. J Biol Chem. 1986;261:279-284. [PubMed] |
| 16. | Estacion M, Mordan LJ. Competence induction by PDGF requires sustained calcium influx by a mechanism distinct from storage-dependent calcium influx. Cell Calcium. 1993;14:439-454. [PubMed] |
| 17. | Munaron L, Distasi C, Carabelli V, Baccino FM, Bonelli G, Lovisolo D. Sustained calcium influx activated by basic fibroblast growth factor in Balb-c 3T3 fibroblasts. J Physiol. 1995;484:557-566. [PubMed] |
| 18. | Gusev K, Glouchankova L, Zubov A, Kaznacheyeva E, Wang Z, Bezprozvanny I, Mozhayeva GN. The store-operated calcium entry pathways in human carcinoma A431 cells: functional properties and activation mechanisms. J Gen Physiol. 2003;122:81-94. [PubMed] |
| 19. | Nowycky MC, Thomas AP. Intracellular calcium signaling. J Cell Sci. 2002;115:3715-3716. [PubMed] |
| 20. | Michie AM, Nakagawa R. The link between PKCalpha regulation and cellular transformation. Immunol Lett. 2005;96:155-162. [PubMed] |
| 21. | Balboa MA, Firestein BL, Godson C, Bell KS, Insel PA. Protein kinase C alpha mediates phospholipase D activation by nucleotides and phorbol ester in Madin-Darby canine kidney cells. Stimulation of phospholipase D is independent of activation of polyphosphoinositide-specific phospholipase C and phospholipase A2. J Biol Chem. 1994;269:10511-10516. [PubMed] |
| 22. | Ramsden JJ. MARCKS: a case of molecular exaptation? Int J Biochem Cell Biol. 2000;32:475-479. [PubMed] |
| 23. | Ohmori S, Sakai N, Shirai Y, Yamamoto H, Miyamoto E, Shimizu N, Saito N. Importance of protein kinase C targeting for the phosphorylation of its substrate, myristoylated alanine-rich C-kinase substrate. J Biol Chem. 2000;275:26449-26457. [PubMed] |
| 24. | Thelen M, Rosen A, Nairn AC, Aderem A. Regulation by phosphorylation of reversible association of a myristoylated protein kinase C substrate with the plasma membrane. Nature. 1991;351:320-322. [PubMed] |
| 25. | Hartwig JH, Thelen M, Rosen A, Janmey PA, Nairn AC, Aderem A. MARCKS is an actin filament crosslinking protein regulated by protein kinase C and calcium-calmodulin. Nature. 1992;356:618-622. [PubMed] |
| 26. | Fujise A, Mizuno K, Ueda Y, Osada S, Hirai S, Takayanagi A, Shimizu N, Owada MK, Nakajima H, Ohno S. Specificity of the high affinity interaction of protein kinase C with a physiological substrate, myristoylated alanine-rich protein kinase C substrate. J Biol Chem. 1994;269:31642-31648. [PubMed] |