修回日期: 2007-07-09
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 评价和比较2毫居(mci)全身显像法和2 mci部显像法诊断肝肺综合征(HPS)的优劣, 探讨更为实用的诊断方法.
方法: 选择2004年住院的55例肝硬化患者和8例健康志愿者, 利用99m锝(Tc)标记的多聚白蛋白(MAA)灌注显像技术, 采用2 mci全身显像法和2 mci局部显像法测定其肺内分流率并诊断HPS.
结果: 2 mci全身显像组与2 mci局部显像组的55例肝硬化患者分流率分别为3.16%±1.58%和3.18%±1.60%, 其诊断HPS的检出率分别为7.27%和9.09%, 两种方法检出率相比均无统计学差异. 采用2 mci全身显像方法, 测定对照组分流率均数为2.76%, HPS组为6.87%, 非HPS组为2.86%. 采用2 mci局部显像法, 测定对照组分流率均数为2.52%, HPS组为6.85%, 非HPS组为2.82%. 两种方法健康对照组与非HPS组分流率均无统计学差异(P = 0.811和P = 0.46), HPS组分流率高于健康对照和非HPS组(P<0.001). 经计算Kappa值为0.88, 说明两种检验方法检验结果一致性属于最强.
结论: 肝肺综合征的核素诊断方法应进一步统一和规范, 2 mci全身显像法和2 mci局部显像法在肝肺综合征的诊断中均可靠、安全而实用, 值得在国内推广.
引文著录: 王海燕, 王惠吉, 李春林, 杨吉刚, 李书明. 肝硬化患者肝肺综合征核素诊断方法的一项对比研究. 世界华人消化杂志 2007; 15(22): 2431-2435
Revised: July 9, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To evaluate and compare the methods of 99mTc-labeled macro-aggregates of albumin (MAA) lung and brain scanning, and whole-body scanning for diagnosis of hepatopulmonary syndrome (HPS) in patients with cirrhosis.
METHODS: We studied 55 consecutive inpatients with cirrhosis seen in 2004, along with eight healthy volunteers. 99mTc-labeled MAA lung and brain scanning or whole-body scanning was carried out to diagnose HPS. 99mTc-MAA scanning was undertaken follow the same protocol.
RESULTS: In 55 patients with hepatic cirrhosis, we carried out both 2 mci whole-body scanning and 2 mci lung and brain scanning at the same time, the shunt rate was 3.16 ± 1.58% and 3.18 ± 1.60%, and the detection rate of HPS was 7.27% and 9.09%, respectively (P = 1.00). Patients who were diagnosed according to the criteria for HPS were included in the HPS group. Other patients were included in the non-HPS group. For whole-body scanning, the mean shunt rate was 2.76% in the control group, 6.87% in the HPS group, and 2.86% in the non-HPS group. For lung and brain scanning, the mean shunt rate was 2.52% in the control group, 6.85% in the HPS group, and 2.82% in the non-HPS group. The shunt rate in the HPS group was higher than that in non-HPS and control groups (P < 0.001). The kappa value was 0.88, which showed that there was good consistency between the two methods.
CONCLUSION: Different methods for diagnosing HPS in patients with liver cirrhosis should be unified and standardized. Both 2 mci 99mTc-MAA whole-body scanning and 2 mci 99mTc-MAA lung and brain scanning are safe, reliable and pragmatic means for diagnosing HPS.
- Citation: Wang HY, Wang HJ, Li CL, Yang JG, Li SM. Contrasting methods for diagnosing hepatopulmonary syndrome in liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2431-2435
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2431.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2431
肝肺综合征(hepatopulmonary syndrome HPS)是肝脏疾病引起低氧血症的常见原因. 在慢性肝病中其发病率约为4%-17%[1-2], 肝硬化患者中发病率为10%-19%[3-5], 在拟行肝移植患者中发病率为10%-28%[3,6-7]. 目前, 肝移植术是唯一可行的治疗方法[8-9]. 及早明确HPS的诊断, 可以大大降低围手术期死亡率[8], 但目前国际上对肝肺综合征的诊断尚缺乏公认的金标准. 本文将国内外肝移植中心较多采用的几种核素诊断方法进行了对比研究, 其目的在于初步探讨HPS不同诊断方法的优劣.
选择2004年住院的肝硬化患者55例, 其中男34例, 女21例, 年龄21-79(平均56.8)岁. 肝硬化诊断标准参照1990年全国肝硬变专题学术研讨会制定的诊断标准. 55例患者同时采用2毫居(mci)全身显像法和2 mci局部显像法测定其肺内分流率. 对照组选择年龄、性别比与病例组相匹配的健康志愿者8例. 每例研究对象均签署知情同意书.
1.2.1 肝肺综合征诊断标准: (1)直立位呼吸室内空气的情况下, 肺泡气-动脉氧分压差PO2(A-a)增加(≥20 mmHg)[1,2,4]. (2)采用核素显像的方法诊断肺内血管扩张, 分流率≥6%为阳性[6].
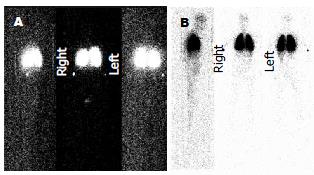
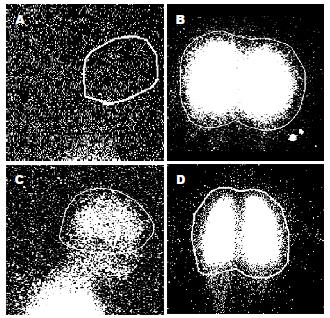
1.2.2 研究过程: (1)立位动脉血气分析、胸片. 患者呼吸室内空气, 取坐位或直立位0.5 h后, 取桡动脉血2 mL, 立即置于冰盒中送检血气分析. 血气分析仪为ABL750型全自动血气分析仪. 测定酸碱度pH, 动脉氧分压PO2, 动脉血二氧化碳分压PCO2, 动脉氧饱和度SiO2, 肺泡气动脉氧分压差PO2(A-a). 每位患者均常规拍胸部正侧位X光片. (2)99mTc标记的多聚白蛋白(macroaggregates of albumin, MAA)灌注显像[2,6,10]. 患者取坐位或直立位0.5 h, 呼吸室内空气, 于右侧肘静脉注射99mTcMAA(药品由北京森科公司提供, 标记率95%以上, 90%的颗粒直径在20-60 μm, 颗粒数50×104±10×104), 注射后5 min, 患者取卧位开始静态采集. 设备采用Philips IRIX3三探头SPECT, 低能高分辨平行孔准直器, 光电峰值140 keV, 窗宽20%, 采集矩阵256×256. 采用2种不同方法分别测定分流率: 2 mci全身显像法中99mTcMAA的放射剂量为2 mci, 三探头同时进行全身显像显像, 图像采集时间为10 min. 取得全身放射分布影像图, 并分别计数头部和肺部放射剂量进行计算. 2 mci局部显像法[2]中99mTcMAA的放射剂量为2 mci, 三探头同时分别对头部、肺部进行局部显像, 每个部位图象采集时间为5 min. 分别取得头部和肺部放射分布影像图, 并分别计数头部和肺部放射剂量进行计算. 正常肺毛细血管床的直径为8-10 μm, 20-60 μm的多聚白蛋白可由肺毛细血管床捕捉并嵌顿在肺内, 因此, 正常情况下只有肺组织有放射性物质显像. HPS时, 肺毛细血管直径可扩张至15-500 μm, 这时MAA就不能被肺毛细血管床所嵌顿, 而随肺静脉进入体循环, 从而导致脑、甲状腺、脾和肾等肺外器官也出现了放射性物质显像. 由于脑部的供血比较稳定, 约占心输出量的13%, 因此采用γ计数的方法分别测定脑部和肺部的放射量, 计算分流率的公式为: 分流率(%) = (脑部γ计数/0.13)/(脑部γ计数/0.13+肺部γ计数), 分流率大于6%诊断为阳性.
统计学处理 使用SPSS12.0软件, 计数资料采用配对χ2检验, 计量资料采用两配对样本t检验, 或单因素方差分析, P<0.05有统计学意义. 分析评价两种检验方法检测结果的一致性用Kappa值计算, 当Kappa值介于0.81-1之间时为一致性最强.
2 mci全身显像法和2 mci局部显像法测定的分流率分别为(3.16%±1.58%)和(3.18%±1.60%), 将两组均数进行配对t检验, 相关系数为0.958, P = 0.663, 差异无显著性. HPS患者临床资料如表1所示. 2 mci全身显像法HPS的检出率为7.27%(4/55), 2 mci局部显像法HPS的检出率为9.09%(5/55), 均与文献报道一致[3]. 两组分流率采用配对χ2检验, P = 1.00, 无统计学差异. 按照HPS的诊断标准, 将分流率大于6%同时PO2(A-a)≥20 mmHg的患者列入HPS组, 其余列入非HPS组. 对照组8例健康志愿者也同时进行2 mci全身和2 mci局部显像, 分流率分别为2.76%和2.52%. 采用2 mci全身显像方法, 所采集图像如图1所示, 测定对照组分流率均数为2.76%, HPS组为6.87%, 非HPS组为2.86%, 将对照组分别与HPS组和非HPS组分流率比较, 分别为P<0.001和P = 0.811. 采用2 mci局部显像法, 所采集图像如图2所示, 测定对照组分流率均数为2.52%, HPS组为6.85%, 非HPS组为2.82%, 将对照组与HPS组、非HPS组分流率比较, 分别为P<0.001和P = 0.46. 两种方法健康对照组与非HPS组分流率均无统计学差异, HPS组分流率高于健康对照和非HPS组. 经计算Kappa值为0.88, 说明两种检验方法检验结果一致性属于最强.
| 年龄(岁) | 性别 | 病因 | C-P分级 | PaO2(mmHg) | PO2(A-a)(mmHg) | 分流率(%) | |
| 2 mci全身 | 2 mci局部 | ||||||
| 46 | 男 | 乙肝 | A | 74.8 | 30.4 | 7.4 | 7.35 |
| 41 | 男 | 乙肝 | B | 82.5 | 26.9 | 6.6 | 6.25 |
| 56 | 女 | 自免肝 | B | 64.6 | 50.1 | 6.46 | 6.4 |
| 70 | 女 | PBC | A | 54.5 | 59.1 | 7.03 | 6.76 |
| 59 | 女 | 隐源 | A | 75.3 | 30.8 | 5.84 | 7.47 |
肝肺综合征是肝脏疾病引起低氧血症的常见原因. 他包括肝病、气体交换异常、肺内血管扩张在内的三联征. 尽管在1977年, Kennedy和Knudson就提出"肝肺综合征(HPS)"这一概念, 但是随着原位肝移植的成功开展并在全世界步入成熟时期, 医学界对HPS才越来越引起足够的重视: 因为目前肝移植术是解决HPS低氧血症的唯一方法[8,11].
肝肺综合征的诊断目前还没有公认的金标准[12-13], 对于气体交换异常以及肺内血管扩张的诊断标准在国际上尚未达成一致[5]. 国内报道的研究方法之间也存在很大差异. 2000年, Krowka再次提出应当对核素分流率的计算方法进行进一步的规范[6]. 正常人核素测定的分流率为2%-5%, 在HPS时有不同程度的分流率增加. 使用核素显像诊断HPS的优点为可以对肺内血管扩张的严重程度进行定量评价; 即使合并有原发性肺部疾患, 核素显像阳性对HPS诊断也具有特异性[14].
2 mci99m锝(Tc)标记的多聚白蛋白(99mTc-MAA)肺灌注显像是一项安全而准确的核医学检查方法, 文献报道其诊断HPS的灵敏度为84%, 特异度为100%[2]. 同时其放射剂量只有2 mci, 是核医学检查中的最小量, 1次显像使用的MAA颗粒数量为(1.5-2)×105, 一过性阻断肺小血管的数量仅占全部肺血管的1/3000以下, 对血流动力学没有影响, 因而也非常安全. 2 mci全身显像法的优点在于方法简单易操作, 肘静脉注射显像剂后, 1次扫描3个体位获取图像, 再用计算机感兴趣区计数法即可计算出分流率. 其缺点在于由于绝大部分放射性物质聚集在肺内, 机器将扫描区内最大放射剂量默认为1, 图像采用0-1之间的灰度对比呈像, 因此头部影像由于放射性物质所占比例太小而显示欠清晰. 2 mci局部显像法需要探头分别在肺部和头部呈像5 min, 检查过程中需要人工调整探头位置2次, 虽然操作过程稍烦琐一些, 但由于头部和肺部分别独立呈像, 本底放射剂量不同, 因此头部的图像更加清晰. 国内有较多文献报道采用5 mci全身显像法, 计算公式为: 分流率 = (全身-两肺)/全身. 此方法测定的分流率数值普遍明显偏高. 笔者认为这种诊断方法存在着不足之处在于: 游离的99mTc(指那些没有与MAA结合的游离锝, 约占10%左右)由于颗粒小, 直接进入体循环并被肝脾巨噬细胞摄取; 那些在肺内积聚并逐渐衰减的99mTc-MAA也最终通过肝肾排泄, 因此使用该公式计算出的并非真正的分流率. 文献显示国外的移植中心均未采用此种方法, 可能也是出于这种考虑.
Krowka et al[15]研究发现从出现呼吸系统症状(原发性呼吸困难)到诊断肝肺综合征的平均时间为4.8±2.5 年. 已知的HPS自然病程表明: 多数患者肺内血管扩张持续进展, 气体交换随时间进行性恶化[16-17], 自然缓解者极为少见[13]. 肝硬化患者HPS的出现可作为预后的独立危险因素[19]. 因此HPS的早期诊断具有重要的临床意义[20]. 及时施行肝移植已经成为治疗HPS的1种有效的方法[21-22], 85%以上及时施行肝移植的患者肺内血管扩张得到显著改善[8,16], 核素显像在HPS的诊断中具有重要的应用价值, 技术简便易于操作, 值得在全国的肝移植中心推广应用.
本研究表明, 2 mci全身显像法和2 mci局部显像法是诊断肝肺综合征的2种敏感而可靠的方法, 可对分流率进行定量评价, 临床应用价值较高.
肝肺综合征(HPS) 是肝脏疾病引起低氧血症的常见原因. 在慢性肝病中其发病率约为4%-17%, 肝硬化患者中发病率为10%-19%, 目前,肝移植术是唯一可行的治疗方法, 但目前国际上对肝肺综合征的诊断尚缺乏公认的金标准.
对于肝肺综合征中气体交换异常以及肺内血管扩张的诊断标准在国际上尚未达成一致. 国内报道的研究方法之间也存在很大差异. 2000年, Krowka再次提出应当对核素分流率的计算方法进行进一步的规范.
核素显像在HPS的诊断中具有重要的应用价值, 技术简便、易于操作, 可定量评价, 值得在全国的肝移植中心推广应用.
肝肺综合征是肝脏疾病引起低氧血症的常见原因.他是包括肝病、气体交换异常、肺内血管扩张在内的三联征.
本文对比研究了肝硬化患者肝肺综合征的核素诊断方法, 结果表明 2 mci局部显像法是诊断肝肺综合征的敏感而可靠的方法, 临床应用价值较高.
编辑: 王晓瑜 电编:张强
| 2. | Abrams GA, Nanda NC, Dubovsky EV, Krowka MJ, Fallon MB. Use of macroaggregated albumin lung perfusion scan to diagnose hepatopulmonary syndrome: a new approach. Gastroenterology. 1998;114:305-310. [PubMed] |
| 3. | Martinez GP, Barbera JA, Visa J, Rimola A, Pare JC, Roca J, Navasa M, Rodes J, Rodriguez-Roisin R. Hepatopulmonary syndrome in candidates for liver transplantation. J Hepatol. 2001;34:651-657. [PubMed] |
| 4. | Aller R, Moya JL, Moreira V, Boixeda D, Cano A, Picher J, Garcia-Rull S, de Luis DA. Diagnosis of hepatopulmonary syndrome with contrast transesophageal echocardiography: advantages over contrast transthoracic echocardiography. Dig Dis Sci. 1999;44:1243-1248. [PubMed] |
| 5. | Schenk P, Fuhrmann V, Madl C, Funk G, Lehr S, Kandel O, Muller C. Hepatopulmonary syndrome: prevalence and predictive value of various cut offs for arterial oxygenation and their clinical consequences. Gut. 2002;51:853-859. [PubMed] |
| 6. | Krowka MJ, Wiseman GA, Burnett OL, Spivey JR, Therneau T, Porayko MK, Wiesner RH. Hepatopulmonary syndrome: a prospective study of relationships between severity of liver disease, PaO(2) response to 100% oxygen, and brain uptake after (99m)Tc MAA lung scanning. Chest. 2000;118:615-624. [PubMed] |
| 7. | Roberts DN, Arguedas MR, Fallon MB. Cost-effectiveness of screening for hepatopulmonary syndrome in liver transplant candidates. Liver Transpl. 2007;13:206-214. [PubMed] |
| 8. | Arguedas MR, Abrams GA, Krowka MJ, Fallon MB. Prospective evaluation of outcomes and predictors of mortality in patients with hepatopulmonary syndrome undergoing liver transplantation. Hepatology. 2003;37:192-197. [PubMed] |
| 9. | Arguedas MR, Fallon MB. Hepatopulmonary syndrome. Curr Treat Options Gastroenterol. 2005;8:451-456. [PubMed] |
| 10. | Wang HY, Wang HJ, Jia JD, Li CL, Yang JG, Li SM. Hepatopulmonary syndrome: a study using 99mTc-MAA lung perfusion scan. Zhonghua Gan Zang Bing Za Zhi. 2006;14:149-150. [PubMed] |
| 11. | Krowka MJ. Hepatopulmonary syndrome and portopulmonary hypertension: implications for liver transplantation. Clin Chest Med. 2005;26:587-597, vi. [PubMed] |
| 12. | Mandell MS. Clinical controversies surrounding the diagnosis and treatment of hepatopulmonary syndrome. Minerva Anestesiol. 2007;73:347-355. [PubMed] |
| 13. | Mandell MS. The diagnosis and treatment of hepatopulmonary syndrome. Clin Liver Dis. 2006;10:387-405, x. [PubMed] |
| 14. | Fallon MB, Abrams GA. Pulmonary dysfunction in chronic liver disease. Hepatology. 2000;32:859-865. [PubMed] |
| 15. | Krowka MJ, Dickson ER, Cortese DA. Hepatopulmonary syndrome. Clinical observations and lack of therapeutic response to somatostatin analogue. Chest. 1993;104:515-521. [PubMed] |
| 16. | Egawa H, Kasahara M, Inomata Y, Uemoto S, Asonuma K, Fujita S, Kiuchi T, Hayashi M, Yonemura T, Yoshibayashi M. Long-term outcome of living related liver transplantation for patients with intrapulmonary shunting and strategy for complications. Transplantation. 1999;67:712-717. [PubMed] |
| 17. | Swanson KL, Wiesner RH, Krowka MJ. Natural history of hepatopulmonary syndrome: Impact of liver transplantation. Hepatology. 2005;41:1122-1129. [PubMed] |
| 18. | Saunders KB, Fernando SS, Dalton HR, Joseph A. Spontaneous improvement in a patient with the hepatopulmonary syndrome assessed by serial exercise tests. Thorax. 1994;49:725-727. [PubMed] |
| 19. | Schenk P, Schoniger-Hekele M, Fuhrmann V, Madl C, Silberhumer G, Muller C. Prognostic significance of the hepatopulmonary syndrome in patients with cirrhosis. Gastroenterology. 2003;125:1042-1052. [PubMed] |
| 20. | Stavrou GA, Fruhauf NR, Lang H, Malago M, Saner F, Broelsch CE. Liver transplantation and severe hepatopulmonary syndrome. Transplantation. 2003;76:746-747. [PubMed] |
| 21. | Carey EJ, Douglas DD, Balan V, Vargas HE, Byrne TJ, Moss AA, Mulligan DC. Hepatopulmonary syndrome after living donor liver transplantation and deceased donor liver transplantation: a single-center experience. Liver Transpl. 2004;10:529-533. [PubMed] |
| 22. | Taille C, Cadranel J, Bellocq A, Thabut G, Soubrane O, Durand F, Ichai P, Duvoux C, Belghiti J, Calmus Y. Liver transplantation for hepatopulmonary syndrome: a ten-year experience in Paris, France. Transplantation. 2003;75:1482-1489; discussion 1446-1447. [PubMed] |