修回日期: 2007-07-11
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 探讨高迁移率族蛋白1(HMGB1)对多形核白细胞(PMN)黏附和游出肺毛细血管内皮细胞(PCEC)的影响机制.
方法: 分离培养大鼠PMN和PCEC, 分别加入0, 10, 100, 1000和10 000 μg/L浓度的rHMGB1与PCEC单层培养. 记录PMN黏附率. 在Boyden小室迁移模型中加入上述浓度的rHMGB1, 观察PMN穿过PCEC的迁移率. 将PMN与100 μg/L的rHMGB1孵育, 流式细胞仪检测其表面CD11a/CD18和CD11b/CD18的表达率.
结果: 随着rHMGB1浓度的增加, PMN的粘附率(2.5%±0.5%, 5.1%±0.9%, 10.7%±1.7%, 14.6%±2.6%, 25.4%±4.3%)和穿过PCEC的游出率(0%, 1.1%±0.3%, 6.3%±1.2%, 12.4%±2.7%, 14.2%±3.1%)逐渐增加, 但对向下室的迁移率无影响. rHMGB1可明显增加PMN表面CD11a/CD18和CD11b/CD18表达的阳性率(均P<0.05).
结论: HMGB1通过上调CD11a/CD18和CD11b/CD18的表达增加PMN对PCEC的黏附率和游出率.
引文著录: 杨智勇, 陶京, 周峰, 熊炯炘, 吴河水, 王春友. 高迁移率族蛋白1对多形核白细胞黏附和游出肺毛细血管内皮细胞的影响及其机制. 世界华人消化杂志 2007; 15(22): 2403-2407
Revised: July 11, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To observe the effect of high mobility group box 1 protein (HMGB1) on adhesion to pulmonary capillary endothelial cells (PCECs) and transendothelial migration of polymorphonuclear leucocytes (PMNs), and to investigate the mechanism involved.
METHODS: PMNs and PCECs of rats were isolated and cultured. PCEC monolayers were cultured with different concentrations of rHMGB, 10, 10, 100, 1000 or 10 000 μg/L. The adhesion rate of PMNs was then detected. A migration model of a boyden chamber was used to evaluate chemotaxis of HMGB1 to PMNs. Transendothelial migration was also investigated. PMNs were cultured with 100 μg/L rHMGB1 and the expression of CD11a/CD18 and CD11b/CD18 was detected by flow cytometry.
RESULTS: With increasing rHMGB1 concentration, adhesion and transendothelial migration rates of PMNs gradually increased (adhesion rate, 2.5 ± 0.5%, 5.1 ± 0.9%, 10.7 ± 1.7%, 14.6 ± 2.6%, and 25.4 ± 4.3%; transendothelial migration rate, 0%, 1.1% ± 0.3%, 6.3 ± 1.2%, 12.4 ± 2.7%, and 14.2 ± 3.1%). rHMGB1 could increase CD11a/CD18 and CD11b/CD18 expression of PMNs (both P < 0.05).
CONCLUSION: HMGB1 is not a chemotactic factor for PMNs but it can promote their adhesion and transendothelial migration by increasing expression of CD11a/CD18 and CD11b/CD18 on the surface of PMNs.
- Citation: Yang ZY, Tao J, Zhou F, Xiong JX, Wu HS, Wang CY. Effect and mechanism of high mobility group box 1 protein on adhesion to pulmonary capillary endothelial cells and transendothelial migration of polymorphonuclear leucocytes. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2403-2407
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2403.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2403
高迁移率族蛋白1(high mobility group box 1 protein, HMGB1)是一类广泛存在于真核细胞内的非组核蛋白[1-2]. HMGB1在是一个重要的转录调节因子[3-6], 与细胞的生长、分化有关[7-11]. 近年来, 研究显示HMGB1在细胞外是一种重要的炎症因子, 在脓毒症、风湿性关节炎、弥散性血管内凝血、出血性休克、急性肺损伤等多种疾病中发挥作用[12-20]. 我们的前期研究显示, HMGB1在急性出血坏死性胰腺炎大鼠肺部高表达, 提示其可能作为晚期炎症因子参与了急性肺损伤(ALI)的发展, 但机制并不十分清楚.
多形核中性白细胞(PMN)的过度激活在急性胰腺炎ALI的发生中起重要作用, 具体表现为PMN聚集和最终脱颗粒释放蛋白水解酶、炎症细胞因子、氧自由基、血管活性物质等启动炎症级联反应导致肺损伤. 有研究显示HMGB1可激活PMN合成IL-1β、IL-8和TNF-α; 小鼠气管内滴入HMGB1可导致ALI, 表现为PMN在肺部聚集、肺水肿、肺组织学评分增加[21], 提示HMGB1可使PMN向肺部聚集、分泌炎症因子导致肺损伤. 但是PMN向肺组织渗出要经过趋化、贴壁、滚动、黏附和游出一系列的过程, HMGB1在此过程中所起的作用及其机制未见报道. 本课题对此进行了进一步研究.
Ⅰ型胶原酶、rHMGB1(美国Sigma公司); 小牛血清、牛血清白蛋白、RPMI 1640培养基、DMEM培养基、胰蛋白酶(美国Gibco公司); Transwell嵌套培养板(6.5 mm×12孔、聚碳酸酯膜、微孔直径5 μm, 丹麦Costar Corning公司); 抗CD11a/CD18抗体和抗CD11b/CD18抗体(小鼠IgG1 mAb)、FITC标记抗小鼠IgG1抗体(美国Genzyme公司); Ⅷ因子抗体、碱性磷酸酶标记的二抗、苏木精染液、淋巴细胞分离液(北京中山生物公司); 免疫组化SP试剂盒(武汉博士德公司); 清洁级成年♂SD大鼠(200-250 g, 华中科技大学同济医学院实验动物学部). 实验通过同济医学院医学伦理委员会审核.
1.2.1 大鼠肺毛细血管内皮细胞(PCEC)分离培养: 成年SD大鼠, 断颈处死. 10 g/L活力碘浸泡消毒. 无菌下开胸暴露肺组织, 沿肺叶边缘2-3 mm剪下肺组织, 放入D-Hank's液2 mL中漂洗2次. 洗净的肺组织剪成1 mm3的组织碎块, 剪时可在瓶中滴入DMEM培养液2-3滴和小牛血清1滴, 将剪碎的肺组织吸入100 mL培养瓶, 平铺于瓶底, 放入37℃, 50 mL/L CO2-950 mL/L空气贴壁2-3 h[22], 加入DMEM培养液(100 mL/L小牛血清)5 mL后, 培养60-72 h后, 换液去掉肺组织碎片. 继续培养7-10 d, 每隔2 d换液1次, 用2.5 g/L胰蛋白酶消化传代. 倒置光学显微镜下观察细胞生长、传代过程中的形态学变化, 以及细胞内的显微结构, 并进一步采用Ⅷ因子免疫组化染色鉴定[2]. 取2-3代细胞做实验.
1.2.2 PMN分离培养: PMN分离培养参照文献[3]方法进行. 大鼠以10 g/L戊巴比妥钠(35 mg/kg)ip麻醉成功后, 颈动脉插管采血, Hanks液(含50 mL/L小牛血清)2倍稀释后加在淋巴细胞分离液层面上, 500 g离心8 min, 吸弃上层血浆和单个核白细胞, 向下层粒细胞和红细胞中加入5倍体积的红细胞溶解液, 0℃溶解15 min后400 g离心10 min, Hanks液洗2次后弃上清, RPMI 1640(含100 mL/L小牛血清)重悬, 调细胞浓度1×109/L, 涂片Gimsa染色分类计数PMN纯度>92%, 台盼蓝染色活细胞计数>95%.
1.2.3 PMN黏附试验: 将PCEC(1×106/well)接种在包被纤维连接蛋白的12孔培养板中, 在50 mL/L CO2-950 mL/L空气37℃培养箱中培养24 h; PCEC融合成单层后, 去血清培养24 h; 换新鲜无血清RIMP 1640培养液(含10 g/LBSA), 按实验分组分别加入PMN 100 μL(106个)和终浓度为0, 10, 100, 1000和10 000 μg/L的rHMGB1培养30 min; Hank's液洗涤2遍去除未黏附的PMN; 在光学倒置显微镜下进行10个200倍视野下EC和黏附的PMN计数, 并计算黏附率 = 黏附的PMN数/EC数[4].
1.2.4 PMN游出单层PCEC试验: 在Transwell上室接种PCEC, 细胞密度为1×105/well(100 μL), 下室加入新鲜培养液600 μL; PCEC融合成单层后, 去血清培养24 h; 换新鲜无血清RIMP 1640培养液(含10 g/LBSA), 50 mL/L CO2-950 mL/L空气37℃培养24 h; 弃去培养液, 用Hank's液洗涤2遍; 换新鲜无血清RIMP 1640培养液(含10 g/L BSA), 上室加入PMN 105个, 按实验分组下室培养液分别含0, 10, 100, 1000和10 000 μg/L的rHMGB1, 50 mL/L CO2-950 mL/L空气37℃培养3 h; 弃去培养液, 用Hanks液洗涤2遍; 在光学倒置显微镜下进行游出单层PCEC的PMN计数. 穿过率为已穿过单层血管内皮的PMN占总数的百分比[5].
1.2.5 PMN表面CD11a/CD18、CD11b/CD18表达的检测: PMN 1 mL(107个)加入终浓度100 μg/L的rHMGB1在50 mL/L CO2-950 mL/L空气37℃分别孵育30 min和3 h; 500 g离心10 min, PBS洗涤2次, 取PMN悬浮液100 μL(106个)加入小鼠抗CD11a/CD18和CD11b/CD18 mAb 20 μL; 阴性对照组加入PBS, 25℃室温放置15 min, 离心后去上清液, 用PBS清洗1次后加20 μL异硫氰酸荧光素标记的二抗, 室温放置3 min, 离心PBS清洗2次, 然后在美国Becton-Dicknson公司的FACSort型流式细胞仪上测量CD11a/CD18和CD11b/CD18免疫阳性细胞数, 在5000个白细胞中计算免疫阳性细胞数及百分率.
统计学处理 采用SPSS11.0统计软件, 计量资料作t检验, P<0.05有显著统计学意义.
倒置显微镜下观察, 可见PCEC不断生长, 由圆形逐渐变为梭形、多边形, 当其铺满培养瓶瓶底时呈鹅卵石镶嵌排列. 细胞胞质内可见对EC具有特异性的W-P小体. Ⅷ因子免疫组化染色显示细胞内有棕黄色沉淀, 说明有Ⅷ因子抗原存在.
随着HMGB1刺激浓度的增加, PMN的黏附率由5.1%(10 μg/L)逐渐增加至25.4%(10 000 μg/L), P<0.05; 分别为2.5%±0.5%, 5.1%±0.9%, 10.7%±1.7%, 14.6%±2.6%和25.4%±4.3%(图1).
随着HMGB1处理浓度的增加, PMN穿过PCEC单层的迁移率由1.1%(10 μg/L)逐渐增加至14.2%(10 000 μg/L), P<0.05; 分别为0, 1.1%±0.3%, 6.3%±1.2%, 12.4%±2.7%和14.2%±3.1%. 但无细胞穿过聚碳酸酯膜迁移到下室.
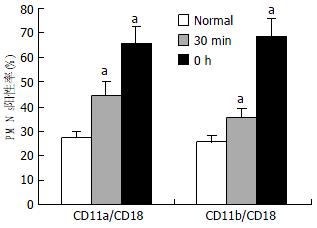
100 μg/L HMGB1刺激30 min和3 h后, 表达CD11a/CD18和CD11b/ CD18的阳性PMN细胞比例均明显升高(图2).
正常情况下组织中少见PMN, 而循环中的PMN呈非活化状态, 必须在趋化因子和激活剂作用下才被激活, 继而侵入炎症组织中. PMN向肺组织渗出要经过趋化、贴壁、滚动、黏附和游出一系列的过程[26]. 我们按成熟的方法分离PCEC, 鉴定结果显示倒置显微镜下可见PCEC瓶底时呈鹅卵石镶嵌排列; 高倍镜下可见具有内皮细胞特异性的W-P小体; Ⅷ因子免疫组化染色阳性. 说明PCEC的分离培养是成功的. 我们采用Boyden小室趋化模型来研究HMGB1对PMN是否具有趋化作用, 经向下室加入不同浓度的HMGB1(假定"趋化物质"), 结果并无PMN穿过聚碳酸酯膜进入下室. 说明HMGB1并非PMN的趋化因子. 但在PMN的黏附试验中, 我们观察到随着HMGB1刺激浓度的增加, PMN对PCEC的黏附逐渐增加, 其黏附率由5.1%逐渐增加至25.4%. 同时, HMGB1对PMN游出也有促进作用, 随着HMGB1作用浓度的提高, PMN穿过PCEC单层到EC与聚碳酸酯膜之间的迁移率由1.1%逐渐增加至14.2%.
上述结果表明, HMGB1并非PMN的趋化因子, 但可促进PMN向血管内皮黏附和游出. PMN向血管内皮黏附和游出与细胞表面黏附分子的相互作用有关. CD11/CD18和ICAM-1参与PMN和血管内皮细胞的黏附, 抗CD11/CD18抗体可明显减少穿越内皮细胞层的PMN数[27], CD11/CD18表达升高和L-选择素表达下降, 则有利于PMN穿越内皮细胞侵入组织[28]. 有研究证实, HMGB1可刺激HUVEC合成和表达黏附分子ICAM-1[29]. 可激活PMNs表达IL-1β、IL-8和 TNF-α[30], 但对于CD11/CD18表达的影响并无研究报道.
本研究结果显示, HMGB1刺激30 min和3 h后, PMN细胞表面CD11a/CD18和CD11b/CD18的表达均有升高. 因此, 我们认为HMGB1可能通过上调血管内皮表面黏附分子ICAM-1和PMN表面黏附分子CD11a/CD18和CD11b/CD18的表达, 促进肺毛细血管内的PMN黏附、游出, 并同时刺激PMN合成并分泌炎症因子导致肺损伤.
HMGB1一直被认为只是1 种DN A结合蛋白. 近年来发现, 在细胞外HMGB1是1种重要的炎症介质, 与多种炎性疾病的发生发展密切相关. HMGB1在数种急性肺损伤动物模型中均高表达, 但其作用并不完全清楚.
ALI是急性胰腺炎患者最常出现的胰外脏器损伤, 致损伤机制还不完全明了. 我们的前期研究提示H MGB1 参与了急性胰腺炎ALI的发展. 本研究有助于进一步认识AL I持续进展的机制.
研究显示, HMGB1在数种急性肺损伤动物模型中均高表达, 小鼠气管内滴入rHMGB1可导致ALI的发生.
诸多研究显示H MGB1 可激活多种炎症细胞释放炎症因子. 但对H MGB1 在P MN向肺组织聚集过程中的作用并不清楚. 本课题对此过程中的趋化、黏附和游出3个环节进行了研究.
TNF-α和IL-1β等细胞因子释放早、持续时间较短, 对其进行针对性治疗的时窗较窄. HMGB1高表达持续时间长的特点为阻止PMN向肺组织聚集和ALI的防治提供了良好的靶点.
本文探讨了高迁移率族蛋白对多形核白细胞黏附和游出肺毛细血管内皮细胞的影响及其机制. 内容有一定的新颖性, 层次较清晰, 讨论观点较明确, 行文流畅, 有一定的科学性.
编辑: 何燕 电编:郭海丽
| 1. | Muller S, Scaffidi P, Degryse B, Bonaldi T, Ronfani L, Agresti A, Beltrame M, Bianchi ME. New EMBO members' review: the double life of HMGB1 chromatin protein: architectural factor and extracellular signal. EMBO J. 2001;20:4337-4340. [PubMed] |
| 2. | Bustin M. Regulation of DNA-dependent activities by the functional motifs of the high-mobility-group chromosomal proteins. Mol Cell Biol. 1999;19:5237-5246. [PubMed] |
| 3. | Calogero S, Grassi F, Aguzzi A, Voigtlander T, Ferrier P, Ferrari S, Bianchi ME. The lack of chromosomal protein Hmg1 does not disrupt cell growth but causes lethal hypoglycaemia in newborn mice. Nat Genet. 1999;22:276-280. [PubMed] |
| 4. | Verrier CS, Roodi N, Yee CJ, Bailey LR, Jensen RA, Bustin M, Parl FF. High-mobility group (HMG) protein HMG-1 and TATA-binding protein-associated factor TAF(II)30 affect estrogen receptor-mediated transcriptional activation. Mol Endocrinol. 1997;11:1009-1019. [PubMed] |
| 5. | Seeler JS, Marchio A, Sitterlin D, Transy C, Dejean A. Interaction of SP100 with HP1 proteins: a link between the promyelocytic leukemia-associated nuclear bodies and the chromatin compartment. Proc Natl Acad Sci U S A. 1998;95:7316-7321. [PubMed] |
| 6. | Flohr AM, Rogalla P, Meiboom M, Borrmann L, Krohn M, Thode-Halle B, Bullerdiek J. Variation of HMGB1 expression in breast cancer. Anticancer Res. 2001;21:3881-3885. [PubMed] |
| 7. | Sparatore B, Pedrazzi M, Passalacqua M, Gaggero D, Patrone M, Pontremoli S, Melloni E. Stimulation of erythroleukaemia cell differentiation by extracellular high-mobility group-box protein 1 is independent of the receptor for advanced glycation end-products. Biochem J. 2002;363:529-535. [PubMed] |
| 8. | Fages C, Nolo R, Huttunen HJ, Eskelinen E, Rauvala H. Regulation of cell migration by amphoterin. J Cell Sci. 2000;113:611-620. [PubMed] |
| 9. | Xiang YY, Wang DY, Tanaka M, Suzuki M, Kiyokawa E, Igarashi H, Naito Y, Shen Q, Sugimura H. Expression of high-mobility group-1 mRNA in human gastrointestinal adenocarcinoma and corresponding non-cancerous mucosa. Int J Cancer. 1997;74:1-6. [PubMed] |
| 10. | Passalacqua M, Patrone M, Picotti GB, Del Rio M, Sparatore B, Melloni E, Pontremoli S. Stimulated astrocytes release high-mobility group 1 protein, an inducer of LAN-5 neuroblastoma cell differentiation. Neuroscience. 1998;82:1021-1028. [PubMed] |
| 11. | Sparatore B, Passalacqua M, Patrone M, Melloni E, Pontremoli S. Extracellular high-mobility group 1 protein is essential for murine erythroleukaemia cell differentiation. Biochem J. 1996;320:253-256. [PubMed] |
| 12. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] |
| 13. | Alsous F, Khamiees M, DeGirolamo A, Amoateng-Adjepong Y, Manthous CA. Negative fluid balance predicts survival in patients with septic shock: a retrospective pilot study. Chest. 2000;117:1749-1754. [PubMed] |
| 14. | Yang H, Ochani M, Li J, Qiang X, Tanovic M, Harris HE, Susarla SM, Ulloa L, Wang H, DiRaimo R. Reversing established sepsis with antagonists of endogenous high-mobility group box 1. Proc Natl Acad Sci U S A. 2004;101:296-301. [PubMed] |
| 15. | Sunden-Cullberg J, Norrby-Teglund A, Rouhiainen A, Rauvala H, Herman G, Tracey KJ, Lee ML, Andersson J, Tokics L, Treutiger CJ. Persistent elevation of high mobility group box-1 protein (HMGB1) in patients with severe sepsis and septic shock. Crit Care Med. 2005;33:564-573. [PubMed] |
| 16. | Ombrellino M, Wang H, Ajemian MS, Talhouk A, Scher LA, Friedman SG, Tracey KJ. Increased serum concentrations of high-mobility-group protein 1 in haemorrhagic shock. Lancet. 1999;354:1446-1447. [PubMed] |
| 17. | Abraham E, Arcaroli J, Carmody A, Wang H, Tracey KJ. HMG-1 as a mediator of acute lung inflammation. J Immunol. 2000;165:2950-2954. [PubMed] |
| 18. | Ueno H, Matsuda T, Hashimoto S, Amaya F, Kitamura Y, Tanaka M, Kobayashi A, Maruyama I, Yamada S, Hasegawa N. Contributions of high mobility group box protein in experimental and clinical acute lung injury. Am J Respir Crit Care Med. 2004;170:1310-1316. [PubMed] |
| 19. | Taniguchi N, Kawahara K, Yone K, Hashiguchi T, Yamakuchi M, Goto M, Inoue K, Yamada S, Ijiri K, Matsunaga S. High mobility group box chromosomal protein 1 plays a role in the pathogenesis of rheumatoid arthritis as a novel cytokine. Arthritis Rheum. 2003;48:971-981. [PubMed] |
| 20. | Hatada T, Wada H, Nobori T, Okabayashi K, Maruyama K, Abe Y, Uemoto S, Yamada S, Maruyama I. Plasma concentrations and importance of High Mobility Group Box protein in the prognosis of organ failure in patients with disseminated intravascular coagulation. Thromb Haemost. 2005;94:975-979. [PubMed] |
| 21. | Yamada S, Maruyama I. HMGB1, a novel inflammatory cytokine. Clin Chim Acta. 2007;375:36-42. [PubMed] |
| 22. | Chen SF, Fei X, Li SH. A new simple method for isolation of microvascular endothelial cells avoiding both chemical and mechanical injuries. Microvasc Res. 1995;50:119-128. [PubMed] |
| 23. | Fernandes MJ, Rollet-Labelle E, Pare G, Marois S, Tremblay ML, Teillaud JL, Naccache PH. CD16b associates with high-density, detergent-resistant membranes in human neutrophils. Biochem J. 2006;393:351-359. [PubMed] |
| 24. | Nakamura H, Herzenberg LA, Bai J, Araya S, Kondo N, Nishinaka Y, Herzenberg LA, Yodoi J. Circulating thioredoxin suppresses lipopolysaccharide-induced neutrophil chemotaxis. Proc Natl Acad Sci U S A. 2001;98:15143-15148. [PubMed] |
| 25. | Rouhiainen A, Kuja-Panula J, Wilkman E, Pakkanen J, Stenfors J, Tuominen RK, Lepantalo M, Carpen O, Parkkinen J, Rauvala H. Regulation of monocyte migration by amphoterin (HMGB1). Blood. 2004;104:1174-1182. [PubMed] |
| 26. | Round table conference. Acute lung injury. Am J Respir Crit Care Med. 1998;158:675-679. [PubMed] |
| 27. | Smith CW, Kishimoto TK, Abbassi O, Hughes B, Rothlein R, McIntire LV, Butcher E, Anderson DC. Chemotactic factors regulate lectin adhesion molecule 1 (LECAM-1)-dependent neutrophil adhesion to cytokine-stimulated endothelial cells in vitro. J Clin Invest. 1991;87:609-618. [PubMed] |
| 28. | Berends C, Dijkhuizen B, de Monchy JG, Dubois AE, Gerritsen J, Kauffman HF. Inhibition of PAF-induced expression of CD11b and shedding of L-selectin on human neutrophils and eosinophils by the type IV selective PDE inhibitor, rolipram. Eur Respir J. 1997;10:1000-1007. [PubMed] |
| 29. | Treutiger CJ, Mullins GE, Johansson AS, Rouhiainen A, Rauvala HM, Erlandsson-Harris H, Andersson U, Yang H, Tracey KJ, Andersson J. High mobility group 1 B-box mediates activation of human endothelium. J Intern Med. 2003;254:375-385. [PubMed] |
| 30. | Park JS, Arcaroli J, Yum HK, Yang H, Wang H, Yang KY, Choe KH, Strassheim D, Pitts TM, Tracey KJ. Activation of gene expression in human neutrophils by high mobility group box 1 protein. Am J Physiol Cell Physiol. 2003;284:C870-879. [PubMed] |