修回日期: 2007-07-20
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 通探讨谷氨酰胺(Gln)和地塞米松(Dex)对脓毒症肝损伤的保护作用.
方法: ip大肠杆菌脂多糖(LPS)制备幼年大鼠脓毒症模型, 按照ip药物不同分为对照组(C, n = 8, ip生理盐水1 mL/kg); 内毒素组(L, n = 40, ip LPS 4 mg/kg),治疗组(T, n = 40, ip LPS 4 mg/kg 后1 h ip Dex 5 mg/kg+Gln 1 mL/kg), 在注射内毒素后0 h(只限对照组), 2, 4, 6, 24 和72 h取肝右叶, 采用免疫组化的方法测定肝组织中肿瘤坏死因子(TNF-α)和基质金属蛋白酶3(MMP3)蛋白质合成水平.
结果: 与C相比, L组TNF-α蛋白质表达明显高于对照组(P<0.01), 24 h达高峰, 72 h虽然有所降低但仍明显高于对照组(P<0.05). T组各时点TNF-α蛋白质表达均高于对照组,但增高幅度明显低于L组(P<0.01), 与对照组相比, L组MMP3蛋白质表达明显升高, 24 h达高峰, 72 h有所降低, 但仍高于对照组(P<0.01); T组较L 组明显减低(P<0.01). L和T组肝脏组织中TNF-α与MMP3改变均呈明显正相关(r = 0.928, r = 0.939).
结论: 联合应用谷氨酰胺与地塞米松可以抑制TNF-α和MMP3的合成, 从而减轻脓毒症幼年大鼠的肝脏损伤和重塑.
引文著录: 王虹, 孙梅, 周卓. 谷氨酰胺和地塞米松对脓毒症幼年大鼠肝脏肿瘤坏死因子-α与基质金属蛋白酶3的影响. 世界华人消化杂志 2007; 15(22): 2382-2386
Revised: July 20, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To explore the effect of glutamine (Gln) and dexamethasone (Dex) on the production of tumor necrosis factor alpha (TNF-α) and matrix metalloproteinase 3 (MMP3) in the liver of young rats with endotoxemia.
METHODS: Endotoxemia models were established by intraperitoneal injection of lipopolysaccharide (LPS) in 88 18-day-old young wistar rats. The rats were then randomly divided into three groups: control group (C, normal saline 1 mL/kg ip, n = 8), LPS group (L, LPS 4 mg/kg ip, n = 40) and treatment group (T, LPS 4 mg/kg ip, followed 1 hour later by Dex 5 mg/kg plus 13.46% Gln 1 mL/kg ip, n = 40). The rats were sacrificed at 0, 2, 4, 6, 24 and 72 h. Liver was isolated, fixed and cut into slices to examine the protein expression of TNF-α and MMP3 by immunohistochemistry.
RESULTS: The protein expression of TNF-α in the L group gradually increased with disease development, until it peaked at 6-24 hours, which was significantly higher than that in the control group (P < 0.01); it then slowly decreased until 72 hours but was still higher than that in the controls (P < 0.05). The variation in the T group was paralleled to that in the L group but significantly milder than that in the L group (P < 0.01). In the L group, the change in MMP3 was similar to that for TNF-α; the peak was at 24 hours, but at 72 hours, it was still higher than in the controls (P < 0.01). In the T group, the production of MMP3 was significantly higher than that in the controls (P < 0.01), but significantly lower than that in the L group (P < 0.01). There were positive correlations between the expression of TNF-α and MMP3 during sepsis (L group, r = 0.928; T group, r = 0.939).
CONCLUSION: Combination of Gln and Dex can prevent the damage and rebuilding of liver with sepsis by decreasing the productions of TNF-α and MMP3.
- Citation: Wang H, Sun M, Zhou Z. Effects of glutamine and dexamethasone on the expression of tumor necrosis factor alpha and matrix metalloproteinase 3 in rat liver with sepsis. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2382-2386
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2382
肝脏胶原纤维对肝细胞及其周围血管有支持和维持形态的作用, 一旦其胶原纤维代谢异常, 将引起肝组织重塑, 肝脏纤维化, 进一步影响肝脏的形态和功能. 脓毒症时可以有心、肺、肝等多脏器功能衰竭, 此时是否伴有肝脏胶原纤维的代谢异常, 尤其是是否存在肝脏形态的改变目前尚未见相关报道. 肿瘤坏死因子(TNF-α)的增加是脓毒症时引起多器官损害的关键, 地塞米松(dexamethasone, Dex)在脓毒症时可以抑制TNF-α以及NO[1]和IL-6的合成, 减少肝脏组织中Toll样受体4的表达, 减少级联免疫反应而保护肝脏[2], 谷氨酰胺(glutamine, Gln)作为自由基清除剂也可以减少脓毒症小鼠的多器官损害和死亡率[3], 但在脓毒症中是否对肝脏胶原代谢有保护作用, 目前还没有相关报道. 观察Gln与Dex对幼年大鼠脓毒症肝脏TNF-α以及胶原代谢的影响, 从而为临床感染性休克的治疗尤其在肝脏的保护方面提供一些理论依据.
参照文献[4]建立幼年大鼠内毒素血症模型, 选健康18日龄Wistar大鼠88只, 体质量28.1±4.9 g, 不分雌雄, 由我院实验动物中心提供. 分组如下: 对照组(Ctrl, n = 8)ip生理盐水1 mL/kg; 内毒素组(L, n = 40, ip LPS 4 mg/kg); Gln与Dex治疗组(T, n = 40, ip LPS 4 mg/kg, 1 h 后ip 13.46 g/L Gln 1 mL/kg+Dex 5 mg/kg). 各组于加LPS后0(仅限于对照组), 2, 4, 6, 24及72 h分别取8只大鼠处死, 分离肝脏右叶, 用冰盐水冲洗后放入0.1 mol/L PBS配制的40 g/L多聚甲醛中固定12-18 h, 常规石蜡包埋, 切片, 用免疫组化方法测定TNF-α和MMP3蛋白质的表达. 大肠杆菌精制内毒素(LPS, Escherichia coli O55: B5)由美国Sigma公司提供. TNF-α及MMP3抗体以及即用型试剂盒由武汉博士得生物医学工程公司提供.
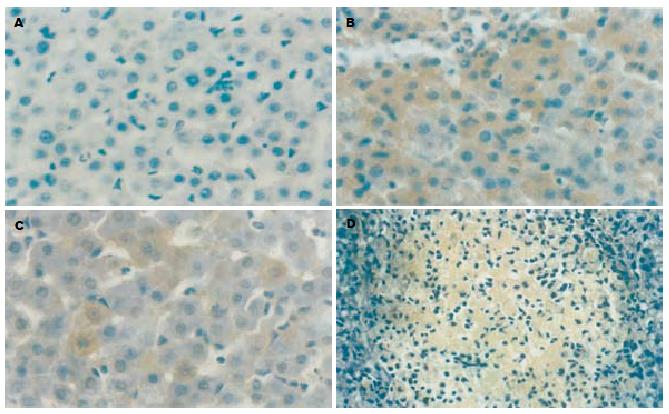
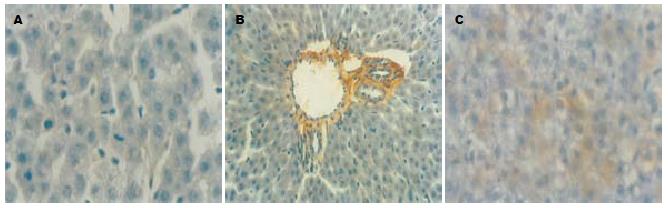
将石蜡切片经常规脱蜡至水, 30 mL/L H2O2, 室温5-10 min灭活内源性酶. 热修复抗原, 加5 g/LBSA封闭, 室温20 min, 甩去多余液体, 不洗. TNF-α指标测定加稀释160倍的小鼠抗TNF-α, 而MMP3指标测定加稀释160倍的小鼠抗MMP3, 37℃, 60 min, 加生物素化山羊抗小鼠IgG, 37℃, 20 min, 加SABC, 37℃, 20 min, PBS洗4次, 每次5 min. DAB显色, 充分水洗, 苏木素复染, 充分水洗, 酒精脱水, 二甲苯透明, 封片. 各时点随机取8张组化染色片, TNF-α阳性者表现为肝细胞质内棕黄色颗粒, MMP3阳性表现为在肝肝血管周围以及肝细胞周围有棕黄色颗粒沉积, 在8张切片上随机选取24个视野照相, 采用日本产Olympus摄像系统和MetaMorph/BX41型图像数据分析系统测定积分吸光度值(Integrated A Total, IAT), 再随机取3个测定的数据计算其平均值作为1个统计数据, 每个时点共取8个统计数据再进行数据分析.
统计学处理 采用SPSS11.0数据分析软件系统, 数据均以(mean±SD)表示, 各组间比较采用Dunnett t检验, P<0.05为显著性差异. TNF-α与MMP3的关系采用相关回归方程表示.
L组肝脏TNF-α表达明显高于对照组(图1A, P<0.001), 24 h达高峰(图1B), 72 h虽然有所恢复但仍强于对照组(P<0.05). T组TNF-α表达趋势与LPS组一致, 但明显低于L组(图1C, P<0.01). 本实验中可以观察到肝脏大体标本在脓毒症时, 其表面可以见到点状坏死, 镜下也可以证实确有灶性坏死(图1D). 脓毒症幼年大鼠肝脏MMP3表达: 脓毒症幼年大鼠肝脏从2组各个时间点表达均强于0 h对照组(图2A); L组最高点在24 h(图2B), 其增高趋势与该组TNF-α增高趋势一致, 到72 h虽然呈现下降趋势但仍高于对照组, 差异有显著(P<0.01). T组MMP3表达趋势于L组一致, 但明显低于L组(P<0.01, 图2C). LPS组TNF-α与MMP3相关系r = 0.928, 相关回归方程为: Y = 1.059X+7.625; 而治疗组r = 0.939, Y = 1.467X+3.419.
基质金属蛋白酶(MMP)是一组由不同类型细胞分泌的依赖钙离子并且与锌离子结合的酶,他可以降解所有的细胞外基质成份[5-6]. 在生理状态下, MMP以无活性的MMP酶原的形式被分泌到细胞外, 很多神经激素、肾上腺皮质激素、细胞因子(尤其是白介素-1, 肿瘤坏死因子α和β)还有细胞外基质金属蛋白酶成份可以影响MMP3的基因传递[7], MMP3的调节包括MMP3的合成和酶原的激活, 此外内源性基质金属蛋白酶组织抑制因子的抑制也参与了这一病理过程[8]. 一旦这种调节失衡, 将会导致组织结构重塑, 引发很多疾病, 如: 关节炎、炎症反应、肿瘤的发生与转移等[9-18]. 酒精中毒性肝炎、乙型、慢性肝损伤和丙肝通过MMP活性增强, 导致肝脏细胞坏死增加以及肝细胞周围具有支持功能的胶原纤维的降解增加, 均有可能导致肝脏的形态和结构改变(肝硬化)[19-22], 本研究中脓毒证时MMP3合成明显增加, 那么推测脓毒症后幸存的大鼠有可能发生肝脏重塑. 对已经受损的肝脏组织, 重组人肝脏再生细胞因子可以促进其MMP3的表达[23]. 此外LPS 还可以使小肠上皮细胞凋亡增加[24], 而同时有增生作用的细胞核抗原表达减少[25], 使小肠的屏障作用降低. TNF-α是引起多脏器损害的主要细胞毒性因子, 他可以增加肝脏细胞的凋亡和坏死以及MMP3表达增强, 同时还可以通过诱导NO合成酶, 合成过量的NO, 使血管内皮损伤, 抑制呼吸链电子传递而引起肝细胞的损害并促进血清IL-8分泌以及抑制血清IL-10 的分泌[26], 从而延缓损伤组织的修复.
Dex为糖皮质激素, 可以抑制细胞因子的合成, 广泛应用于减轻炎症反应. 有报道12-氧-十四烷佛波醇-13-醋酸盐能促进野生型MMP3转录活性, 后者有较高的促进人类结肠癌基因的表达, Dex可钝化其促进野生型MMP3转录活性的作用, 使直肠癌症发生率降低, 小剂量的糖皮质激素就可以抑制MMPs的合成[27]. IL-1和TNF-α可以诱导人类齿龈以及关节滑膜细胞的MMP3表达Dex可以抑制这种表达[28], 我们也证实了用Dex治疗组其肝内TNF-α与MMP3的合成均较LPS组明显减轻, 而且二者的变化趋势一致, 说明二者有一定的相关性.
由于Dex的副作用较大, 临床医生在应用时往往会产生一些顾虑, 因此人们在不放弃应用糖皮质激素的同时, 又在努力寻找另外的在抗炎方面与之有协同作用且副作用较小的药物. 近年来已经有报道观察到规律进食Gln可以保持小肠基底膜的完整性, 减少其分解[4], ip Gln也可以减轻内毒素对小肠的损伤[29]. 对肿瘤细胞, Gln能够使其对TNF-α的敏感性增强而凋亡[30]. 本人在以往的研究中也同样发现Gln能够通过减轻内毒素对心肌收缩蛋白合成的抑制作用[31]和减少心肌重塑[32]保护心肌收缩功能, 从而保护内毒素血症大鼠的脏器损伤. 本试验中Gln与Dex有协同作用, 在脓毒症发生至72 h之内, 均能使肝脏的TNF-α以及MMP3合成减低, 说明Gln对维持肝细胞的形态和功能可能有一定的保护作用.
肝脏胶原纤维对肝细胞及其周围血管有维持形态和支持的作用,MM P是降解细胞外基质的酶, MMP活性与肝硬化形成明显相关. 已知地塞米松和谷氨酰胺对脓毒症引起的某些脏器MMP过度合成有抑制作用, 但在肝脏中作用尚未见报道.
有研究证实脓毒症时肝脏细胞外基质确实受到损害, 另有研究报道地塞米松和谷氨酰胺分别在脓毒症时对小肠、心脏的损害有保护作用, 本文首次将其合用作保护大 鼠肝脏损害的药物, 取得了满意的效果.
地塞米松已广泛用于临床抑制炎症反应, 谷氨酰胺在心肌缺血再灌注损伤的防治中作用也比较突出, 进一步了解二者的作用机制有望成为脓毒症脏器损伤的保护剂.
1 细胞外基质: 胶原纤维的重要组成部分, 其过度破坏对肝细胞及其周围血管的支持以及形态的维持是有害的.2 MMP: 是降解细胞外基质的主要酶, 因此监测肝组织中MMP的代谢即可间接监测肝脏纤维代谢情况.
本文研究了谷氨酰胺和地塞米松对脓毒症幼年大 鼠肝脏的作用, 研究目的明确, 方法使用恰当, 引用的参考文献较新, 有一定的学术价值.
编辑: 王晓瑜 电编:郭海丽
| 3. | Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine reduces cytokine release, organ damage, and mortality in a rat model of endotoxemia. Shock. 2001;16:398-402. [PubMed] |
| 4. | Alscher KT, Phang PT, McDonald TE, Walley KR. Enteral feeding decreases gut apoptosis, permeability, and lung inflammation during murine endotoxemia. Am J Physiol Gastrointest Liver Physiol. 2001;281:G569-G576. [PubMed] |
| 5. | Matsunaga Y, Koda M, Murawaki Y. Expression of matrix metalloproiteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs) in hepatocellular carcinoma tissue, compared with the surrounding non-tumor tissue. Res Commun Mol Pathol Pharmacol. 2004;115-116:143-150. [PubMed] |
| 6. | Cheng J, Huo DH, Kuang DM, Yang J, Zheng L, Zhuang SM. Human macrophages promote the motility and invasiveness of osteopontin-knockdown tumor cells. Cancer Res. 2007;67:5141-5147. [PubMed] |
| 7. | von Lampe B, Barthel B, Coupland SE, Riecken EO, Rosewicz S. Differential expression of matrix metalloproteinases and their tissue inhibitors in colon mucosa of patients with inflammatory bowel disease. Gut. 2000;47:63-73. [PubMed] |
| 8. | Hu J, Van den Steen PE, Dillen C, Opdenakker G. Targeting neutrophil collagenase/matrix metalloproteinase-8 and gelatinase B/matrix metalloproteinase-9 with a peptidomimetic inhibitor protects against endotoxin shock. Biochem Pharmacol. 2005;70:535-544. [PubMed] |
| 9. | Montrull HL, Brizuela NY, Demurtas SL, Strusberg AM, Spitale LS, Meirovich CI. Collagenase production increases in rheumatoid arthritis and osteoarthritis synoviocytes incubated. Rev Fac Cien Med Univ Nac Cordoba. 2000;57:51-57. [PubMed] |
| 10. | Wiencke K, Louka AS, Spurkland A, Vatn M, Schrumpf E, Boberg KM. Association of matrix metalloproteinase-1 and -3 promoter polymorphisms with clinical subsets of Norwegian primary sclerosing cholangitis patients. J Hepatol. 2004;41:209-214. [PubMed] |
| 11. | Yu FL, Liao MH, Lee JW, Shih WL. Induction of hepatoma cells migration by phosphoglucose isomerase/autocrine motility factor through the upregulation of matrix metalloproteinase-3. Biochem Biophys Res Commun. 2004;314:76-82. [PubMed] |
| 12. | Moran A, Iniesta P, de Juan C, Garcia-Aranda C, Diaz-Lopez A, Benito M. Impairment of stromelysin-1 transcriptional activity by promoter mutations in high microsatellite instability colorectal tumors. Cancer Res. 2005;65:3811-3814. [PubMed] |
| 13. | Guo SY, Shen X, Yang J, Yuan J, Yang RL, Mao K, Zhao DH, Li CJ. TIMP-1 mediates the inhibitory effect of interleukin-6 on the proliferation of a hepatocarcinoma cell line in a STAT3-dependent manner. Braz J Med Biol Res. 2007;40:621-631. [PubMed] |
| 14. | Arai I, Nagano H, Kondo M, Yamamoto H, Hiraoka N, Sugita Y, Ota H, Yoshioka S, Nakamura M, Wada H. Overexpression of MT3-MMP in hepatocellular carcinoma correlates with capsular invasion. Hepatogastroenterology. 2007;54:167-171. [PubMed] |
| 15. | Shimizu H, Yokoyama S, Asahara H. Growth and differentiation of the developing limb bud from the perspective of chondrogenesis. Dev Growth Differ. 2007;49:449-454. [PubMed] |
| 16. | Roeb E, Bosserhoff AK, Hamacher S, Jansen B, Dahmen J, Wagner S, Matern S. Enhanced migration of tissue inhibitor of metalloproteinase overexpressing hepatoma cells is attributed to gelatinases: relevance to intracellular signaling pathways. World J Gastroenterol. 2005;11:1096-1104. [PubMed] |
| 17. | Fallowfield JA, Mizuno M, Kendall TJ, Constandinou CM, Benyon RC, Duffield JS, Iredale JP. Scar-associated macrophages are a major source of hepatic matrix metalloproteinase-13 and facilitate the resolution of murine hepatic fibrosis. J Immunol. 2007;178:5288-5295. [PubMed] |
| 18. | Hasebe T, Kajita M, Fujimoto K, Yaoita Y, Ishizuya-Oka A. Expression profiles of the duplicated matrix metalloproteinase-9 genes suggest their different roles in apoptosis of larval intestinal epithelial cells during Xenopus laevis metamorphosis. Dev Dyn. 2007;236:2338-2345. [PubMed] |
| 19. | Xu GF, Li PT, Wang XY, Jia X, Tian DL, Jiang LD, Yang JX. Dynamic changes in the expression of matrix metalloproteinases and their inhibitors, TIMPs, during hepatic fibrosis induced by alcohol in rats. World J Gastroenterol. 2004;10:3621-3627. [PubMed] |
| 20. | Yu FL, Liu HJ, Lee JW, Liao MH, Shih WL. Hepatitis B virus X protein promotes cell migration by inducing matrix metalloproteinase-3. J Hepatol. 2005;42:520-527. [PubMed] |
| 21. | Roderfeld M, Hemmann S, Roeb E. Mechanisms of fibrinolysis in chronic liver injury (with special emphasis on MMPs and TIMPs). Z Gastroenterol. 2007;45:25-33. [PubMed] |
| 22. | Lichtinghagen R, Bahr MJ, Wehmeier M, Michels D, Haberkorn CI, Arndt B, Flemming P, Manns MP, Boeker KH. Expression and coordinated regulation of matrix metalloproteinases in chronic hepatitis C and hepatitis C virus-induced liver cirrhosis. Clin Sci (Lond). 2003;105:373-382. [PubMed] |
| 27. | Richardson DW, Dodge GR. Dose-dependent effects of corticosteroids on the expression of matrix-related genes in normal and cytokine-treated articular chondrocytes. Inflamm Res. 2003;52:39-49. [PubMed] |
| 28. | Domeij H, Yucel-Lindberg T, Modeer T. Signal pathways involved in the production of MMP-1 and MMP-3 in human gingival fibroblasts. Eur J Oral Sci. 2002;110:302-306. [PubMed] |
| 30. | Obrador E, Carretero J, Esteve JM, Pellicer JA, Pascual A, Petschen I, Estrela JM. Glutamine potentiates TNF-alpha-induced tumor cytotoxicity. Free Radic Biol Med. 2001;31:642-650. [PubMed] |
| 31. | Wang H, Pan JK, Sun M, Zhou Z, Gao H. Effects of glutamine on alpha-sarcomeric actin and its mRNA expression of myocardium in rats with endotoxemia. Zhonghua Er Ke Za Zhi. 2005;43:925-929. [PubMed] |
| 32. | Wang H, Yu XY, Sun M, Pan JK, Gao H. Effects of glutamine on matrix metalloproteinase-3 and tissue inhibitor of metalloproteinase-3 expressions in myocardium of rats with sepsis. Zhonghua Er Ke Za Zhi. 2006;44:587-591. [PubMed] |