修回日期: 2007-05-01
接受日期: 2007-05-11
在线出版日期: 2007-07-18
目的: 探讨CD4+CD25+调节性T细胞(regulatory T Cell, Treg)在慢性乙型肝炎(chronic hepatitis B, CHB)患者免疫发病机制中的作用以及其可能在治疗中的应用前景.
方法: 收集未经抗病毒治疗的CHB患者34例和健康对照18例外周血单个核细胞(peripheral blood mononuclear cell, PBMC)标本, 以三色/四色流式分析法对PBMC中CD4+CD25+ Treg的频率及表面分子表达进行分析, 并同时通过磁珠分选去除CHB患者PBMC中的CD4+CD25+ Treg, 分别以MHC-肽-五聚体法和酶联斑点计数法(enzyme-linked immunospot assay, Elispot)检测HBV core18-27抗原肽刺激的对HBV特异性的CTL(cytotoxic T lymphocyte)频率的升高以及IFN-γ的分泌.
结果: CHB患者外周血中CD4+CD25+ CD45RO+CTLA4+ T细胞群以及CD4+CD127loCD25hi-int T细胞群所占CD4+ T细胞群的比例与健康对照相比均明显上升(3.78%±1.87%, 4.40%±2.11% vs 1.58%±0.76%, 2.11%±1.26%; t = 4.86, t = 5.96; P<0.01)去除CHB患者中CD4+CD25+ Treg后, 特异性CTL的频率以及其分泌IFN-γ的频数与未去除组比出现显著上调(0.94%±0.38%, 26±13 vs 0.20%±0.18%, 119±30; t = 5.25, t = 9.886; P<0.01).
结论: CHB患者循环中增多的Treg可能参与抑制抗HBV的免疫应答抑制, 去除Treg以及联合病毒抗原肽刺激的进一步研究可能为CHB的免疫治疗提供新的思路.
引文著录: 张恒辉, 郭芳, 费然, 马慧, 王雪艳, 丛旭, 魏来, 陈红松. CD4+CD25+调节性T细胞在慢性乙型肝炎患者免疫发病机制中的作用. 世界华人消化杂志 2007; 15(20): 2225-2230
Revised: May 1, 2007
Accepted: May 11, 2007
Published online: July 18, 2007
AIM: To evaluate the proportion of CD4+CD25+ regulatory T cells (Tregs) in the immunopathogenesis of patients with chronic hepatitis B (CHB), and to evaluate their potential application in CHB immunotherapy.
METHODS: Peripheral blood mononuclear cells (PBMCs) of 34 patients with CHB and 18 healthy donors were evaluated for the CD4+CD25+ Treg phenotype and the proportion of CD4+CD25+ Tregs as a percentage of the total number of CD4+ cells using flow cytometry with triple-color/fourth-color staining. CD4+CD25+ Tregs were isolated from CHB patients by magnetic beads. Then PBMCs of Treg-depleted and non-Treg-depleted CHB patients were stimulated with HBV core18-27 peptide. The percentage of HBV core18-27-specific cytotoxic lymphocytes (CTLs) and interferon (IFN)-γ-secreting CTLs was determined in PBMCs of Treg-depleted and non-Treg-depleted CHB patients by HLA-pentamer and Elispot (enzyme-linked immunospot assay) analysis.
RESULTS: The percentage of CD4+CD25+ Tregs in CHB patients was reflected by detecting the proportion of CD4+CD127loCD25hi-int Tregs (4.40% ± 2.11%) and CD4+CD25+CD45RO+CTLA4+ Tregs (3.78% ± 1.87%), which were significantly higher than the proportion of CD4+CD127loCD25hi-int Tregs (2.11% ± 1.26%) and CD4+CD25+CD45RO+CTLA4+ Tregs (1.58% ± 0.76%) in healthy donors (P < 0.01). The frequency and IFN-γ-secreting spots of NY-ESO-1-specific CD8+ T cells was higher in CD4+CD25+-depleted PBMCs from CHB patients than in the total PBMC population of all patients tested (0.94% ± 0.38%, 26 ± 13 vs 0.20% ± 0.18%, 119±30, t = 5.25, t = 9.886, P < 0.01).
CONCLUSION: The proportion of CD4+CD25+ Tregs in CHB patients seems to be greater than that in healthy donors. The elimination of Tregs can significantly improve the anti-viral CTL responses in CHB patients, compared with stimulation with HBV core18-27 peptide alone. This may contribute to immunotherapy in CHB patients.
- Citation: Zhang HH, Guo F, Fei R, Ma H, Wang XY, Cong X, Wei L, Chen HS. Effects of regulatory T cells on anti-viral immune responses impaired by chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2225-2230
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2225.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2225
最近, Treg细胞尤其是CD4+CD25+ Treg细胞, 在人类肝脏疾病中的作用逐渐得以认识. 目前认为CD4+CD25+ Treg细胞可以控制肝脏炎症的发生及避免肝细胞受到免疫攻击. 但是当CD4+CD25+ Treg的这种抑制作用在发生HBV或HCV感染及肝脏肿瘤发生时, 由于CD4+CD25+ Treg抑制了机体抗HBV或HCV及抗肿瘤免疫应答的能力, 则有可能导致病毒感染的持续以及肿瘤的进展. HBV感染的控制与特异性的CD8+ T细胞介导的细胞毒性T细胞(cytotoxic T lymphocyte, CTL)及CD4+ T辅助细胞引起的免疫应答有关. 研究证实, 在机体发生一些病原微生物感染时, 机体的Treg的数量增多且可抑制CD4+ T细胞和CD8+ T细胞的活化增殖及细胞因子的分泌, 从而影响机体抗感染免疫应答的发生, 导致感染的持续[1-4]. 国内外在慢性HBV感染患者中CD4+CD25+ Treg的研究中, 对于慢性HBV感染患者外周血中CD4+CD25+ Treg细胞的比例是否升高并不一致[5-6], 且对于CD4+CD25+ Treg细胞在慢性HBV感染患者免疫发病机制中作用及去除CD4+CD25+ Treg细胞后是否能有效增强HBV抗原肽诱导的抗HBV免疫应答尚不确定. 为了进一步明确上述问题, 我们收集了34例CHB患者外周血采用多组CD4+CD25+ Treg特异性标记对其循环中的CD4+CD25+ Treg 细胞频率进行确证, 同时探讨CHB患者循环中CD4+CD25+ Treg的体外去除能否增强CHB患者抗病毒免疫应答的能力.
CHB患者34例, 诊断符合2005年制定的《慢性乙型肝炎防治指南》. 患者平均年龄41(27-69)岁, 全部患者均经ELISA方法检测HBV血清学标志: HBsAg, HBsAb, HBeAg, HBeAb, HBcAb, 并用荧光定量PCR方法检测HBV DNA水平(5.4×105-2.1×108 copies/mL). 排除HCV, HAV, HDV, HEV感染, 近3 mo没有接受过抗病毒治疗. 健康对照18例为健康献血员, 所有组织标本及血液标本的收集均征得患者及健康献血员本人的书面知情同意. 鼠抗人CD4-PerCP-Cy5.5, CD45RO-APC, CD25-FITC, CTLA-4-PE, CD45RA-PE, HLA-DR-PE, 鼠抗人HLA-A02 mAb均购于美国BD公司; 鼠抗人GITR-FITC购自美国R&D公司; 流式细胞仪为美国BD公司; CD4负选、CD25正选磁珠购于加拿大Stem cell公司; HBV核心肽(HBV core18-27 FLPSDFFPSV)由上海生物医学工程公司合成; HBV core18-27肽五聚体(PE-conjugated HLA-0201/HBV core18-27 pentamer)以及HCV NS3肽五聚体(PE-conjugated HLA-0201/HCV NS3 pentamer)购自英国Proimmune公司. 静脉抽取外周血10 mL, 抗凝, 小心铺于淋巴细胞分离液10 mL表面, 梯度离心20 min(22℃, 450 r/min), 细胞悬液和淋巴细胞分离液之间的白膜层即为所分离得到的单个核细胞, 小心吸出后, 用预冷RPMI 1640稀释, 400 r/min离心15 min, 去除混杂的淋巴细胞分离液; 最后用预冷RPMI 1640悬浮细胞沉淀, 300 r/min离心5 min, 即可分离到外周血单个核细胞.
取全血100 μL与鼠抗人HLA-A02单抗100 μL室温共孵育15 min, 加入红细胞裂解液2 mL裂解红细胞, PBS洗1遍, 加羊抗鼠IgG-FITC 1 μL, 室温避光反应15 min, 2 mL PBS洗3遍. 最后用10 g/L多聚甲醛300 μL重悬固定, 行流式细胞仪检测. 同时每份标本均设自身阴性对照. 取2×105 PBMC分别与CD-4-PerCP-Cy5.5, CD45RO-APC, CD25-FITC, CTLA-4-PE以及CD127-PE抗体室温共孵育15 min. 以流式细胞仪双色、三色、四色分析法分别分析CD4+CD25high Treg细胞、CD4+CD127loCD25hi-int Treg细胞、CD4+CD25+CD45RO+CTLA4+ Treg细胞占CD4+ T细胞的比例. 同时取CD4-PerCP-Cy5.5, CD25-FITC, CD62L-PE, CD45RA-PE, HLA-DR-PE, GITR-FITC标记各份PBMC样本以流式细胞仪三色分析法分析CD4+CD25- T细胞, CD4+CD25low T细胞, CD4+CD25high Treg细胞表面分子CD45RA, HLA-DR, GITR以及CD103的表达. 每份检测标本均设自身阴性对照. 将密度梯度离心法分离的PBMC用CD4负选磁珠分选法去除单个核细胞中的CD4- T细胞; 再使用CD25正选磁珠法分选出CD4+CD25+ T细胞, 剩余细胞即为CD4+CD25-的T细胞.
1.2.1 HBV特异性CTL的诱导和HBV core18-27特异性的CTL的检测: 将第1次磁珠分离后的CD4- T细胞以及第2次磁珠分离后的CD4+CD25- T细胞混合, 在体外进行IL-2 30 kU/L维持培养, 同时给予HBV core18-27多肽(10 mg/L)刺激, 每6 d刺重复刺激. 将去除以及未去除CD4+CD25+ Treg细胞CHB患者的PBMC体外培养2-3 wk后进行HBV core18-27特异性的CTL的检测. 取CHB患者体外培养2-3 wk的去除以及未去除CD4+CD25+ Treg细胞的PBMC, 分别用PBS调节为数量为4×105/管, 加入PE标记HBV core18-27肽五聚体10 μL避光, 室温反应15 min, 用PBS洗涤细胞2次后加入FITC标记的抗CD8抗体10 μL, 冰上避光孵育15 min, 用PBS洗2遍. 10 g/L多聚甲醛300 μL重悬固定, 行流式检测. 每例患者标本均设各自同型对照. 对于CHB患者, 采用HLA-A0201/HCV NS3五聚体标记作为阴性对照, 该实验每个标本均设平行管, 取2次流式检测结果均值进行统计学处理.
1.2.2 Elispot检测分泌IFN-γ的T细胞频数: 采用BD公司IFN-γ Elispot检测试剂盒. 具体操作可详见试剂盒操作说明. 加入细胞组别分别为CHB患者单纯经IL-2维持组、经HBV core18-27刺激并去除CD4+CD25+ Treg的CHB患者PBMC, 经HBV core18-27刺激的CHB患者PBMC, 加入细胞数2×105/孔. 经孵育、洗板、标记、显色等步骤后采用CTL公司Immunospot分析仪计数每孔斑点数.
统计学处理 用SPSS11.0软件进行统计分析, 对于多组间采用F分析, 两组间比较采用双侧t检验, 相关性分析采用Spearman法, P<0.05为差异有统计学意义.
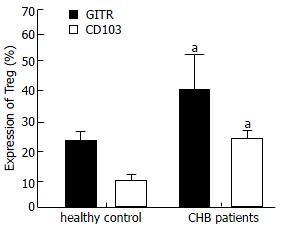
CHB患者循环中CD4+CD127loCD-25hi-int Treg细胞, CD4+CD25+CD45RO+CTLA4+ Treg细胞占CD4+ T细胞的比例均显著高于健康志愿者循环中上述二群细胞占CD4+ T细胞的比例(t = 5.96, t = 4.86, P<0.01, 表1). 且对比CD4+CD127loCD25hi-int Treg细胞、CD4+CD25+CD45RO+CTLA4+ Treg占CD4+ T细胞的比例发现, 二群细胞在反映CD4+CD25+ Treg比例上有很强的正相关性(r = 0.96, P<0.01). 以流式细胞仪三色分析法分析发现, 与CD4+ CD25- T细胞、CD4+CD25low T细胞相比CHB患者及健康对照外周血中CD4+CD25high T细胞表面分子CD45RA低表达, 而HLA-DR, CTLA-4, CD45RO高表达. 研究还发现, CHB患者CD4+CD25high Treg表面GITR以及CD103分子与健康对照相比均出现明显上调(t = 3.85, t = 4.97, P<0.01, 图1).
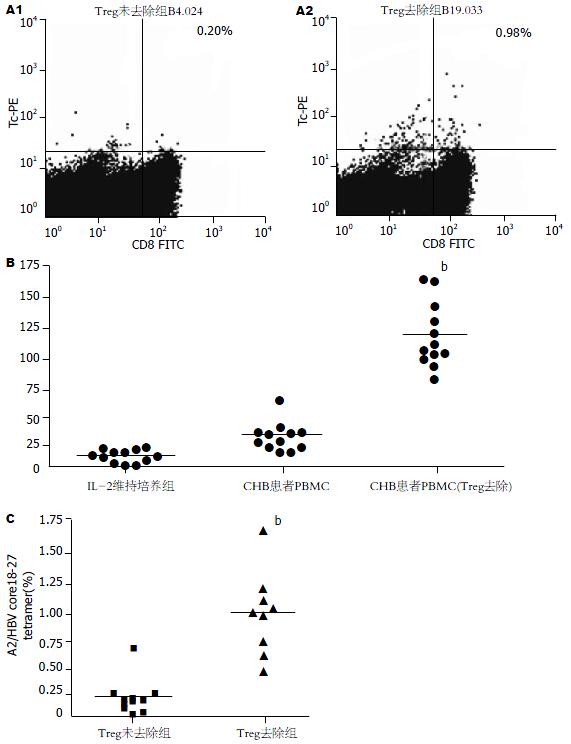
经HLA-A2型别鉴定, 34例CHB患者中筛选出12例HLA-A2+ CHB患者. 对于该12例HLA-A2+ CHB患者, 通过磁珠分选可有效去除CHB患者外周血中CD4+CD25+ Treg细胞, 去除效率可达到90%以上(数据未显示). 分别对于去除CD4+CD25+ Treg细胞或未去除的CHB患者PBMC在经HBVcore18-27多肽多次刺激后, 行HBV core18-27肽五聚体标记与流式检测发现, 去除CHB患者循环中CD4+CD25+ Treg细胞后可显著增强HBV core 18-27肽诱导的CTL频率(Treg未去除0.20%±0.18%, Treg去除后0.94%±0.38%; t = 5.25, P<0.01, 图2A, C). Elispot检测HBV core18-27特异性的CTL分泌IFN-γ的T细胞的频数发现, 去除CHB患者循环中CD4+CD25+ Treg细胞后CTL分泌IFN-γ的频数(119±30)显著高于未去除Treg的患者(26±13, t = 9.886, P<0.01, 图2B).
目前关于CHB患者外周血中CD4+CD25+ Treg细胞频率是否升高存在争议, 我们对CHB患者循环中CD4+CD25high T细胞、CD4+CD127loCD25hi-int T细胞、CD4+CD25+CD45RO+CTLA4+ T细胞进行比较发现, CHB患者循环中经流式双色分析检测出CD4+CD25high T细胞频率与健康对照之间无统计学差异, 这一点与Franzese et al[6]结果一致. 而经三色及四色流式分析的CHB患者循环中CD4+CD127loCD25hi-int T细胞、CD4+CD25+CD45RO+CTLA4+ T细胞频率则显著高于健康对照, 其中CD4+CD25+CD45RO+ CTLA4+ T细胞频率升高与Stoop et al[5]人报道一致. 这些研究中Treg的比例检测的差异可能主要是由于当前对Treg细胞界定及检测方法不同所致. 目前多数对于CD4+CD25+ Treg研究主要通过检测CD4+CD25high T细胞来反映体内CD4+CD25+ Treg的频率. 但CD25虽然可作为鉴定CD4+CD25+ Treg典型标志, 但一些活化的T细胞也可表达此分子. 故在本研究中我们采用了一些更为特异的标志. 通过流式检测HCC及慢性HBV感染患者外周血中CD4+CD25+CD45RO+CTLA4+ 4种标记物阳性的T细胞来反映Treg细胞. CTLA-4(cytotoxic T-lymphocyte-associated antigen 4)也称细胞毒T细胞相关抗原-4, 是T细胞表面重要膜分子[7-8], CD4+ CD25+ T细胞活化后CTLA-4的表达增加, 并持续表达, 故认为CD4+CD25+CD45RO+CTLA4+ T细胞的频率更能准确的反映体内活化的天然产生的Treg细胞, 从而区别于抗原反复刺激诱导产生的获得性Treg细胞[5]. 此外, Foxp3(forkhead/winged helix transcription factor)又称叉状头/翅膀状螺旋转录因子, 作为Treg细胞特异性表达的基因和抑制功能维持的主要调节基因是Treg细胞的特异性标志[9-10]. 但Foxp3属于胞内蛋白, 检测时的细胞破膜处理过程会影响检测的结果和下游的试验, 而最近发现CD127的低表达与Foxp3表达及其一致且与CD25中等-强表达有良好的相关性, 故检测CD127loCD25hi-int T细胞可较好的反映CD4+CD25+ Treg的频率[11-12]. 因此, 我们通过上述方法学的比较发现, CHB患者循环中CD4+CD127loCD25hi-int Treg细胞、CD4+CD25+CD45RO+CTLA4+ Treg细胞频率显著高于健康对照, 且两种检测方法所得结果有很好的一致性(r = 0.96, P<0.01), 上述结果进一步证实了CHB患者循环中CD4+CD25+ Treg细胞频率升高.
在对CD4+CD25+ Treg细胞表面分子进行研究时, 我们发现, CHB患者中CD4+CD25+ Treg细胞表面糖皮质激素诱导的TNFR相关基因(glucocorticoid-induced TNFR-related protein, GITR)的表达与健康对照相比均显著上升. GITR又称TNFRSF18, 为TNF受体超家族成员之一, 静止T细胞呈低水平表达GITR, 而CD4+CD25+调节性T细胞则呈高水平表达; T细胞一旦激活则GITR的表达水平则会上调. CHB患者CD4+CD25+ Treg细胞表面GITR表达增高反映了这些患者CD4+CD25+ Treg处于有抑制功能的活化状态. CD103作为一种黏膜整合素aEb7, 主要结合肝细胞以及胆管上皮细胞上表达的上皮细胞钙黏蛋白(E-cadherin), 有研究报道CD103可控制Treg在表达E-cadherin局部组织的停滞, 有助于利什曼原虫慢性感染的发生[13], 目前还发现, 在肝脏局部发现有大量CD103+ T细胞的浸润[14], Xu et al[4]报道在CHB患者肝脏中有大量的CD4+CD25+ Treg浸润, 这可能与CHB患者肝脏局部免疫抑制有关. 而我们的研究发现在CHB患者循环中与健康人相比其CD4+CD25+ Treg高表达CD103分子, 提示CD103的高表达可能与CHB患者肝脏局部CD4+CD25+ Treg浸润有关.
上述的研究明确了CHB患者循环中CD4+CD25+ Treg频率的增高且处于抑制功能的活化状态, 最近也有一些研究证据表明CHB患者中CD4+CD25+ Treg的可抑制HBV患者的CD8+ T细胞对HBV抗原的免疫应答[4,6], 我们在研究中通过磁珠分离去除CHB患者PBMC的CD4+CD25+ Treg后, 对患者PBMC在体外进行HBV core18-27肽多次负载, 发现CD4+CD25+ Treg的去除可显著增强HBV core18-27肽诱导的HBV特异性的CTL数量的增多和IFN-γ分泌, 从而有效上调CHB患者体外的抗HBV的免疫应答. 这一点对于进一步研究CD4+CD25+ Treg在CHB患者免疫发病机制中的作用, 探讨利用去除或干扰CD4+CD25+ Treg功能作为慢性乙型肝炎免疫治疗策略提供了前期试验证据.
最近, Treg细胞尤其是CD4+ CD25+ Treg细胞, 在人类肝脏疾病中的作用逐渐得以认识. 目前认为CD 4 +CD25+ Treg细胞可以控制肝脏炎症的发生及避免肝细胞受到免疫攻击, 但当这种抑制作用发生HBV或HCV感染及肝脏肿瘤发生时, 则有可能导致病毒感染的持续以及肿瘤的进展.
鉴于Treg在肝脏炎症及感染免疫方面的控制作用,关于慢性乙型肝炎患者中Treg表型、功能及作用近年来也是慢性乙型肝炎免疫发病机制方面的研究热点.
对于慢性HBV感染患者外周血中CD4+CD25+ Treg细胞的比例是否升高, 目前仍有争议, 且对于CD4+CD25+ Treg细胞在慢性HBV感染患者免疫发病机制中作用及去除CD4+CD25+Treg细胞后是否能有效增强HBV抗原肽诱导的抗HB V免疫应答尚不确定
本研究进一步明确了CHB患者循环中CD4+ CD25+ Treg频率的增高且处于抑制功能的活化状态, 且体外去除CHB患者PBMC的CD4+ CD25+ Treg后,对患者PBMC在体外进行HB Vcore18-27肽多次负载, 发现CD4+ CD25+ Treg的去除可显著增强HBV core18-27肽诱导的HBV特异性的CTLs数量的增多和IFN-γ分泌,从而有效上调CHB患者体外的抗HBV的免疫应答.
本研究对于进一步研究CD 4 +CD2 5 +Treg在 CHB患者免疫发病机制中的作用,探讨利用去除或干扰CD4+ CD25+Treg功能作为慢性乙型肝炎免疫治疗策略提供了前期试验证据.
本文层次清楚, 论证有据, 方法先进, 对慢性乙型肝炎患者免疫发病机制的研究有一定的指导意义.
编辑: 程剑侠 电编:何基才
| 1. | Kullberg MC, Jankovic D, Gorelick PL, Caspar P, Letterio JJ, Cheever AW, Sher A. Bacteria-triggered CD4(+) T regulatory cells suppress Helicobacter hepaticus-induced colitis. J Exp Med. 2002;196:505-515. [PubMed] |
| 2. | Tsunemi S, Iwasaki T, Imado T, Higasa S, Kakishita E, Shirasaka T, Sano H. Relationship of CD4+CD25+ regulatory T cells to immune status in HIV-infected patients. AIDS. 2005;19:879-886. [PubMed] |
| 3. | Aandahl EM, Michaelsson J, Moretto WJ, Hecht FM, Nixon DF. Human CD4+ CD25+ regulatory T cells control T-cell responses to human immunodeficiency virus and cytomegalovirus antigens. J Virol. 2004;78:2454-2459. [PubMed] |
| 4. | Xu D, Fu J, Jin L, Zhang H, Zhou C, Zou Z, Zhao JM, Zhang B, Shi M, Ding X. Circulating and liver resident CD4+CD25+ regulatory T cells actively influence the antiviral immune response and disease progression in patients with hepatitis B. J Immunol. 2006;177:739-747. [PubMed] |
| 5. | Stoop JN, van der Molen RG, Baan CC, van der Laan LJ, Kuipers EJ, Kusters JG, Janssen HL. Regulatory T cells contribute to the impaired immune response in patients with chronic hepatitis B virus infection. Hepatology. 2005;41:771-778. [PubMed] |
| 6. | Franzese O, Kennedy PT, Gehring AJ, Gotto J, Williams R, Maini MK, Bertoletti A. Modulation of the CD8+-T-cell response by CD4+ CD25+ regulatory T cells in patients with hepatitis B virus infection. J Virol. 2005;79:3322-3328. [PubMed] |
| 7. | Shevach EM, McHugh RS, Piccirillo CA, Thornton AM. Control of T-cell activation by CD4+ CD25+ suppressor T cells. Immunol Rev. 2001;182:58-67. [PubMed] |
| 8. | Sakaguchi S, Sakaguchi N, Shimizu J, Yamazaki S, Sakihama T, Itoh M, Kuniyasu Y, Nomura T, Toda M, Takahashi T. Immunologic tolerance maintained by CD25+ CD4+ regulatory T cells: their common role in controlling autoimmunity, tumor immunity, and transplantation tolerance. Immunol Rev. 2001;182:18-32. [PubMed] |
| 9. | Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol. 2003;4:330-336. [PubMed] |
| 10. | Fontenot JD, Rasmussen JP, Williams LM, Dooley JL, Farr AG, Rudensky AY. Regulatory T cell lineage specification by the forkhead transcription factor foxp3. Immunity. 2005;22:329-341. [PubMed] |
| 11. | Liu W, Putnam AL, Xu-Yu Z, Szot GL, Lee MR, Zhu S, Gottlieb PA, Kapranov P, Gingeras TR, Fazekas de St Groth B. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. J Exp Med. 2006;203:1701-1711. [PubMed] |
| 12. | Seddiki N, Santner-Nanan B, Martinson J, Zaunders J, Sasson S, Landay A, Solomon M, Selby W, Alexander SI, Nanan R. Expression of interleukin (IL)-2 and IL-7 receptors discriminates between human regulatory and activated T cells. J Exp Med. 2006;203:1693-1700. [PubMed] |