修回日期: 2007-04-01
接受日期: 2007-04-28
在线出版日期: 2007-07-18
目的: 研究白细胞介素6(IL-6)对豚鼠近端结肠平滑肌的影响及其机制.
方法: 观察IL-6对结肠收缩的影响; 用河豚毒素(TTX)阻断肠神经后观察不同浓度IL-6对结肠平滑肌收缩的影响; 损伤Cajal 间质细胞(ICC)后观察IL-6对结肠平滑肌收缩的影响.
结果: 在带有ICC的近端结肠纵行肌加入IL-6后, 结肠平滑肌的收缩振幅增加和频率加快, 呈浓度依赖性; 加入TTX后, 收缩的幅度和频率, 同拮抗前相比分别降低和减慢(0.206±0.027 g vs 0.300±0.039 g; 9.770±1.711 s vs 8.483±1.113 s; P<0.01, P<0.05); TTX阻断后加入IL-6(80 µg/L), 振幅增加和频率加快(P<0.01, P<0.05); 破坏结肠ICC, 收缩幅度和频率分别与损伤ICC后加入IL-6无显著性差异(80 µg/L), 而与正常结肠收缩振幅和频率有显著性差异(P<0.01).
结论: IL-6对豚鼠近端结肠平滑肌的收缩活动有兴奋作用, 其兴奋效应主要是通过肠神经元介导. ICC是IL-6对平滑肌兴奋途径的一个不可缺少的中间环节.
引文著录: 吕晓光, 余保平, 徐龙, 吴志轩. 白细胞介素6对豚鼠离体近端结肠平滑肌收缩的影响. 世界华人消化杂志 2007; 15(20): 2205-2209
Revised: April 1, 2007
Accepted: April 28, 2007
Published online: July 18, 2007
AIM: To investigate the effects and mechanism of interleukin-6 on the contraction of colonic smooth muscle.
METHODS: Smooth muscle segments with mucosa were removed from the proximal colon of guinea pigs, and were divided into three groups: group A [interleukin-6 (IL-6) was added to Tyrode's solution], group B (tetrodotoxin and IL-6 added), and group C (interstitial cells of Cajal were specially destroyed by methylene blue incubation and intensive illumination).
RESULTS: The amplitude and frequency of contractions were upregulated by IL-6 in a dose-independent manner. The frequency and amplitude of contractions were decreased when the enteric nerve was blocked by tetrodotoxin (0.206 ± 0.027 g vs 0.300 ± 0.039 g; 9.770 ± 1.711 s vs 8.483 ± 1.113 s; P < 0.01, P < 0.05). Addition of IL-6 (80 µg/L) after blocking with tetrodotoxin increased amplitude and frequency of smooth muscle contraction (P < 0.01, P < 0.05). The contraction of smooth muscle was nearly abolished when interstitial cells of cajal were destroyed by methylene blue incubation and intensive illumination (P < 0.01). Although IL-6 was administered, there was no significant difference in the amplitude and frequency of the contraction of smooth muscle segments when interstitial cells of cajal were destroyed by methylene blue and intensive illumination.
CONCLUSION: IL-6 was able to promote the contraction of colon smooth muscle. The effects of IL-6 on contraction are mainly induced by the enteric nervous system. Interstitial cells of Cajal play an essential role in the activation of smooth muscle contraction by IL-6.
- Citation: Lv XG, Yu BP, Xu L, Wu ZX. Effects of interleukin-6 on the contraction of colonic smooth muscle. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2205-2209
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2205.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2205
胃肠道平滑肌运动受神经内分泌的支配和调节, 同时也受到免疫系统的影响[1]. 在腹泻型肠易激综合征(irritable bowel syndrome, IBS), 术后胃肠动力障碍等患者的血清和消化道中IL-6等炎性因子表达增强. 尤其是在无病理学改变的区域同样出现动力障碍伴炎性因子表达增强[2-3]. 这些研究提示, IL-6可能对胃肠功能失调有直接的影响. 我们观察IL-6对豚鼠近端结肠平滑肌收缩的影响, 并探讨IL-6在肠神经系统, Cajal间质细胞, 平滑肌细胞3个不同的层次的作用机制.
健康豚鼠, 体质量250-300 g, 雌雄不拘, 由湖北省疾病控制中心提供, 喂自来水, 普通颗粒饲料. IL-6购自Research Diagnostics, Inc, 河豚毒素购自中国大连瑞芳公司, 亚甲基蓝(methylene blue)购自中国湘中地质实验研究所. Tyrode液成份包括(mmol/L): NaCl 147.0, KCl 14.0, CaCl2 2.0, MgCl2 1.05, Na2HPO4 1.81, NaH2PO4 0.42, 葡萄糖5.5, pH用NaOH调至7.35-7.4 5.50 mmol/L亚甲基兰采用Tyrode液配制. 张力换能器, RM6240多道生理信号采集处理系统购自成都仪器厂.
本实验共分3组, 前后自身对照: (1)IL-6生理剂量组: IL-6浓度分别为20, 40, 80 µg/L; (2)TTX 10-5 mol/L组+IL-6(20, 40, 80 µg/L); (3)ICC破坏组+IL-6(80 µg/L), 每组18只. 将豚鼠击头放血处死, 剖腹截取距离回盲部3 cm远的近端结肠, 置于Tyrode液中. 漂洗干净, 剪去肌条的黏膜层. 在此过程中持续往Tyrode液通入950 mL/L O2+50 mL/L CO2的混合气体. 肌条的规格: 8 mm×10 mm. 肌条分为2种: (1)带有ICC的近端结肠肌条; (2)破坏ICC的近端结肠肌条. 将肌条与张力换能器相连, 浸没于37℃ Tyrode液中孵育1 h, 待肌条收缩稳定后记录机械性收缩信号. 用化学药物亚甲基兰50 mmol/L+光照50 mW/cm2选择性破坏ICC. 光源采用可调聚光灯, 为可见光. 光波长532.0 nm, 照射在距光源3-5 cm的组织表面, 照射时间5 min. 光照强度用数字测光表测出. 该方法只破坏ICC结构而不破坏肌间神经网及平滑肌细胞[4]. 将豚鼠击头放血死后取近端结肠. 用Tyrode液清洗后将组织平铺于滤纸, 随后将其放入25 g/L戊二醛固定2 h. 切成2 mm×10 mm的肌条, 用1 g/L磷酸缓冲漂洗3次. 随后将其浸入浓度梯度序列酒精中脱水, 通过环氧树脂进行包埋. 1 µm切片使用甲苯胺蓝进行染色, 在光镜下观察黏膜层, 肌层和浆膜层. 超薄切片使用20 mL/L醋酸双氧铀、枸橼酸铅染色20 min. 使用日立H-600透射电镜进行观察.
统计学处理 收缩振幅和周期用mean±SD表示, 采用SPSS统计软件进行分析, 对所得数据采用配对t检验分析, 双侧概率P<0.05, 即有统计学意义.
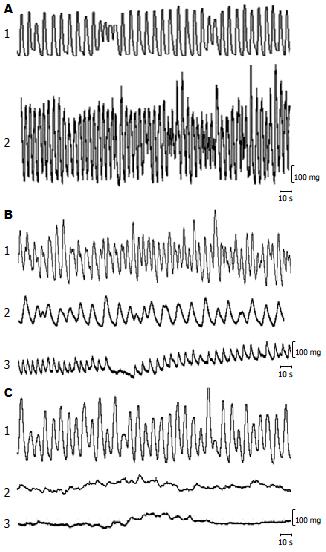
在带有ICC的近端结肠纵行肌(n = 18)孵育后1 h出现稳定的收缩活动. 加入20, 40, 80 µg/L IL-6后结肠平滑肌的收缩振幅分别增加了4.0% (t = -1.116, P>0.05), 24.4%(t = -2.129, P<0.05), 67.3%(t = -10.722, P<0.01). 收缩频率分别加快了6.9%(t = 1.888, P>0.05), 12.2%(t = 2.948, P<0.01), 26.0%(t = 3.715, P<0.01)(表1, 图1).
加入10-5 mol/L TTX阻断肠神经系统前结肠平滑肌(n = 18)收缩的幅度和频率分别为0.300±0.039 g和8.483±1.113 s, 阻断后为0.206±0.027 g, 9.770±1.711 s. 收缩振幅和频率分别下降了31.3%(t = 4.236, P<0.01), 15.2%(t = -2.765, P<0.05). 在TTX阻断肠神经后加入IL-6, 结肠平滑肌的收缩振幅分别增加了-9.7%(t = 1.666, P>0.05), -3.9%(t = 0.289, P>0.05), 13.1%(t = -2.693, P<0.05), 收缩频率增快了3.6%(t = 1.262, P>0.05), 10.3%(t = 1.590, P>0.05), 20.5%(t = 2.974, P<0.01)(表1, 图1).
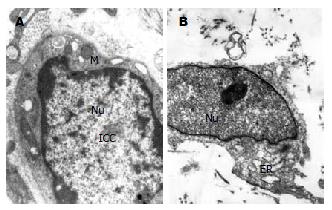
正常ICC电镜下胞内含有大量的线粒体, 内质网, 细胞膜穴样内陷. 在亚甲基兰孵育45 min, 光照10 min后, 电镜下ICC形态变化为胞核肿胀, 染色质均质化; 内质网扩张, 线粒体几乎无法辨认; 细胞膜穴样凹陷减少(提示细胞膜可能受到损害), 胞膜不完整. 而在光照后的结肠中平滑肌细胞几乎没有受到损害. 破坏的ICC通过连续的基质和细胞质特点(线粒体数量)以及和最内层肌细胞之间的联系进行鉴定(图2). 带有ICC的结肠肌条收缩的振幅和频率分别为0.324±0.017 g, 8.541±0.797 s; 用亚甲基兰孵育加光照特异性破坏结肠ICC使结肠(n = 18)收缩幅度和频率分别为0.080±0.048 g和30.830±5.917 s, 分别下降了75.3%(t = 3.792, P<0.01), 72.3%(t = -9.774, P<0.001). 损伤ICC后加入IL-6(80 µg/L)结肠平滑肌收缩振幅和周期分别为0.072±0.020 g和30.167±6.559 s, 与损伤ICC后肌条收缩活动无显著性差异(表2, 图1).
在部分胃肠动力障碍性疾病中, 消化道组织学的改变主要表现为免疫细胞浸润. 这些炎性细胞释放的炎性介质和细胞因子可能介导胃肠动力的改变. 目前研究发现, IBD, IBS, 术后胃肠动力障碍性疾病, 以及轮状病毒感染性腹泻消化道组织均有IL-1β, TNF-α, IL-6等炎性因子的增高. 值得关注的是在部分伴发动力障碍的区域, 无病理学改变却伴有IL-6等增高[2-3,5-6]. 这些研究提示, IL-6对胃肠动力失调可能存在直接的影响. IL-6对胃肠动力的影响及影响机制至今尚未阐明. 目前研究主要针对IL-6对神经细胞兴奋性的影响. Xia et al[7]研究发现, IL-1β, IL-6具有抑制快速型兴奋性突触后电位(excitatory postsynaptic potential, EPSP)和去甲肾上腺素型抑制性突触后电位(inhibitory postsynaptic potential, IPSP)的作用, 从而导致交感神经末稍去甲肾上腺素的释放减少. 而去甲肾上腺素是肠道分泌运动性神经元控制的关键, 推测IL-6等炎性因子增高, 引起肠道腺体分泌和运动亢进, 可能是腹泻型IBS发病基础. 我们发现, IL-6对近端结肠的收缩有直接的兴奋作用. 这一结果提示, IL-6不仅参与了肠道的炎症反应, 而且可能对腹泻型IBS, 分泌性运动性腹泻, 轮状病毒感染性腹泻中肠道运动功能失调有直接的影响.
IL-6对胃肠动力的兴奋机制尚不明确. 李改丽 et al[8]通过免疫组化证实在中枢神经系统中广泛存在着IL-6R, 提示IL-6可能在肠神经元中也存在着相应的受体. 我们研究发现, 在加入TTX阻断肠神经元后, 高浓度的IL-6对结肠收缩的兴奋作用显著下降. 这一结果说明, IL-6的兴奋作用主要是通过兴奋肠神经元来完成的; IL-6可能除了影响兴奋性肠神经元的突触后电位以外还有可能导致肠神经递质的释放或者使相应受体上调从而引起胃肠功能紊乱.
ICC不仅是慢波电位起搏细胞, 同时还是重要的信号传导枢纽. 目前研究发现, ICC的主要功能包括产生起搏电流以及介导神经递质对胃肠平滑肌的影响. 我们发现, IL-6对ICC遭特异性破坏的豚鼠结肠的兴奋作用几乎消失, 初步证实了ICC是炎性介质IL-6对平滑肌的兴奋途径中一个中间环节. ICC与神经元和平滑肌之间的信号传导机制目前尚未明了. Horiguchi et al[9]在电镜研究中发现, ICC与肠神经元存在着突触联系, 与平滑肌细胞之间也存在着广泛的缝隙连接. 这为肠神经元与ICC之间的联系提供了形态学的依据. 最近Daniel et al[10]发现, 在阻断缝隙连接以后, 犬的小肠和结肠的收缩幅度下降. 这提示肠神经对消化道收缩强度调节是通过ICC介导的. 目前研究发现, ICC存在着乙酰胆碱, NO, NK1等受体. 这几种神经递质可以调节ICC起搏电流从而影响胃肠的收缩活动[11-12]. 这提示IL-6可能通过影响神经递质的释放, 进而通过调节ICC起搏电流从而影响结肠平滑肌的收缩活动.
本项研究尚存在一定的局限性. 主要是研究IL-6对豚鼠离体肌条的急性期作用. IL-6对活体的效应以及对机体的长期作用还未明了. 此外上述的胃肠动力障碍性疾病中通常有多种炎性因子的增高[3,13]. 炎性因子之间的相互关系以及多因子对胃肠动力的综合作用尚待进一步研究. 总之, IL-6可以增强豚鼠近端结肠平滑肌的收缩, 其对平滑肌的兴奋效应主要是通过肠神经元介导. ICC是IL-6对平滑肌兴奋途径的一个中间环节. 深入探讨炎性介质IL-6对胃肠动力的影响机制对阐明胃肠动力障碍发病机制有重要意义.
余国萍教授以及吕莉, 尹太郎, 黄杏, 曾彬, 艾耀伟的帮助.
肠易激综合征是一种以腹痛和腹部不适伴有排便异常为特征的肠道功能紊乱性综合征. 胃肠动力异常是该综合征重要的病理生理特点.
目前研究发现胃肠道免疫反应和炎症常常伴有动力异常. 因此探讨炎症因子对胃肠动力的影响对于阐明肠易激综合征等胃肠动力障碍性疾病可能的病理生理机制具有现实的意义.
本文观察了IL-6 对近端结肠平滑肌收缩的影响, 并进一步探讨了其作用机制. 研究内容较新颖, 实验设计较合理, 结果可信, 统计处理较正确, 讨论客观, 有一定的参考价值.
编辑: 程剑侠 电编:张敏
| 2. | Schwarz NT, Kalff JC, Turler A, Speidel N, Grandis JR, Billiar TR, Bauer AJ. Selective jejunal manipulation causes postoperative pan-enteric inflammation and dysmotility. Gastroenterology. 2004;126:159-169. [PubMed] |
| 3. | Dinan TG, Quigley EM, Ahmed SM, Scully P, O'Brien S, O'Mahony L, O'Mahony S, Shanahan F, Keeling PW. Hypothalamic-pituitary-gut axis dysregulation in irritable bowel syndrome: plasma cytokines as a potential biomarker? Gastroenterology. 2006;130:304-311. [PubMed] |
| 4. | Liu LW, Thuneberg L, Huizinga JD. Selective lesioning of interstitial cells of Cajal by methylene blue and light leads to loss of slow waves. Am J Physiol. 1994;266:G485-496. [PubMed] |
| 5. | Gustot T, Lemmers A, Louis E, Nicaise C, Quertinmont E, Belaiche J, Roland S, Van Gossum A, Deviere J, Franchimont D. Profile of soluble cytokine receptors in Crohn's disease. Gut. 2005;54:488-495. [PubMed] |
| 6. | Nakao A, Moore BA, Murase N, Liu F, Zuckerbraun BS, Bach FH, Choi AM, Nalesnik MA, Otterbein LE, Bauer AJ. Immunomodulatory effects of inhaled carbon monoxide on rat syngeneic small bowel graft motility. Gut. 2003;52:1278-1285. [PubMed] |
| 7. | Xia Y, Hu HZ, Liu S, Ren J, Zafirov DH, Wood JD. IL-1beta and IL-6 excite neurons and suppress nicotinic and noradrenergic neurotransmission in guinea pig enteric nervous system. J Clin Invest. 1999;103:1309-1316. [PubMed] |
| 9. | Horiguchi K, Sanders KM, Ward SM. Enteric motor neurons form synaptic-like junctions with interstitial cells of Cajal in the canine gastric antrum. Cell Tissue Res. 2003;311:299-313. [PubMed] |
| 10. | Daniel EE, Thomas J, Ramnarain M, Bowes TJ, Jury J. Do gap junctions couple interstitial cells of Cajal pacing and neurotransmission to gastrointestinal smooth muscle? Neurogastroenterol Motil. 2001;13:297-307. [PubMed] |
| 11. | Ward SM, Sanders KM, Hirst GD. Role of interstitial cells of Cajal in neural control of gastrointestinal smooth muscles. Neurogastroenterol Motil. 2004;16 Suppl 1:112-117. [PubMed] |
| 12. | Huizinga JD, Golden CM, Zhu Y, White EJ. Ion channels in interstitial cells of Cajal as targets for neurotransmitter action. Neurogastroenterol Motil. 2004;16 Suppl 1:106-111. [PubMed] |
| 13. | Kinoshita K, Hori M, Fujisawa M, Sato K, Ohama T, Momotani E, Ozaki H. Role of TNF-alpha in muscularis inflammation and motility disorder in a TNBS-induced colitis model: clues from TNF-alpha-deficient mice. Neurogastroenterol Motil. 2006;18:578-588. [PubMed] |