修回日期: 2006-11-01
接受日期: 2006-11-08
在线出版日期: 2007-01-18
目的: 构建EBV潜伏期膜蛋白基因LMP2A的腺病毒表达载体, 探讨LMP2A表达对胃癌细胞的作用.
方法: RT-PCR扩增获取目的基因LMP2A, 采用AdEasy系统构建携带目的基因的重组腺病毒载体pAd-2A, 脂质体法将重组质粒pAd-2A转染HEK293细胞包装重组腺病毒. 用重组腺病毒感染靶细胞SGC(胃癌细胞), 通过MTT实验、流式细胞分析、激光共聚焦检测目的基因LMP2A表达对靶细胞增殖的影响.
结果: 限制性酶切、PCR及测序鉴定证实, 目的基因LMP2A正确插入重组质粒, HEK293细胞成功包装出具有稳定感染性的重组腺病毒, 命名为vAd-2A, 经测定病毒滴度为3.16×1012 pfu/L. MTT实验、流式细胞分析以及激光共聚焦检测结果显示, 感染腺病毒vAd-2A的SGC细胞增殖旺盛(感染vAd-2A细胞vs感染vAd细胞和未感染病毒细胞, P<0.01), S期细胞比例升高(24 h: 35.2%±5.1% vs 14.0%±3.4%, 13.2%±4.6%, P<0.01; 48 h: 25.6%±4.1% vs 12.9%±2.6%, 12.5%±3.2%, P<0.01), LMP2A可诱导细胞周期调节蛋白cyclinE的表达.
结论: 成功构建了EBV潜伏期膜蛋白基因LMP2A的重组腺病毒表达载体, 并在HEK293细胞中成功包装出重组腺病毒, 同时证实LMP2A可通过诱导cyclinE的表达促进SGC细胞增殖.
引文著录: 高玉, 纪静, 朱伟, 王云, 罗兵. EB病毒潜伏期膜蛋白LMP2A对胃癌细胞增殖的影响. 世界华人消化杂志 2007; 15(2): 108-113
Revised: November 1, 2006
Accepted: November 8, 2006
Published online: January 18, 2007
AIM: To construct recombinant adenovirus expression vector containing Epstein-Barr virus (EBV) latent membrane protein 2A (LMP2A) and investigate the effects of LMP2A on the proliferation of human gastric cancer cell line.
METHODS: The target gene LMP2A was amplified by reverse transcription-polymerase chain reaction (RT-PCR), and the recombinant adenovirus vector carrying LMP2A gene was constructed with AdEasy system. The recombinant adenovirus vector pAd-2A was transfected into HEK293 cells with lipofectamine 2000 to package recombinant adenovirus, and then gastric cancer cells SGC with negative EBV were infected by recombinant adenovirus. The expression of LMP2A and its effect on the proliferation of SGC cells were analyzed by PT-PCR, MTT assay, fluorescence activated cell sorting (FACS) and confocal microscopy.
RESULTS: The recombinant adenovirus vector pAd-2A was successfully constructed and identified by PCR, restrictive enzyme analysis, and DNA sequencing. The recombinant adenovirus vAd-2A packaged by HEK293 cells had stable infectivity. The virus titer was 3.16×1012 pfu/L. MTT assay, FACS and confocal microscopy showed that vAd-2A transfection significantly increased the proliferation of SGC cells (P < 0.01). The ratio of S-phase cells was markedly elevated after vAd-2A transfection in comparison with that after vAd transfection and non-transfection (24 h: 35.2% ± 5.1% vs 14.0% ± 3.4%, 13.2% ± 4.6%, P < 0.01; 48 h: 25.6% ± 4.1% vs 12.9% ± 2.6%, 12.5% ± 3.2%, P < 0.01). The expression of Cyclin E protein was also induced by LMP2A.
CONCLUSION: The recombinant adenovirus vector carrying EBV LMP2A gene is constructed successfully. Meanwhile, it is confirmed that LMP2A may promote the proliferation of SGC cells by induction of Cyclin E expression.
- Citation: Gao Y, Ji J, Zhu W, Wang Y, Luo B. Influence of Epstein-Barr virus latent membrane protein 2A on the proliferation of human gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2007; 15(2): 108-113
- URL: https://www.wjgnet.com/1009-3079/full/v15/i2/108.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i2.108
EB病毒(Epstein-Barr virus, EBV)属人类g疱疹病毒, 是传染性单核细胞增多症(IM)的病原体, 并与鼻咽癌(NPC)、Burkitt淋巴瘤(BL)、胃癌(GC)等多种肿瘤的发生有关[1-5]. 近年来研究表明, 体内外EBV潜伏感染的B细胞中均能检测到潜伏膜蛋白LMP2A的表达, 约50%的EBV相关胃癌LMP2A阳性, 而且LMP2A是鼻咽癌、淋巴瘤等肿瘤细胞稳定表达的少数EBV保守抗原之一. 此外LMP2A具有潜在的T细胞激活表位, 能介导CTL发挥作用[6-7], 因此深入探讨LMP2A的生物活性对于揭示EBV致病机制以及开展EBV相关肿瘤的特异性治疗具有重要意义. 本研究通过缺陷型腺病毒介导LMP2A基因在胃癌细胞中的表达, 探讨LMP2A表达对细胞生物学行为的影响.
携带GFP报告基因的腺病毒穿梭质粒pAdTrack-CMV, E1区和E3区缺失的复制缺陷5型腺病毒骨架质粒pAdeasy-1以及大肠杆菌BJ5183和DH10B均由中国疾病控制中心性病艾滋病中心病毒免疫室邵一鸣教授惠赠. 逆转录试剂盒购自美国Promega公司, 限制性核酸内切酶PacⅠ和PmeⅠ为英国NEB公司产品, 快速腺病毒感染性滴度(TCID50)检测试剂盒为北京本元正阳公司产品, TGF-b购自北京中杉金桥试剂公司. 人胚肾293细胞和胃癌细胞(SGC)为本实验室保存, EBV阳性LCL细胞OB系日本鸟取大学医学部生体情报学教室西连寺刚教授惠赠. 上述细胞均用含100 mL/L胎牛血清、100 kU/L青链霉素的DMEM, 37℃, 50 mL/L CO2的培养箱中培养.
根据GenBank提供的LMP2A基因编码序列, DNAstar软件设计扩增LMP2A读码框架的特异性引物, 并在上、下游引物的5'端分别引入BglⅡ和EcoRⅤ酶切位点(下划线部分)和保护碱基(斜体部分). 上游引物序列为: 5'-GGCAGATCTATGGGGTCCCTAGAAATGGTG-3', 下游引物序列为: 5'-GCGATATCTTATACAGTGTTGCGATATGG-3', 扩增产物长度为1545 bp. TRIzol法提取EBV阳性OB细胞总RNA, 按照逆转录试剂盒要求的标准条件合成cDNA用作PCR模板; 扩增产物于12 g/L琼脂糖凝胶中电泳, 紫外透射仪下观察结果. 用BglⅡ和EcoRⅤ双酶切LMP2A的PCR产物和穿梭质粒pAdTrack-CMV, 纯化后连接形成重组质粒pAd-CMV-2A. 重组质粒pAd-CMV-2A经PmeⅠ线性化和CIAP去磷酸化后与骨架质粒pAdEasy-1共转化工程菌BJ5183进行同源重组, 重组质粒命名pAd-2A; 同时构建不含目的基因的对照质粒pAd, 通过PCR扩增、限制性酶切和测序分析对重组质粒和对照质粒进行鉴定. 用脂质体法将PacⅠ酶切线性化的重组质粒pAd-2A和质粒对照pAd分别转染293细胞, 48 h后荧光显微镜观察细胞是否有荧光出现, 在观察到细胞荧光出现5-7 d后收获细胞, 1000 r/min离心10 min弃上清, 细胞沉淀重悬于2 mL磷酸盐缓冲液(PBS)中, -80℃/37℃反复冻融3次. 1000 r/min离心10 min, 取1/3上清接种至50%-70%汇合的293细胞, 约1/3-1/2的293细胞产生病变效应时, 离心收集细胞, 重复上述步骤2-3 次, 所获重组腺病毒命名为vAd-2A, 载体对照命名为vAd. 用快速腺病毒感染性滴度(TCID50)检测试剂盒测定病毒滴度, 操作按说明书进行. SGC细胞感染前1 d传代, 当细胞生长达60%汇合时, 每25 cm2培养瓶接种150 mL病毒悬液, 24 h后换维持液, 荧光显微镜下逐日观察绿色荧光蛋白的表达以确定感染效率.
1.2.1 RT-PCR检测LMP2A的表达: 分别提取未感染腺病毒组、感染vAd-2A组以及感染vAd组靶细胞SGC总RNA, 用DNase消化处理排除DNA的干扰, RT-PCR检测目的基因LMP2A的转录表达, 所用引物和探针序列参考文献[8-9]设计合成, PCR产物为280 bp. 同时以DNase消化处理的RNA为模板进行PCR检测, 证实RNA中确无DNA污染. PCR产物于20 g/L琼脂糖凝胶中电泳后转印至Hybond-N+尼龙膜, 与地高辛标记的LMP2A特异性探针进行杂交检测, 以EBV阳性OB细胞作为阳性对照.
1.2.2 MTT检测细胞增殖: 制备5×107个/L的SGC单细胞悬液接种96孔细胞培养板, 每孔100 mL, 细胞过夜贴壁后接种腺病毒1.5 mL, 培养液中加转化生长因子b1(transforming growth factor beta, TGF-b1)至终浓度为10 mg/L. 试验设未感染腺病毒组、感染vAd-2A组以及感染vAd组, 每组各时间段均设3个平行孔, 分别于接种病毒0, 24, 48, 72, 96, 120 h时加10 mL 5 g/L MTT, 37℃继续培养4 h, 每孔加0.5 g/L DMSO 150 mL终止反应, 将细胞悬液充分混匀后, 用酶标检测仪在波长490 nm下读取吸光度(A)值. 以无细胞培养液孔作为空白对照, 取3次试验均值.
1.2.3 流式细胞分析S期细胞的比例: SGC细胞生长达80%汇合时接种重组腺病毒vAd-2A和病毒对照vAd, 腺病毒感染组及未感染病毒组同样用TGF-b1处理, 分别于感染后48 h和72 h收集所有悬浮及贴壁细胞, 1000 r/min离心5 min弃培养基, PBS洗细胞1次, 用少量PBS重悬细胞, 加预冷750 mL/L乙醇4 mL混匀, 4℃固定18 h. 然后将细胞悬浮于含碘化丙啶(PI)的染色培养基中冰上放置5 min, PBS洗细胞2次, 离心后细胞沉淀重悬于染色培养基1 mL中, 用流式细胞仪检测S期细胞的比例, Multipcycle分析软件对实验数据进行统计学处理和分析.
1.2.4 细胞周期蛋白Cyclin E表达的检测: 靶细胞爬片培养形成单层后接种病毒, 24 h时取出用40 g/L甲醛固定30 min, PBS洗3次; 3 g/L Triton-100室温作用30 min, PBS洗1次. 用山羊血清封闭30 min, 然后加鼠抗Cyclin E mAb(PBS 1:200稀释)37℃孵育1-2 h, PBS洗3次. 加罗丹明标记的羊抗鼠IgG(PBS 1:200稀释) 37℃孵育1-2 h, PBS充分洗涤后, 直接在激光共聚焦显微镜下观察结果并拍照.
统计学处理 MTT检测和流式细胞仪分析分别重复3次, 结果表示为平均值±标准差(mean±SD), 应用SAS6.12统计分析软件进行t检验, P<0.01有统计学意义.
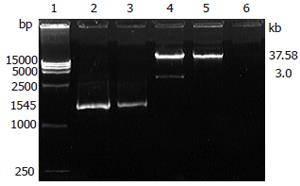
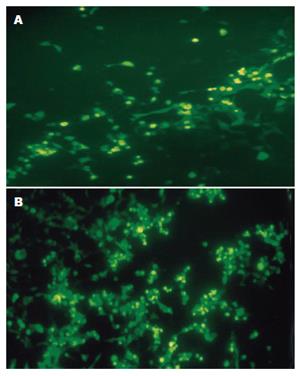
重组质粒经PacⅠ酶切后, 形成3.0 kb和37.6 kb的2条电泳条带, 提示pAdTrack-CMV-2A和骨架质粒pAdEasy-1的重组发生在质粒的右臂和左臂区. 以重组质粒为模板进行PCR扩增, 可观察到大小约1545 bp的PCR产物, 与预期值一致(图1). 正反双向测序结果显示重组质粒pAd-2A插入片断方向正确, 核酸序列无误, 读码框架完整. 将重组质粒pAd-2A和对照质粒pAd用PacⅠ线性化后转染293细胞, 48 h后在荧光显微镜下可观察到细胞内的绿色荧光, 表明质粒转染成功, 外源基因开始表达(图2). 随之阳性细胞逐渐增多, 且荧光增强, 7 d后约1/3细胞出现圆缩、肿胀脱落等细胞病变效应时收获细胞, -80℃/37℃冻融3次, 离心除去细胞碎片. 取细胞裂解上清接种新的293细胞, 细胞出现病变效应时收集细胞, 如此反复3次, 出现细胞病变效应的时间越来越短, 表明病毒滴度逐渐升高, 且感染性增强, 快速腺病毒感染性滴度检测试剂盒测得腺病毒滴度为3.16×1012 pfu/L.
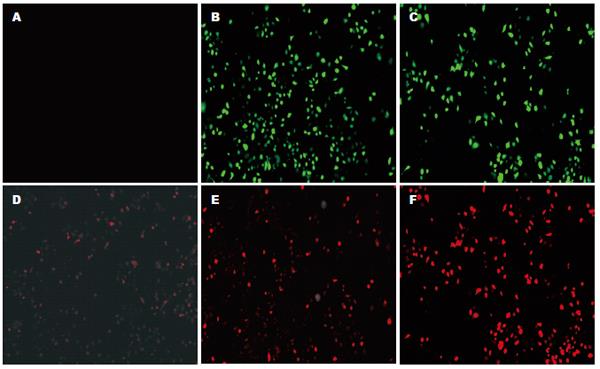
靶细胞感染重组腺病毒48 h后可在荧光显微镜下观察到绿色荧光, 4 d时感染率达90%, 提示重组腺病毒可有效感染靶细胞(图3). 提取重组腺病毒感染靶细胞SGC总RNA, DNA酶充分消化后RT-PCR结合Southern-blotting杂交检测目的基因LMP2A表达. 结果显示, 接种重组腺病毒的靶细胞检测到目的基因LMP2A的表达, 可观察到280 bp的特异性扩增条带, 而载体对照和未感染腺病毒的靶细胞则无此条带, 表明重组腺病毒能在SGC细胞有效转录(图4).
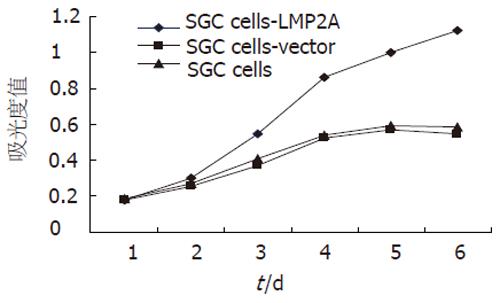
接种vAd-2A组SGC细胞吸光度值与接种vAd组SGC细胞和未接种病毒SGC细胞吸光度值比较前3 d差别较小, 从第4天起差别逐渐增大, 差别有统计学意义(P<0.01); 第6天SGC细胞和接种vAd的SGC细胞增殖明显减弱, 而接种vAd-2A组SGC细胞仍表现出较强的增殖能力(图5).
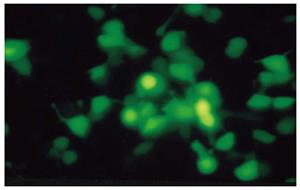
EBV对宿主细胞的感染有潜伏感染和裂解期感染两种类型, 肿瘤组织中EBV主要以潜伏感染的形式存在[10]. 体内外EBV潜伏感染的B细胞中均能检测到潜伏膜蛋白LMP2A的表达, 且LMP2A是除BL外大多数EBV相关肿瘤细胞中稳定表达的EBV抗原之一, 提示LMP2A在维持病毒潜伏感染状态和EBV相关肿瘤的发病中可能发挥一定的作用. 近几年有体内外实验表明LMP2A可影响B细胞及上皮细胞的生长、分化和凋亡, 并对LMP2A调节细胞生长的可能机制进行了初步探讨, 但LMP2A对细胞周期的调节机制尚未明确[11-14]. 本研究成功构建了表达LMP2A的重组腺病毒载体, 经HEK293细胞包装获得了具有感染性的重组腺病毒vAd-2A, PCR-Southern-blotting结果表明, 重组腺病毒能在SGC细胞有效转录表达. 本研究MTT检测结果显示, 接种重组腺病毒vAd-2A组SGC细胞增殖与接种病毒对照vAd组SGC细胞和未接种病毒细胞增殖比较前3 d无明显差异, 从第4天起未接种病毒的SGC细胞和接种vAd的SGC细胞增殖明显减弱, 而接种vAd-2A组SGC细胞至第6天时仍表现出较强的增殖能力. 流式细胞技术结果显示, 感染vAd-2A的胃癌细胞S期比例明显升高, 表明LMP2A可促进胃癌细胞增殖. 细胞殖和凋亡受多种细胞周期蛋白调控, 细胞周期蛋白Cyclin E是G1期特异性蛋白, 在细胞由G0→S期中起主要作用, 已发现的某些肿瘤组织如胃癌等可检测到Cyclin E基因扩增或高表达, 与肿瘤进展相关, 是候选的癌基因[15-18]. 另有研究者发现, 在胃癌中存在Cyclin D1, Cyclin E的过度表达, 从而导致G1期时间缩短或加速G1期的进程, 甚至可以突破检测点的监测直接进入S期, 使S期比值升高[19-20]. 本实验激光共聚焦扫描检测结果显示, 未接种病毒的SGC细胞少有Cyclin E阳性细胞, 感染重组腺病毒vAd-2A组表达Cyclin E的SGC细胞数量明显多于接种病毒对照vAd的SGC细胞, 且荧光信号更强, 提示LMP2A可诱导胃癌细胞Cyclin E的过度表达. LMP2A可通过诱导Cyclin E表达, 促进细胞由G1期进入S期, 引起细胞异常增生.
LMP2A不仅促进SGC细胞增殖, 也可有效抑制TGF-b1诱导的细胞凋亡. TGF-b1是一种多功能细胞因子, 在调节细胞的生长分化方面起重要作用, 且是一种有效的免疫调节剂, 能抑制大多数T、B细胞系在体外的增殖和分化[21-23]. 我们在MTT实验和流式细胞分析中加入TGF-b1处理SGC细胞, 结果证实LMP2A可以有效抑制TGF-b1诱导的SGC细胞的凋亡. Fukuda et al[24]亦报道, LMP2A通过激活PI-K/AKt途径抑制TGF-b1诱导的BL细胞系和胃印戒细胞癌细胞系的凋亡, 可在一定程度上增强TGF-b1处理后细胞的生存能力. LMP2A具有多种生物学活性, 在B细胞中可抑制诱导EBV裂解复制的B细胞受体信号的传导, 从而抑制病毒增殖, 维持病毒的潜伏, 虽然LMP2A并无体外转化B细胞的作用, 但能抑制B细胞分化[25]. 实验表明, LMP2A能诱导上皮细胞发生转化, Scholle et al[26]报道, LMP2A转染人角质化上皮细胞株HaCaT后, 能引起细胞增殖及转化, 并可在裸鼠中形成肿瘤. 鉴于LMP2A可在大多数EBV相关肿瘤中表达, 因此推测LMP2A可通过多种途径影响细胞周期, 促进细胞周期紊乱, 引起细胞异常增生, 在EBV相关肿瘤的发生中发挥重要作用. EBV与胃癌的相关性近年来已得到确认, 世界各地约2%-16%的胃癌EBV阳性, EBVaGC中几乎所有癌细胞EBV阳性, 研究表明, EBVaGC来源于EBV感染细胞的单克隆增生, EBV感染发生在胃癌形成早期, EBV在癌症发生中起重要作用[27-31]. 在EBVaGC中, 公认的EBV转化基因LMP1并不表达, 而约50%的EBVaGC表达LMP2A, LMP2A在EBV相关胃癌发生发展中的作用受到广泛关注. 本研究成功制备了能在靶细胞有效转录表达目的基因的重组腺病毒vAd-2A, 并证实LMP2A在胃癌细胞中可通过诱导Cyclin E表达而促进细胞增生, 为深入探讨LMP2A的作用途径提供了实验基础.
EB病毒(EBV)属人类γ疱疹病毒, 是传染性单核细胞增多症(IM)的病原体, 并与鼻咽癌(NPC)、Burkitt淋巴瘤(BL)、胃癌(GC)等多种肿瘤的发生有关. 研究表明, EBV潜伏期基因和部分早期基因的表达与EBV相关肿瘤的发生密切相关.
近年来有研究表明LMP2A可影响B细胞及上皮细胞的生长、分化和凋亡, 并对LMP2A调节细胞生长的可能机制进行了初步探讨, 但LMP2A对细胞周期的调节机制尚未明确.
本研究成功制备了能在靶细胞有效转录表达目的基因的重组腺病毒vAd-2A, 通过腺病毒将目的基因LMP2A导入靶细胞胃癌细胞, 通过MTT实验、流式细胞分析以及激光共聚焦检测证实, LMP2A在胃癌细胞中可通过诱导cyclin E表达而促进细胞增生.
本文为深入探讨LMP2A的作用途径提供了实验基础, 为EBV相关胃癌的发生机制以及未来采用免疫学方法治疗和预防EBV相关肿瘤提供理论依据.
1 LMP2A: 潜伏期膜蛋白2A, EBV编码, 由2.3 kb mRNA编码, 起始于EBV线性基因组的第166607位核苷酸, 由U5区的1个外显子和U1区的8个外显子组成, 在多种肿瘤中可检测到LMP2A的表达.
2 Cyclin E: 细胞周期蛋白E, 可促进细胞进入S 期, 在细胞周期由G1→S 期的转换中是主要的限速因子之一, 很可能在细胞分裂周期中起中心控制作用.
本研究进行了LMP2A蛋白转染促进胃癌细胞系增殖并诱导CyclinE表达的研究, 对于LMP2A蛋白的作用机制进行了初步的研究, 课题设计较为合理, 对于LMP2A在肿瘤中的作用有一定的指导意义.
电编: 李琪 编辑: 潘伯荣
| 1. | Masucci MG, Ernberg I. Epstein-Barr virus: adaptation to a life within the immune system. Trends Microbiol. 1994;2:125-130. [PubMed] [DOI] |
| 2. | Cohen JI. Epstein-Barr virus infection. N Engl J Med. 2000;343:481-492. [PubMed] [DOI] |
| 3. | Niedobitek G, Meru N, Delecluse HJ. Epstein-Barr virus infection and human malignancies. Int J Exp Pathol. 2001;82:149-170. [PubMed] [DOI] |
| 4. | Delecluse HJ, Hammerschmidt W. The genetic approach to the Epstein-Barr virus: from basic virology to gene therapy. Mol Pathol. 2000;53:270-279. [PubMed] [DOI] |
| 5. | Young LS, Dawson CW, Eliopoulos AG. The expression and function of Epstein-Barr virus encoded latent genes. Mol Pathol. 2000;53:238-247. [PubMed] [DOI] |
| 6. | Konishi K, Maruo S, Kato H, Takada K. Role of Epstein-Barr virus-encoded latent membrane protein 2A on virus-induced immortalization and virus activation. J Gen Virol. 2001;82:1451-1456. [PubMed] [DOI] |
| 7. | Murray RJ, Kurilla MG, Brooks JM, Thomas WA, Rowe M, Kieff E, Rickinson AB. Identification of target antigens for the human cytotoxic T cell response to Epstein-Barr virus (EBV): implications for the immune control of EBV-positive malignancies. J Exp Med. 1992;176:157-168. [PubMed] [DOI] |
| 8. | Luo B, Murakami M, Fukuda M, Fujioka A, Yanagihara K, Sairenji T. Characterization of Epstein-Barr virus infection in a human signet ring cell gastric carcinoma cell line, HSC-39. Microbes Infect. 2004;6:429-439. [PubMed] [DOI] |
| 9. | Luo B, Wang Y, Wang XF, Liang H, Yan LP, Huang BH, Zhao P. Expression of Epstein-Barr virus genes in EBV-associated gastric carcinomas. World J Gastroenterol. 2005;11:629-633. [PubMed] [DOI] |
| 10. | Takano Y, Kato Y, Saegusa M, Mori S, Shiota M, Masuda M, Mikami T, Okayasu I. The role of the Epstein-Barr virus in the oncogenesis of EBV(+) gastric carcinomas. Virchows Arch. 1999;434:17-22. [PubMed] [DOI] |
| 11. | Portis T, Longnecker R. Epstein-Barr virus LMP2A interferes with global transcription factor regulation when expressed during B-lymphocyte development. J Virol. 2003;77:105-114. [PubMed] [DOI] |
| 12. | Ikeda A, Merchant M, Lev L, Longnecker R, Ikeda M. Latent membrane protein 2A, a viral B cell receptor homologue, induces CD5+ B-1 cell development. J Immunol. 2004;172:5329-5337. [PubMed] [DOI] |
| 13. | Engels N, Merchant M, Pappu R, Chan AC, Longnecker R, Wienands J. Epstein-Barr virus latent membrane protein 2A (LMP2A) employs the SLP-65 signaling module. J Exp Med. 2001;194:255-264. [PubMed] [DOI] |
| 14. | Swart R, Ruf IK, Sample J, Longnecker R. Latent membrane protein 2A-mediated effects on the phosphatidylinositol 3-Kinase/Akt pathway. J Virol. 2000;74:10838-10845. [PubMed] [DOI] |
| 15. | Ohtsubo M, Theodoras AM, Schumacher J, Roberts JM, Pagano M. Human cyclin E, a nuclear protein essential for the G1-to-S phase transition. Mol Cell Biol. 1995;15:2612-2624. [PubMed] [DOI] |
| 16. | Akama Y, Yasui W, Yokozaki H, Kuniyasu H, Kitahara K, Ishikawa T, Tahara E. Frequent amplification of the cyclin E gene in human gastric carcinomas. Jpn J Cancer Res. 1995;86:617-621. [PubMed] [DOI] |
| 17. | Ishii H, Gobé G, Kawakubo Y, Sato Y, Ebihara Y. Interrelationship between Epstein-Barr virus infection in gastric carcinomas and the expression of apoptosis-associated proteins. Histopathology. 2001;38:111-119. [PubMed] [DOI] |
| 18. | Herrera-Goepfert R, Akiba S, Koriyama C, Ding S, Reyes E, Itoh T, Minakami Y, Eizuru Y. Epstein-Barr virus-associated gastric carcinoma: Evidence of age-dependence among a Mexican population. World J Gastroenterol. 2005;11:6096-6103. [PubMed] [DOI] |
| 19. | Spruck CH, Won KA, Reed SI. Deregulated cyclin E induces chromosome instability. Nature. 1999;401:297-300. [PubMed] [DOI] |
| 20. | Keyomarsi K, Herliczek TW. The role of cyclin E in cell proliferation, development and cancer. Prog Cell Cycle Res. 1997;3:171-191. [PubMed] [DOI] |
| 21. | Massagué J. TGF-beta signal transduction. Annu Rev Biochem. 1998;67:753-791. [PubMed] [DOI] |
| 22. | Inman GJ, Allday MJ. Apoptosis induced by TGF-beta 1 in Burkitt's lymphoma cells is caspase 8 dependent but is death receptor independent. J Immunol. 2000;165:2500-2510. [PubMed] [DOI] |
| 23. | Yanagihara K, Tsumuraya M. Transforming growth factor beta 1 induces apoptotic cell death in cultured human gastric carcinoma cells. Cancer Res. 1992;52:4042-4045. [PubMed] |
| 24. | Fukuda M, Longnecker R. Latent membrane protein 2A inhibits transforming growth factor-beta 1-induced apoptosis through the phosphatidylinositol 3-kinase/Akt pathway. J Virol. 2004;78:1697-1705. [PubMed] [DOI] |
| 25. | Longnecker R, Miller CL, Miao XQ, Marchini A, Kieff E. The only domain which distinguishes Epstein-Barr virus latent membrane protein 2A (LMP2A) from LMP2B is dispensable for lymphocyte infection and growth transformation in vitro; LMP2A is therefore nonessential. J Virol. 1992;66:6461-6469. [PubMed] |
| 26. | Scholle F, Bendt KM, Raab-Traub N. Epstein-Barr virus LMP2A transforms epithelial cells, inhibits cell differentiation, and activates Akt. J Virol. 2000;74:10681-10689. [PubMed] [DOI] |
| 27. | Takada K. Epstein-Barr virus and gastric carcinoma. Mol Pathol. 2000;53:255-261. [PubMed] [DOI] |
| 28. | Imai S, Koizumi S, Sugiura M, Tokunaga M, Uemura Y, Yamamoto N, Tanaka S, Sato E, Osato T. Gastric carcinoma: monoclonal epithelial malignant cells expressing Epstein-Barr virus latent infection protein. Proc Natl Acad Sci U S A. 1994;91:9131-9135. [PubMed] [DOI] |
| 29. | Shibata D, Weiss LM. Epstein-Barr virus-associated gastric adenocarcinoma. Am J Pathol. 1992;140:769-774. [PubMed] |
| 30. | Rowlands DC, Ito M, Mangham DC, Reynolds G, Herbst H, Hallissey MT, Fielding JW, Newbold KM, Jones EL, Young LS. Epstein-Barr virus and carcinomas: rare association of the virus with gastric adenocarcinomas. Br J Cancer. 1993;68:1014-1019. [PubMed] [DOI] |
| 31. | Begnami MD, Montagnini AL, Vettore AL, Nonogaki S, Brait M, Simoes-Sato AY, Seixas AQ, Soares FA. Differential expression of apoptosis related proteins and nitric oxide synthases in Epstein Barr associated gastric carcinomas. World J Gastroenterol. 2006;12:4959-4965. [PubMed] [DOI] |