修回日期: 2007-05-01
接受日期: 2007-05-22
在线出版日期: 2007-07-08
目的: 探讨人乳头状病毒(HPV)18, 31, 45E7 3个高危基因亚型在新疆哈萨克族(哈族)食管癌中的感染率及其相关性.
方法: 采用聚合酶链反应(PCR)技术检测HPV-18, 31, 45E7基因在316例哈族食管癌中的感染情况. 并随机抽取PCR产物进行测序来验证PCR结果.
结果: HPV18, 31和45E7基因亚型在食管癌中阳性率分别为25.3%(80/316), 14.2%(45/316)和7.3%(23/316), 其基因型分布与年龄、性别均无关. HPV31, 45E7基因阳性率在组织病理学分级上无统计学意义. HPV18基因型分布在中低分化食管鳞状细胞癌中的检出率明显高于高分化食管鳞癌(29.6% vs 17.7%, χ2 = 5.398, P<0.05).
结论: HPV18型是新疆哈族食管癌的主要高危亚型之一, 其基因型分布与食管癌分化程度有关; HPV31, 45亚型可能不是新疆哈族食管癌最主要的高危亚型.
引文著录: 杨兰, 陈玲, 孙振柱, 张海洋, 田秀云, 齐妍, 朱敬, 杨磊, 秦江梅, 李锋. 新疆哈萨克族食管癌中HPV感染状况分析. 世界华人消化杂志 2007; 15(19): 2114-2119
Revised: May 1, 2007
Accepted: May 22, 2007
Published online: July 8, 2007
AIM: To detect the infection rate of three high-risk human papillomavirus (HPV) DNA gene subtypes (HPV18, 31 and 45E7) in Xinjiang Kazakh esophageal carcinoma and their association with esophageal carcinoma.
METHODS: We detected HPV18, 31 and 45E7 infections in 316 Kazakh esophageal carcinoma cases by polymerase chain reaction (PCR), and validated them by sequencing PCR products randomly selected from the 316 samples.
RESULTS: The positive rate of HPV18, 31 and 45E7 in Kazakh esophageal carcinoma was 25.3% (80/316), 14.2% (45/316) and 7.3% (23/316), respectively. Genotype distribution had no correlation with age or gender; however, there was a significant difference between moderate-to-low-differentiation esophagus squamous cell carcinoma and high-differentiation esophagus squamous cell carcinoma with HPV18 infection (29.6% vs 17.7%, χ2 = 5.398, P < 0.05).
CONCLUSION: HPV18E7 infection may be important for the development of esophageal carcinoma and be associated with the degree of differentiation of Kazakh esophageal carcinoma. HPV31 and 45 are not important high-risk factors in the development of Kazakh esophageal carcinomas in Xinjiang province.
- Citation: Yang L, Chen L, Sun ZZ, Zhang HY, Tian XY, Qi Y, Zhu J, Yang L, Qin JM, Li F. Analysis of human papillomavirus DNA infection in Kazakh esophageal carcinomas in Xinjiang province. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2114-2119
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2114.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2114
食管癌是常见的十大恶性肿瘤之一, 其发病率有地理区域及民族、种族差异, 中国亦属于食管癌高发国家. 位于中国北部的新疆哈萨克族(哈族)是食管癌的高发民族, 其食管癌死亡率达155.9/106, 高于我国平均水平15.23/106[1]. 人乳头状瘤病毒(HPV)经研究被认为是宫颈癌的高危因素, 近年来又有研究者[2-3]提出HPV可能是食管癌病因学的重要因素之一. 但其致瘤机制尚未完全阐明. 不同的研究表明食管癌HPV感染具有区域性, 民族差异性, 且感染率差异很大. 据报道[2]HPV16, 18, 31, 45基因型是宫颈癌的主要高危亚型中的4个, 我们实验室前期曾检测HPV16型在新疆哈族食管癌中的感染率(41%), 本研究采用PCR技术对新疆哈萨克族食管癌患者HPV18, 31, 45感染情况进行检测和分析.探讨HPV18, 31, 45亚型在哈族食管癌中所处地位及与哈族食管癌病因学的相关性.
1980/2005年收集的新疆维吾尔自治区人民医院、伊犁州友谊医院、新华医院、伊犁州奎屯医院的哈萨克族食管癌手术切除的石蜡组织标本316例, 男188例, 女128例, 患病年龄35-79(平均53)岁, 经40 g/L甲醛固定、石蜡包埋, 做常规病理组织学诊断存档蜡块. 4 μm厚蜡块1张做HE染色, 5-10 μm厚10张抽提DNA. 含HPV18, 31, 45全长的质粒分别由德国癌症研究中心Dr. zur Hausen博士, 美国马里兰州Digene公司Attila Lorincz教授, 德国海德堡大学Ethel-Michele de Villers博士惠赠. 大肠杆菌菌株DH5α由本室保存、提供. BioRadicyclePCR仪、BioRad凝胶呈像仪、电泳仪等; 引物及PCR试剂均购自上海Sangon公司. 引物序列参照文献[4], 引物由上海生工生物工程公司合成, 引物序列如表1.
| 引物名称 | 引物序列 | 扩增长度 |
| HPV18E7 For | 5'-AAG AAA ACG ATG AAA TAG ATG GA-3' | 104 bp |
| HPV18E7Rev | 5'-GGC TTC ACA CTT ACA ACA CA-3' | |
| HPV31E7 For | 5'-GGG CTC ATT TGG AAT CGT GTG-3' | 100 bp |
| HPV31E7Rev | 5'-AAC CAT TGC ATC CCG TCC CC-3' | |
| HPV45E7 For | 5'-CCG ACG AGC CGA ACC ACA G-3' | 97 bp |
| HPV45E7Rev | 5'-TCT AAG GTC CTC TGC CGA GC-3' | |
| β-globin For | 5'-CAG ACA CCA TGG TGC ACC TGA C-3' | 210 bp |
| β-globin Rev | 5'-CCA ATA GGC AGA GAG AGT CAG TG -3' |
所有食管癌均做常规HE染色, 由2名病理学专家对HE染色切片进行组织学观察和复诊并分型. 食管癌病理诊断标准参照《肿瘤病理学分类》[5], 经光镜观察所有病例均为食管鳞状上皮细胞癌(ESCC), 按WHO肿瘤组织学标准进行分类: 高分化鳞癌113例, 中、低分化鳞癌203例.
1.2.1 DNA的制备: 石蜡组织DNA的制备[6], 5-10片5 µm厚石蜡包埋组织切片先经二甲苯、37℃脱蜡3次, 每次3-4 h; 然后梯度酒精水化(1000 mL/L乙醇30 min, 950 mL/L乙醇30 min, 750 mL/L乙醇30 min, 1×PBS 10 min顺序水化). 再置于通风厨内, 室温下过夜晾干. 采用直接裂解法制备DNA: 根据标本量多少, 加入适量裂解液, 通常病理标本加入500 µL, 再加入相应量的蛋白酶K(20 g/L), 至终浓度为100 mg/L, 55℃震荡消化过夜(中间可拿出混匀数次有助于消化彻底), 至消化液清亮. 95℃, 10 min灭活蛋白酶K, 10 000 g室温离心15 min,-20℃保存. 用DH5α进行细菌的转化, 摇菌, 运用质粒抽提试剂盒提取HPV18, 31, 45全长质粒DNA.
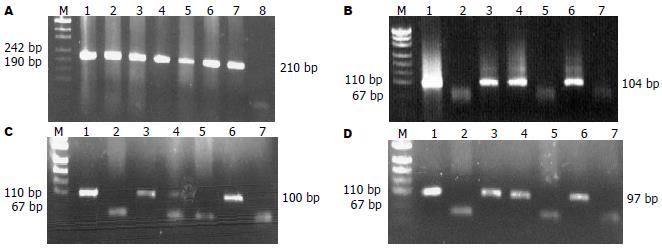
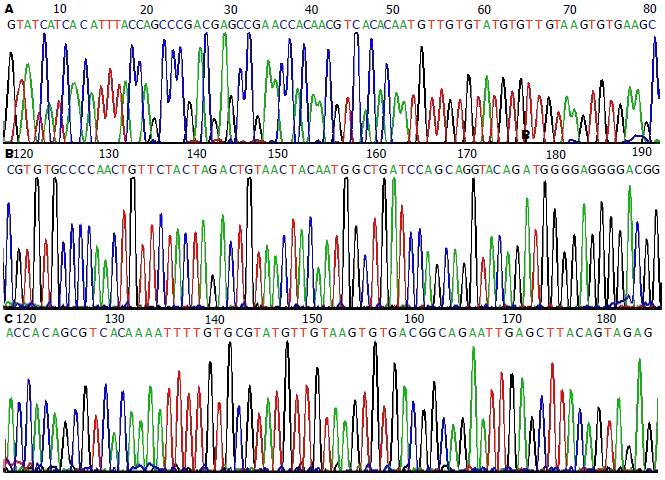
1.2.2 PCR方法检测食管癌组织中β-globin, HPV18, 31, 45E7基因DNA: 以β-globin的PCR作为内对照, 检测DNA的质和量, 剔除β-globin PCR结果阴性或弱阳性标本, 对质和量符合要求的标本进一步行HPV PCR检测. 每一反应均设阳性对照和阴性对照、空白对照; 阳性对照以含HPV18, 31, 45全长质粒DNA为模板, 阴性对照不加模板, 空白对照以水为模板; PCR分别采用25 µL, 40 µL反应体系: β-globin反应体系(25 µL): 10×PCR Buffer 2.5 µL, MgCl2 1.5 µL, 10 mmol dNTP 0.5 µL, 25 µmol Primer For 0.8 µL, 25 µmol Primer Rev 0.8 µL, Taq DNA polymerase 0.3 µL, Template DNA 2 µL, ddH2O 16.6 µL. HPV18, 31, 45反应体系(40 µL): 10×PCR Buffer 4 µL, MgCl2 3.5 µL, 10 mmol dNTP 0.8 µL, 25 µmol Primer For 0.8 µL, 25 µmol Primer Rev 0.8 µL, Taq DNA polymerase 0.4 µL, Template DNA 2 µL, ddH2O 27.7 µL. 将上述各成分加入0.2 mL的96孔PCR反应排管中, 然后在PCR扩增仪上行如下反应: β-globin体系为94℃预变性5 min, 94℃变性30 s, 60℃复性45 s, 72℃延伸60 s, 共35个循环, 然后72℃再延伸10 min. HPV18, 31, 45体系: 95℃预变性2 min, 94℃变性40 s, 退火温度分别为57℃, 57.2℃, 57.5℃复性40 s, 72℃延伸40 s, 共40个循环, 然后72℃再延伸10 min. 取20 µL PCR产物于30 g/L琼脂糖凝胶、150 V电泳(0.5×TBE), 25 min后在紫外线凝胶成像仪下观察结果并拍照. PCR产物由上海基康生物技术公司克隆、纯化并测序, 结果经BLAST基因服务站进行同源性分析.
统计学处理 用SPSS11.5软件进行χ2检验法.
β-globin DNA和HPV18, 31, 45E7基因的DNA样品经PCR扩增后分别产生210 bp目的片段和104 bp, 100 bp, 97 bp产物(图1A-D). 经测序确证是HPV18, 31, 45基因(图2A-C). HPV18, 31, 45E7基因在哈族食管鳞癌病例中的检出率分别为25.3%, 14.2%, 7.3%, 说明HPV18E7与哈族食管鳞癌可能具有一定的相关性, HPV31, 45在哈族食管鳞癌中具有一定的检出率, 但并不是最主要的高危亚型. HPV18, 31, 45E7基因型分布与年龄、性别均无关(P>0.05, 表2), HPV31, 45E7基因阳性率在组织病理学分级上P值分别为0.169, 0.056均大于(P>0.05), 无统计学意义, HPV18E7基因阳性率在中低分化鳞癌组中(29.6%)明显高于高分化鳞癌组(17.7%), 差异有统计学意义(P<0.05), 提示HPV18E7基因与食管癌组织病理分极有相关性.
| n | HPV18E7 | P | HPV31E7 | P | HPV45E7 | P | |||||
| n | % | n | % | n | % | ||||||
| 年龄 | 35-55 | 187 | 41 | 21.9 | 0.095 | 27 | 8.5 | 0.903 | 15 | 4.7 | 0.540 |
| >55 | 129 | 39 | 30.2 | 18 | 14.0 | 8 | 6.2 | ||||
| 性别 | 男 | 188 | 47 | 25 | 0.875 | 29 | 15.4 | 0.261 | 14 | 7.4 | 0.889 |
| 女 | 128 | 33 | 25.8 | 26 | 20.3 | 9 | 7.0 | ||||
| 分化程度 | 高分化 | 113 | 20 | 17.7 | 0.020 | 1 2 | 10.6 | 0.169 | 4 | 3.5 | 0.056 |
| 中-低分化 | 203 | 60 | 29.6a | 33 | 16.3 | 19 | 9.4 | ||||
近年来, 随着对HPV研究的逐步深入, HPV与人类一些肿瘤发生的关系日益受到关注, 据报导HPV在宫颈癌、肛周癌、口腔癌等肿瘤的发生、发展过程中起着重要作用[7-8]. 自1982年Syrjanen发现在40%(24/60)的食管癌中组织学形态改变与生殖道湿疣改变非常相似, 随后他用免疫组化法检测出HPV与食管癌的发病有关, 此后, 研究者采用不同的方法对食管癌中的HPV DNA进行检测, 但不同国家、不同地区、不同民族甚至不同实验组检测阳性率均有较大差别(0%-67%)[9-16].
HPV是一组体积较小的双链DNA病毒, 根据其是否致癌分为高危型和低危型两种. 低危型如HPV6, 11型, 高危型如HPV16, 18, 31, 45等型. HPV16, 18型是子宫颈鳞状上皮细胞癌的最主要的两个高危亚型, 其次是HPV31, 45, 33等, HPV因其严重的危害性而日益成为国内外学者研究的重点. 近年来研究表明HPV16, 18型也是食管鳞癌的主要高危亚型[17-21], 在食管鳞癌中以HPV16型为主; HPV18是仅次于HPV16的高危型, 在HPV18恶性转化中, 起关键作用的是其E6和E7基因. 一般认为HPV DNA在良性和癌前病变中以游离形式存在, 而在恶性肿瘤中整合于细胞基因中, 下游区域E6和E7整合入宿主细胞后参与细胞的增殖与转化, E7基因可通过与Rb家族相互作用使细胞周期失控, DNA大量合成并丧失DNA复制的保真度; E6则通过结合并降解P53, 阻止DNA的修复或阻止细胞进入程序性死亡. 多数文献报导E6, E7的PCR结果符合性很好, 二者检测的敏感性差异也不大[22]. Lu et al[23]利用PCR技术对41例新疆哈族食管癌石蜡标本检测了HPV16E6基因感染状况, 测得HPV16E6基因阳性检出率为52.9%(55/104), 提示新疆哈萨克族食管癌的发生与HPV感染具有相关性. 目前尚无对新疆哈萨克族食管癌HPV16、18E7基因及HPV31, 45等亚型的感染率的报道, 我们前期曾检测了HPV16在哈族食管癌中感染率(41%), 因此, 本实验组选择研究HPV18, 31, 45E7这3个高危亚型在新疆哈族食管癌中的检出率,探讨HPV18, 31, 45E7基因与新疆哈族食管癌病因学的相关性. Li et al[24]报导HPV18在河南安阳食管癌高发地区阳性率为17%, 并且发现大多HPV18阳性的样本同时伴有HPV16阳性, 分析其OR值, 得出HPV18与食管癌发病有关, 并且当HPV16, 18合并感染时提高了细胞病变的风险. 因此, 虽然HPV18在食管癌中感染率低, 但一旦感染可加强HPV16的致癌作用, 提示这两种类型HPV在致癌功能上存在协同互补作用. 我们的结果(25.3%)与此较一致, 说明HPV18可能是引起新疆哈萨克族食管癌高发的原因之一, HPV31, 45在哈族食管癌中的检出率分别为14.2%, 7.3%, 说明HPV31, 45可能不是引起哈族食管癌高发的主要高危亚型. 本研究发现HPV18, 31, 45基因型的分布与食管癌患者的性别、年龄无关, 但在组织分化程度上, 中低分化食管鳞癌组织中HPV18E7基因检出率明显高于高分化组(P<0.05), 提示HPV18E7基因与哈萨克族食管癌的发生密切相关.
我们采用104 bp的短片段来扩增HPV18E7基因, 是基于石蜡组织由于甲醛固定及年代久, DNA降解多且提取出的DNA多为碎裂的片段[25-26], 若用来扩增较大的目的片段有一定困难, 易出现假阴性结果. Karlsen et al[27]研究认为, 对于石蜡组织, 甲醛固定造成一种拮抗效应, 导致较长(>200 bp)片段扩增受到抑制, 而选择扩增较短的目的片段则避免了以上不足. 本实验中采用直接裂解法制备石蜡组织DNA, 既避免了在提取过程中步骤多而增加DNA污染的机会, 又因为无酚-氯仿提纯而减少了DNA的损失. 此种方法提取的DNA完全适用于病毒的检测, 据报道采用常规PCR方法, 可检测到直接裂解法制备的样本DNA中10-100拷贝的HPV病毒[28-30]. 但能否用于基因多态性等方面的检测有待于进一步的验证.
位于我国北部的新疆哈萨克族(哈族)是食管癌的高发民族, 近年来, 与食管癌病因学相关的致病因素之一-微生物因素特别是人乳头状瘤病毒(HPV)与食管癌的相关性逐渐引起人们的重视, 目前对新疆哈族食管癌与HPV感染相关性的研究较少.
食管癌病因及发病学机制至今尚未完全阐明, 目前认为这是相关环境因素和遗传因素共同作用的结果.食管癌的病因可归结为致癌物活化或解毒作用、DNA修复能力、HPV感染和其他已知或未知因素产生的联合作用. 国内外研究结果表明高危型HPV感染与高发区食管癌发生关系密切.
目前尚无对新疆哈萨克族食管癌HPV16, 18E7基因及HPV31, 45等亚型的感染率的报导, 本实验组选择研究HPV18, 31, 45E7这3个高危亚型在新疆哈族食管癌中的检出率, 探讨HPV18, 31, 45E7基因与新疆哈族食管癌病因学的相关性.
本研究为新疆哈族食管癌病因学的研究奠定基础.
HPV, 即人类乳头状瘤病毒(Humanpapillomavirus, HPV)是一组体积较小的双链DNA病毒, 共有200多种类型. 乳头瘤基因区包括3个功能分明的区域. 按病毒与临床的相关性可将HPV分为高危型和低危型, 高危型如HPV16、18等, 与宫颈癌、食管癌等肿瘤密切相关;低危型如HPV6、11等, 与尖锐湿疣等良性疾病相关.
本文探讨HPV18、31、45亚型在哈族食管癌中所处地位及与哈族食管癌病因学的相关性, 设计合理, 采用的方法也比较经典, 结果可信, 有学术价值.
编辑: 程剑侠 电编:张强
| 2. | zur Hausen H. Cervical carcinoma and human papillomavirus: on the road to preventing a major human cancer. J Natl Cancer Inst. 2001;93:252-253. [PubMed] |
| 3. | Munoz N, Bosch FX, de Sanjose S, Herrero R, Castellsague X, Shah KV, Snijders PJ, Meijer CJ. and International Agency for Research on Cancer Multicenter Cervical Cancer Study Group. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003;348:518-527. [PubMed] |
| 4. | Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, Snijders PJ, Peto J, Meijer CJ, Munoz N. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999;189:12-19. [PubMed] |
| 7. | Lyronis ID, Baritaki S, Bizakis I, Tsardi M, Spandidos DA. Evaluation of the prevalence of human papillomavirus and Epstein-Barr virus in esophageal squamous cell carcinomas. Int J Biol Markers. 2005;20:5-10. [PubMed] |
| 8. | Farhadi M, Tahmasebi Z, Merat S, Kamangar F, Nasrollahzadeh D, Malekzadeh R. Human papillomavirus in squamous cell carcinoma of esophagus in a high-risk population. World J Gastroenterol. 2005;11:1200-1203. [PubMed] |
| 9. | Matsha T, Erasmus R, Kafuko AB, Mugwanya D, Stepien A, Parker MI. CANSA/MRC Oesophageal Cancer Research Group. Human papillomavirus associated with oesophageal cancer. J Clin Pathol. 2002;55:587-590. [PubMed] |
| 10. | Peixoto Guimaraes D, Hsin Lu S, Snijders P, Wilmotte R, Herrero R, Lenoir G, Montesano R, Meijer CJ, Walboomers J, Hainaut P. Absence of association between HPV DNA, TP53 codon 72 polymorphism, and risk of oesophageal cancer in a high-risk area of China. Cancer Lett. 2001;162:231-235. [PubMed] |
| 11. | Si HX, Tsao SW, Poon CS, Wang LD, Wong YC, Cheung AL. Viral load of HPV in esophageal squamous cell carcinoma. Int J Cancer. 2003;103:496-500. [PubMed] |
| 12. | Chen B, Yin H, Dhurandhar N. Detection of human papillomavirus DNA in esophageal squamous cell carcinomas by the polymerase chain reaction using general consensus primers. Hum Pathol. 1994;25:920-923. [PubMed] |
| 13. | Cooper K, Taylor L, Govind S. Human papillomavirus DNA in esophageal carcinomas in South Africa. J Pathol. 1995;175:273-277. [PubMed] |
| 14. | Chang F, Syrjanen S, Shen Q, Cintorino M, Santopietro R, Tosi P, Syrjanen K. Evaluation of HPV, CMV, HSV and EBV in esophageal squamous cell carcinomas from a high-incidence area of China. Anticancer Res. 2000;20:3935-3940. [PubMed] |
| 15. | Scuderi PE, James RL, Harris L, Mims GR 3rd. Multimodal antiemetic management prevents early postoperative vomiting after outpatient laparoscopy. Anesth Analg. 2000;91:1408-1414. [PubMed] |
| 16. | Henzi I, Walder B, Tramer MR. Dexamethasone for the prevention of postoperative nausea and vomiting: a quantitative systematic review. Anesth Analg. 2000;90:186-194. [PubMed] |
| 17. | Duensing S, Duensing A, Crum CP,Munger k. Human papillomavirus type 16E7 oncoprotein induced abnormal centrosomesythesis is an early event in the evolving malignamt phenotype. Cancer Res. 2001;61:2356-2360. [PubMed] |
| 18. | Gillison ML, Koch WM, Capone RB, Spafford M, Westra WH, Wu L, Zahurak ML, Daniel RW, Viglione M, Symer DE. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst. 2000;92:709-720. [PubMed] |
| 19. | Bahnassy AA, Zekri AR, Abdallah S, El-Shehaby AM, Sherif GM. Human papillomavirus infection in Egyptian esophageal carcinoma: correlation with p53, p21, mdm2, C-erbB2 and impact on survival. Pathol Int. 2005;55:53-62. [PubMed] |
| 20. | Katiyar S, Hedau S, Jain N, Kar P, Khuroo MS, Mohanta J, Kumar S, Gopalkrishna V, Kumar N, Das BC. p53 gene mutation and human papillomavirus (HPV) infection in esophageal carcinoma from three different endemic geographic regions of India. Cancer Lett. 2005;218:69-79. [PubMed] |
| 21. | Acevedo-Nuno E, Gonzalez-Ojeda A, Vazquez-Camacho G, Balderas-Pena Luz Ma A, Moreno-Villa H, Montoya-Fuentes H. Human papillomavirus DNA and protein in tissue samples of oesophageal cancer, Barrett's oesophagus and oesophagitis. Anticancer Res. 2004;24:1319-1323. [PubMed] |
| 22. | zur Hausen H. Papillomavirus infections--a major cause of human cancers. Biochim Biophys Acta. 1996;1288:F55-F78. [PubMed] |
| 23. | Lu XM, Zhang YM, Lin RY, Liang XH, Zhang YL, Wang X, Zhang Y, Wang Y, Wen H. p53 polymorphism in human papillomavirus-associated Kazakh's esophageal cancer in Xinjiang, China. World J Gastroenterol. 2004;10:2775-2778. [PubMed] |
| 24. | Li T, Lu ZM, Chen KN, Guo M, Xing HP, Mei Q, Yang HH, Lechner JF, Ke Y. Human papillomavirus type 16 is an important infectious factor in the high incidence of esophageal cancer in Anyang area of China. Carcinogenesis. 2001;22:929-934. [PubMed] |
| 25. | Baay MF, Quint WG, Koudstaal J, Hollema H, Duk JM, Burger MP, Stolz E, Herbrink P. Comprehensive study of several general and type-specific primer pairs for detection of human papillomavirus DNA by PCR in paraffin-embedded cervical carcinomas. J Clin Microbiol. 1996;34:745-747. [PubMed] |
| 26. | Ohara Y, Honma M, Iwasaki Y. Sensitivity of the polymerase chain reaction for detecting human T-cell leukemia virus type I sequences in paraffin-embedded tissue. Effect of unbuffered formalin fixation. J Virol Methods. 1992;37:83-88. [PubMed] |
| 27. | Karlsen F, Kalantari M, Chitemerere M, Johansson B, Hagmar B. Modifications of human and viral deoxyribonucleic acid by formaldehyde fixation. Lab Invest. 1994;71:604-611. [PubMed] |
| 28. | van den Brule AJ, Claas EC, du Maine M, Melchers WJ, Helmerhorst T, Quint WG, Lindeman J, Meijer CJ, Walboomers JM. Use of anticontamination primers in the polymerase chain reaction for the detection of human papilloma virus genotypes in cervical scrapes and biopsies. J Med Virol. 1989;29:20-27. [PubMed] |
| 29. | Melchers WJ, Claas HC, Quint WG. Use of the polymerase chain reaction to study the relationship between human papillomavirus infections and cervical cancer. Eur J Clin Microbiol Infect Dis. 1991;10:714-727. [PubMed] |
| 30. | van den Brule AJ, Meijer CJ, Bakels V, Kenemans P, Walboomers JM. Rapid detection of human papillomavirus in cervical scrapes by combined general primer-mediated and type-specific polymerase chain reaction. J Clin Microbiol. 1990;28:2739-2743. [PubMed] |