修回日期: 2007-04-01
接受日期: 2007-04-13
在线出版日期: 2007-06-28
目的: 探讨巨噬细胞金属弹力酶(MME)对小鼠原位结肠癌生长、微血管生成及环氧合酶-2(COX-2)表达的影响.
方法: 扩增编码MME基因结构域Ⅰ和Ⅱ的cDNA片段, 构建真核细胞表达载体pcDNA3.1-MME并转染小鼠CT-26结肠癌细胞. 建立MME转染组及对照组小鼠原位结肠癌种植模型, 观察重组MME对结肠癌生长的影响, 采用Western blot方法检测肿瘤组织中的COX-2表达和微血管密度(MVD).
结果: 4 wk后, 小鼠原位结肠癌的平均体积和微血管密度, 空质粒转染组小鼠和未转染组显著高于MME转染组(1151.07±35.91 mm3, 1201.13±42.15 mm3vs 384.83±4.76 mm3, P<0.001; 21.87±0.47, 22.56±0.71 vs 8.48±0.53, P<0.001). COX-2蛋白水平在MME转染组中均显著低于对照组(2.766±1.22 vs 5.77±1.08, 5.84±0.95, P<0.01).
结论: 转染入小鼠结肠癌细胞的MME基因通过抑制新生血管的生成和COX-2表达, 从而起到抑制原位结肠癌生长的作用.
引文著录: 石海, 许建明, 胡乃中, 梅俏, 鲍峻峻. 巨噬细胞金属弹力酶对小鼠原位结肠癌生长及COX-2表达的影响. 世界华人消化杂志 2007; 15(18): 2014-2020
Revised: April 1, 2007
Accepted: April 13, 2007
Published online: June 28, 2007
AIM: To determine correlations between macrophage metalloelastase (MME), microvessel angiogenesis and cyclooxygenase-2 (COX-2) expression in the angiogenesis of colon cancer.
METHODS: A cDNA fragment coding for domainsⅠand Ⅱ of MME was transfected into MME deficient murine CT-26 colon cancer cells. The enzymatic activity of recombinant MME was confirmed by cleavage of native substrate in vitro. An orthotopic implantation model was established using MME-transfected and control cells. Tumor samples were subjected to Western blot to detect expressions of MME and COX-2. Microvessel counting was used to assess angiogenesis of murine colon tumors.
RESULTS: Primary tumors with volumes and microvessel formation carrying pcDNA3.1-transfected and nontransfected cells were larger than that in the group implanted with MME-transfected (1151.07 ± 35.91 mm3 and 1201.13 ± 42.15 mm3vs 384.83 ± 4.76 mm3, P < 0.001; 21.87 ± 0.47 and 22.56 ± 0.71 vs 8.48 ± 0.53, P < 0.001, respectively). The expression of COX-2 protein was significantly lower in the MME-transfected group than that in the controls by Western blot analysis (2.766 ± 1.22 vs 5.77 ± 1.08 and 5.84 ± 0.95, P < 0.01, respectively).
CONCLUSION: The MME gene when transfected into murine colon cancer cells can effectively suppress the growth of orthotopic tumors by inhibiting vascularity and COX-2 expression.
- Citation: Shi H, Xu JM, Hu NZ, Mei Q, Bao JJ. Effects of mouse macrophage metalloelastase on growth and cyclooxygenase-2 expression of murine orthotopic colon cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(18): 2014-2020
- URL: https://www.wjgnet.com/1009-3079/full/v15/i18/2014.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i18.2014
巨噬细胞金属弹力酶(macrophage metalloelas-tase, MME)是基质金属蛋白酶(matrix metallo-proteinase, MMP)家族成员之一, 也称MMP-12. 与其他MMPs成员不同, MME可以分解纤溶酶原, 产生具有抑制血管内皮细胞增殖作用的血管抑素(angiostatin), 进而抑制体内肿瘤细胞的生长, 在抗肿瘤血管生成中具有重要作用[1-6]. 国外研究发现, MME可抑制结肠癌生长, 并与结肠癌的临床病理特征关系密切[7-8]. 然而, 尚未见到在结肠原位移植瘤中探讨MME抗肿瘤活性的报道. 环氧合酶是催化花生四烯酸转化为前列腺素的限速酶, 可分成在许多正常组织中恒定表达的原生性COX-1和在炎症组织中增强表达的诱生性COX-2. 特异性COX-2抑制剂的抑制肿瘤效果更优于非选择性非甾体抗炎药, 提示COX-2与消化肿瘤的发生、发展密切相关[9-10]. 因而, COX-2蛋白表达状况与胃肠道肿瘤的关系备受关注. 为了探讨MME在结肠原位移植瘤生长和微血管生成过程中所起的作用, 以及与COX-2表达的关系, 我们选择无MME基因表达的小鼠CT-26结肠癌细胞作为研究对象[7], 将MME基因转染CT-26细胞, 建立结肠癌小鼠原位移植模型, 以期探讨MME的抗肿瘤活性及其作用机制.
pUC9-MME全长cDNA及pcDNA3.1(+)质粒由美国俄亥俄州辛辛那提大学医学院董钟云博士惠赠; XL1-blue、DH5α菌株及CT-26结肠癌细胞株由安徽医科大学病原微生物教研室提供; pGEM-T载体、T4DNA连接酶、TaqDNA聚合酶、DNA纯化试剂盒、BamHⅠ内切酶、XbaⅠ内切酶均购自Promega公司; 引物合成及G418由上海生工生物工程技术服务有限公司提供; DMEM培养基购自Gibco公司; 6周龄♀BALB/C小鼠80只购自上海西普尔-必凯实验动物有限公司[动物合格证号: SCXK(沪)2003-0002]; MMP-12羊抗鼠多克隆抗体、COX-2羊抗鼠多克隆抗体及羊抗鼠CD34多克隆抗体均购自Santa Cruz公司; 免疫组化SP试剂盒购自福州迈新公司.
构建及鉴定pcDNA3.1-MME重组质粒的具体方法参见以前的研究报道[11].
1.2.1 细胞培养与转染: CT-26细胞用含100 mL/L胎牛血清的DMEM及抗生素在37℃、50 mL/L CO2条件下培养. 将指数生长期CT-26细胞(5×105)于转染前1 d接种于6孔培养板中, 以含100 mL/L胎牛血清的DMEM培养. 采用磷酸钙共沉淀法转染细胞[12]. 转染后再用含800 mg/L G418的选择性培养基进行稳定转染克隆的筛选, 挑取单个稳定转染克隆于含200 mg/L G418的培养基中继续培养, 用于下一步实验.
1.2.2 免疫细胞化学染色: 采用SP法. 让细胞爬于盖玻片上生长过夜, 取出爬有CT-26细胞的盖玻片, 用预冷的PBS冲洗3次, 再用冰预冷的丙酮固定10 min, 置-20℃保存, 用于免疫细胞化学染色. 1:100稀释MMP-12羊抗鼠多克隆抗体, 免疫细胞化学染色步骤按SP法试剂盒操作说明书进行, DAB显色(棕黄色). CT-26细胞质呈明显的棕黄色判定为MME阳性表达.
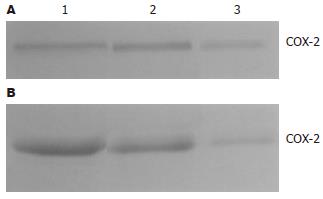
1.2.3 CT-26细胞裂解上清和原位结肠癌组织中COX-2表达的Western blot分析: 实验细胞分为3组, 分别为MME转染组和对照组(空质粒转染组及未转染组). 各组培养的CT-26细胞于检测前48 h换用不含胎牛血清的DMEM培养, 留取细胞裂解上清. 取大约-80℃冻存的结肠癌组织200 mg, 剪碎后置于1 mL冰预冷的TBS缓冲液中融化, 然后匀浆5 min, 4℃ 14 000 r/min离心20 min, 留取上清. 将含有大约40 μg总蛋白的各组样品与等体积的2×SDS-PAGE上样缓冲液混合, 煮沸5 min. Western blot按常规方法进行[1], DAB显色, 标准分子量蛋白用氨基黑10B染色.
1.2.4 重组蛋白酶活性鉴定: 首先, 采用超声波破碎细胞法, 分别裂解转染及非转染的3组细胞, 再与不含变性剂的上样缓冲液混合, 不煮沸. 再采用明胶酶谱法[1]进行酶活性鉴定.
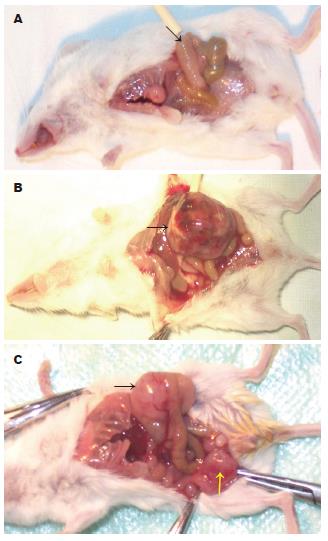
1.2.5 原位移植结肠癌模型建立: 用1.25 g/L胰蛋白酶溶液收获处于指数生长期的转染及非转染CT-26细胞, 吹打成单细胞悬液, 用Hank's平衡盐溶液(HBSS)洗涤并重悬. 用台盼蓝(trypan blue)清除试验鉴定, 具有90%以上活力的单细胞悬液用于下一步实验. 对照组(各15只)及MME转染组小鼠(15只)用30 mg/kg戊巴比妥钠ip麻醉, 固定后在下腹中线做一切口, 暴露盲肠. 将CT-26细胞(1×109/L HBSS)注射到盲肠穹窿部肠壁内, 950 mL/L乙醇轻擦注射部位, 关闭切口. 4 wk后处死或随时处死濒死的荷瘤小鼠, 留取肿瘤标本. 濒死小鼠的标本仍计为有效标本. 原发肿瘤体积用公式(宽度2×长度)/2计算, 同时称瘤体重量. 瘤组织常规石蜡包埋, 另外一部分在液氮中速冻后, -80℃保存, 留做Western blot检测, 方法见上.
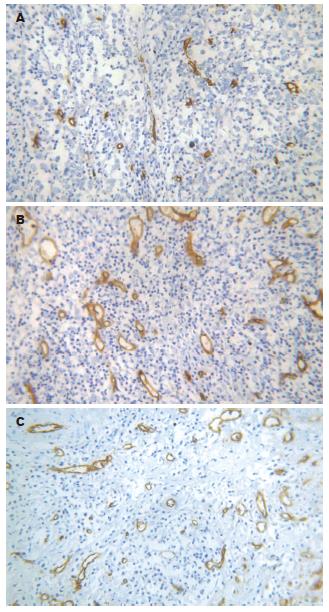
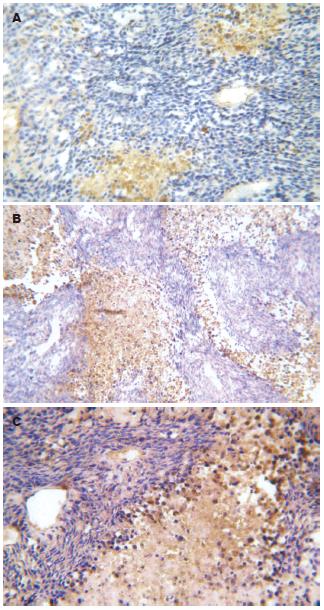
1.2.6 免疫组织化学染色检测MVD、MME和COX-2表达: 采用SP法. 羊抗鼠CD34多克隆抗体稀释150倍, 羊抗鼠MME多克隆抗体稀释100倍, 羊抗鼠COX-2多克隆抗体稀释100倍. 免疫组化步骤按SP法试剂盒操作说明书进行, DAB显色(棕黄色). MVD计数按文献[13]报道进行.
统计学处理 肿瘤体积和MVD值采用t检验, 数据以mean±SD表示; 分类变量统计采用χ2检验. 所有统计分析均在SPSS12.0统计软件上完成.
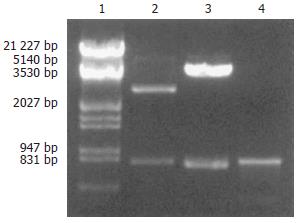
PCR扩增产生一编码MME结构域Ⅰ和Ⅱ的840 bp的cDNA片段. 该片段与载体pGEM-T连接后, 经DNA序列分析, 与GenBank中小鼠MME cDNA序列完全一致. pGEM-T-MME及pcDNA3.1-MME的BamHⅠ和XbaⅠ双酶切鉴定结果见图1.
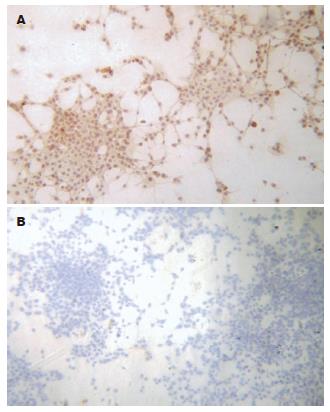
pcDNA3.1(+)-MME转染CT-26细胞的免疫细胞化学染色呈阳性反应, 细胞胞质呈棕黄色(图2).
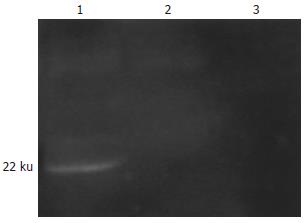
pcDNA3.1-MME转染的CT-26细胞裂解后, 经明胶酶谱电泳, 可以清楚地看见一条大小约22 ku的明胶分解透亮条带(图3), 与成熟的有酶活性的MME分子量大小一致(结构域Ⅱ).
采用细胞悬液进行结肠癌模型的建立, 共造模67只, 22只未见明显肿瘤生长, 成瘤率为67.16%(45/67). 未转染组小鼠7/15(46.7%)于种植后4 wk内因衰竭而濒死, 空载体转染组小鼠有9/15(60.0%)于种植后4 wk内因衰竭而濒死, 而MME转染组小鼠仅有4/15(26.7%)濒死. MME转染组结肠癌平均瘤重为2.35±0.24 g, 空质粒转染组及未转染组平均瘤重分别为8.08±0.79 g和8.76±0.92 g (P<0.01). pcDNA3.1空质粒转染组瘤体大小平均为1151.07±35.91 mm3; 未转染组瘤体大小平均为1201.13±42.15 mm3; pcDNA3.1-MME转染组瘤体大小平均为384.83±4.76 mm3. MME转染组结肠癌体积明显小于空质粒转染组及未转染组(P<0.001), 而两对照组之间差异无显著性(P = 0.374). MME转染组结肠癌平均体积明显小于空质粒转染组及未转染组(P<0.001), 而两对照组之间差异无显著性(P = 0.374, 图4).
MME转染组MVD值(8.48±0.53)明显低于pcDNA3.1空质粒转染组(21.87±0.47)和未转染组(22.56±0.71) (P<0.001). 两对照组之间相比差异无显著性(P = 0.423). MME转染组MVD值明显低于对照组(P<0.001), 两对照组之间相比差异无显著性(P = 0.423, 图5). MME转染组肿瘤组织中, 棕黄色染色见于大片肿瘤细胞胞质中; 空载体转染组和未转染组肿瘤基质中可见MME蛋白表达, 而肿瘤细胞中未见棕黄色染色. 3组肿瘤组织中COX-2的免疫组化染色结果见图6.
对CT-26细胞裂解上清和肿瘤组织进行Western blot检测发现, 3组均可见一条分子量大约为72 ku的免疫印迹条带. 计算机图像分析软件测定MME转染组细胞培养上清条带的平均密度为2.54±0.64, 而空载体转染组和未转染组COX-2条带的平均密度分别为5.77±1.08和5.84±0.95; MME转染组肿瘤组织中条带的平均密度为2.76±0.66, 而空载体转染组和未转染组COX-2条带的平均密度分别为7.31±1.22和6.42±1.03(P<0.01, 图7).
实质性肿瘤的生长和转移离不开丰富的血管网提供营养成分, 而肿瘤中的血管生成是受内源性血管生成刺激物(例如VEGF等)和内源性血管生成抑制物(例如血管抑素、内皮抑素等)双重调控的, 他们之间的平衡决定了肿瘤内血管生成的状况[14-16], 近些年抗肿瘤血管生成研究成为抗肿瘤研究的热点之一. 与MMPs其他家族成员的促进肿瘤浸润和转移作用不同, MMP-12 (MME)具有很强的分解纤溶酶原而产生血管抑素(angiostatin)的作用, 这种作用在Lewis肺癌小鼠皮下移植模型及体外实验中都得到证实[1-2]. 另外, 肿瘤细胞分泌的粒细胞-巨噬细胞集落刺激因子(GM-CSF)可以引起巨噬细胞大量分泌MME, 从而产生更多的血管抑素, 抑制肿瘤生长和转移[17-18]. 目前, 对于MMP-12的研究逐渐增多, 但研究显示, 他在不同部位肿瘤及不同疾病的发展过程中扮演不同的角色[19-27]. 在研究人巨噬细胞金属弹力酶(human macrophage metalloelastase, HME)生物学作用中发现, 肝细胞癌患者HME的表达与肝癌组织中血管抑素的产生和肿瘤血管网的丰富程度密切相关[28]. HME过表达结肠癌患者其肿瘤浸润深度、淋巴管及血管浸润程度均好于HME阴性表达者[8]. 以上这些研究都证实MME通过产生血管抑素而在抗肿瘤和抗血管生成方面起着重要作用. 然而, 尚未见有关MME对原位移植肿瘤生长影响及与肿瘤模型中COX-2表达关系的文献报道. 因而本研究对深入研究MME在结肠癌生长、转移过程中的生物学作用及机制具有重要意义.
在本项研究中, 我们首先成功构建了真核细胞表达载体pcDNA3.1-MME, 证实这种真核表达载体可稳定转染至小鼠CT-26细胞, 其成熟的重组MME蛋白(结构域Ⅱ)具有酶活性. 在随后进行的小鼠原位结肠癌动物研究发现, 高水平表达的MME具有明显的抑制原位结肠癌生长的作用, 同时, MME表达与结肠癌组织中MVD值密切相关. 本研究的结果进一步证实了, MME具有重要的抗肿瘤血管生成作用, 这可能是通过分解循环血液中的纤溶酶原, 生成血管抑素, 从而抑制了肿瘤血管内皮细胞增殖而起作用的. 这些研究结果与国外报道的小鼠黑素瘤皮下移植模型研究[29]和小鼠结肠癌皮下移植模型研究[7]的结果相似. 但本项研究在结肠原位移植瘤模型中探讨了MME的抗肿瘤作用. 与皮下移植瘤模型研究比较, 结肠原位种植肿瘤模型的实验结果可以从"土壤"和"种子"学说的角度, 更清晰地探讨MME抑制结肠癌生长转移的体内作用机制.
肿瘤组织中平均微血管密度(MVD)是衡量肿瘤血管生成的重要指标, 在目前难以测定血管抑素的情况下, 检测肿瘤MVD值, 可以间接反映MME的作用机制. COX-2与肿瘤血管生成密切相关, COX-2作为一种刺激因子在肿瘤发生中能促进肿瘤血管生长, 为肿瘤生长和转移提供必需的营养[30-31]. 本项研究发现, 在MME转染组中, 不仅原位结肠癌组织中MVD明显降低, 而且COX-2的表达亦明显下降, 提示MME也可能具有调节COX-2表达和生成的作用, 其作用机制尚待进一步探讨. 总之, 我们研究显示, MME和COX-2与结肠癌血管生成密切相关, 为阻断肿瘤血管生成的靶向基因治疗提供了实验依据.
结肠癌是最为常见的消化道恶性肿瘤之一, 易于发生肝转移, 预后差, 迄今尚无令人满意的生物学治疗措施. 在绝大多数实体肿瘤中有聚集浸润的巨噬细胞, 这类细胞可以特异性地表达巨噬细胞金属弹力酶(MME), 是巨噬细胞穿透基底膜和浸润肿瘤组织必不可少的一种活性产物. 近年来的研究显示, 与其他MMPs不同, MME具有独特的抗肿瘤生长转移的作用. 在所有的MMPs中, MME诱导生成血管抑素(angiostatin)的能力最强. MME在肿瘤浸润性巨噬细胞抗肿瘤血管生成活性中具有重要作用, 值得进一步研究其独特的抗肿瘤效应及机制.
MME在疾病发展过程中的作用还处于探索研究阶段. 虽然对于MME的研究报道已不少, 但MME对肿瘤生长、转移及预后意义的研究结果还存在分歧, 仍有待于大量的基础实验研究加以论证, 还需要更深入地研究MME在肿瘤等疾病中的确切作用机制(可能不止一种作用机制). 因此, 通过对MME在多种疾病中作用机制的进一步深入研究, 可以预期不久的将来MME可能成为治疗包括肿瘤在内的多种疾病的靶分子, 为进一步开展基因治疗打下理论基础.
虽然国外有研究发现MME表达与结肠癌细胞生长转移呈负相关, MME可以通过产生血管抑素的作用机制而抑制结肠癌生长, 然而, 迄今尚未见到有关巨噬细胞特异性MME原位种植肿瘤模型建立的报道, 也未见有关MME对原位移植肿瘤生长影响及与肿瘤模型中COX-2表达关系的文献报道.
本研究显示MME具有抑制原位结肠癌生长转移的作用, 并且在小鼠原位结肠癌模型中探讨了MME与COX-2表达的关系, 证实MME可能具有抑制COX-2表达的作用, MME和COX-2都与结肠癌血管生成密切相关, 为阻断肿瘤血管生成的靶向基因治疗提供了实验依据.
本文通过构建真核细胞表达载体pcDNA3.1-MME,并把鼠结肠癌细胞的MME基因转入小鼠CT-26结肠癌细胞系, 探讨了MME基因对新生血管生成的抑制作用, 为阻断肿瘤血管生成的靶向基因治疗提供了实验依据.
编辑: 王晓瑜 电编:张敏
| 1. | Dong Z, Kumar R, Yang X, Fidler IJ. Macrophage-derived metalloelastase is responsible for the generation of angiostatin in Lewis lung carcinoma. Cell. 1997;88:801-810. [PubMed] |
| 2. | Cornelius LA, Nehring LC, Harding E, Bolanowski M, Welgus HG, Kobayashi DK, Pierce RA, Shapiro SD. Matrix metalloproteinases generate angiostatin: effects on neovascularization. J Immunol. 1998;161:6845-6852. [PubMed] |
| 3. | Gronski TJ Jr, Martin RL, Kobayashi DK, Walsh BC, Holman MC, Huber M, Van Wart HE, Shapiro SD. Hydrolysis of a broad spectrum of extracellular matrix proteins by human macrophage elastase. J Biol Chem. 1997;272:12189-12194. [PubMed] |
| 4. | Janusz MJ, Hare M, Durham SL, Potempa J, McGraw W, Pike R, Travis J, Shapiro SD. Cartilage proteoglycan degradation by a mouse transformed macrophage cell line is mediated by macrophage metalloelastase. Inflamm Res. 1999;48:280-288. [PubMed] |
| 5. | Banerji A, Chakrabarti J, Mitra A, Chatterjee A. Effect of curcumin on gelatinase A (MMP-2) activity in B16F10 melanoma cells. Cancer Lett. 2004;211:235-242. [PubMed] |
| 6. | Saito T, Mizumoto H, Tanaka R, Satohisa S, Adachi K, Horie M, Kudo R. Overexpressed progesterone receptor form B inhibit invasive activity suppressing matrix metalloproteinases in endometrial carcinoma cells. Cancer Lett. 2004;209:237-243. [PubMed] |
| 7. | Gorrin-Rivas MJ, Arii S, Mori A, Kaneda Y, Imamura M. Mouse macrophage metalloelastase gene delivery by HVJ-cationic liposomes in experimental antiangiogenic gene therapy for murine CT-26 colon cancer. Int J Cancer. 2001;93:731-735. [PubMed] |
| 8. | Yang W, Arii S, Gorrin-Rivas MJ, Mori A, Onodera H, Imamura M. Human macrophage metalloelastase gene expression in colorectal carcinoma and its clinicopathologic significance. Cancer. 2001;91:1277-1283. [PubMed] |
| 9. | Zha S, Yegnasubramanian V, Nelson WG, Isaacs WB, De Marzo AM. Cyclooxygenases in cancer: progress and perspective. Cancer Lett. 2004;215:1-20. [PubMed] |
| 10. | Perchick GB, Jabbour HN. Cyclooxygenase-2 overexpression inhibits cathepsin D-mediated cleavage of plasminogen to the potent antiangio-genic factor angiostatin. Endocrinology. 2003;144:5322-5328. [PubMed] |
| 11. | Shi H, Xu JM, Hu NZ, Wang XL, Mei Q, Song YL. Transfection of mouse macrophage metalloelastase gene into murine CT-26 colon cancer cells suppresses orthotopic tumor growth, angiogenesis and vascular endothelial growth factor expression. Cancer Lett. 2006;233:139-150. [PubMed] |
| 12. | Jordan M, Schallhorn A, Wurm FM. Transfecting mammalian cells: optimization of critical parameters affecting calcium-phosphate precipitate formation. Nucleic Acids Res. 1996;24:596-601. [PubMed] |
| 13. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] |
| 14. | Gorrin-Rivas MJ, Arii S, Mori A, Takeda Y, Mizumoto M, Furutani M, Imamura M. Implications of human macrophage metalloelastase and vascular endothelial growth factor gene expression in angiogenesis of hepatocellular carcinoma. Ann Surg. 2000;231:67-73. [PubMed] |
| 15. | Maehara Y, Kabashima A, Koga T, Tokunaga E, Takeuchi H, Kakeji Y, Sugimachi K. Vascular invasion and potential for tumor angiogenesis and metastasis in gastric carcinoma. Surgery. 2000;128:408-416. [PubMed] |
| 16. | Perrone G, Vincenzi B, Santini D, Verzi A, Tonini G, Vetrani A, Rabitti C. Correlation of p53 and bcl-2 expression with vascular endothelial growth factor (VEGF), microvessel density (MVD) and clinico-pathological features in colon cancer. Cancer Lett. 2004;208:227-234. [PubMed] |
| 17. | Dong Z, Yoneda J, Kumar R, Fidler IJ. Angiostatin-mediated suppression of cancer metastases by primary neoplasms engineered to produce granulocyte/macrophage colony-stimulating factor. J Exp Med. 1998;188:755-763. [PubMed] |
| 18. | Kumar R, Dong Z, Fidler IJ. Differential regulation of metalloelastase activity in murine peritoneal macrophages by granulocyte-macrophage colony-stimulating factor and macrophage colony-stimulating factor. J Immunol. 1996;157:5104-5111. [PubMed] |
| 19. | Hautamaki RD, Kobayashi DK, Senior RM, Shapiro SD. Requirement for macrophage elastase for cigarette smoke-induced emphysema in mice. Science. 1997;277:2002-2004. [PubMed] |
| 20. | Valenca SS, de Souza da Fonseca A, da Hora K, Santos R, Porto LC. Lung morphometry and MMP-12 expression in rats treated with intraperitoneal nicotine. Exp Toxicol Pathol. 2004;55:393-400. [PubMed] |
| 21. | D'Alessio S, Fibbi G, Cinelli M, Guiducci S, Del Rosso A, Margheri F, Serrati S, Pucci M, Kahaleh B, Fan P. Matrix metalloproteinase 12-dependent cleavage of urokinase receptor in systemic sclerosis microvascular endothelial cells results in impaired angiogenesis. Arthritis Rheum. 2004;50:3275-3285. [PubMed] |
| 22. | Prescott MF, Sawyer WK, Von Linden-Reed J, Jeune M, Chou M, Caplan SL, Jeng AY. Effect of matrix metalloproteinase inhibition on progression of atherosclerosis and aneurysm in LDL receptor-deficient mice overexpressing MMP-3, MMP-12, and MMP-13 and on restenosis in rats after balloon injury. Ann N Y Acad Sci. 1999;878:179-190. [PubMed] |
| 23. | Luttun A, Lutgens E, Manderveld A, Maris K, Collen D, Carmeliet P, Moons L. Loss of matrix metalloproteinase-9 or matrix metalloproteinase-12 protects apolipoprotein E-deficient mice against atherosclerotic media destruction but differentially affects plaque growth. Circulation. 2004;109:1408-1414. [PubMed] |
| 24. | Curci JA, Liao S, Huffman MD, Shapiro SD, Thompson RW. Expression and localization of macrophage elastase (matrix metalloproteinase-12) in abdominal aortic aneurysms. J Clin Invest. 1998;102:1900-1910. [PubMed] |
| 25. | Morgan AR, Rerkasem K, Gallagher PJ, Zhang B, Morris GE, Calder PC, Grimble RF, Eriksson P, McPheat WL, Shearman CP. Differences in matrix metalloproteinase-1 and matrix metalloproteinase-12 transcript levels among carotid atherosclerotic plaques with different histopathological characteristics. Stroke. 2004;35:1310-1315. [PubMed] |
| 26. | Kaneko Y, Sakatsume M, Xie Y, Kuroda T, Igashima M, Narita I, Gejyo F. Macrophage metalloelastase as a major factor for glomerular injury in anti-glomerular basement membrane nephritis. J Immunol. 2003;170:3377-3385. [PubMed] |
| 27. | Saarialho-Kere U, Kerkela E, Jeskanen L, Hasan T, Pierce R, Starcher B, Raudasoja R, Ranki A, Oikarinen A, Vaalamo M. Accumulation of matrilysin (MMP-7) and macrophage metalloelastase (MMP-12) in actinic damage. J Invest Dermatol. 1999;113:664-672. [PubMed] |
| 28. | Gorrin Rivas MJ, Arii S, Furutani M, Harada T, Mizumoto M, Nishiyama H, Fujita J, Imamura M. Expression of human macrophage metalloelastase gene in hepatocellular carcinoma: correlation with angiostatin generation and its clinical significance. Hepatology. 1998;28:986-993. [PubMed] |
| 29. | Gorrin-Rivas MJ, Arii S, Furutani M, Mizumoto M, Mori A, Hanaki K, Maeda M, Furuyama H, Kondo Y, Imamura M. Mouse macrophage metalloelastase gene transfer into a murine melanoma suppresses primary tumor growth by halting angiogenesis. Clin Cancer Res. 2000;6:1647-1654. [PubMed] |
| 30. | Tsujii M, Kawano S, Tsuji S, Sawaoka H, Hori M, DuBois RN. Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell. 1998;93:705-716. [PubMed] |
| 31. | Kang S, Kim YB, Kim MH, Yoon KS, Kim JW, Park NH, Song YS, Kang D, Yoo KY, Kang SB. Polymorphism in the nuclear factor kappa-B binding promoter region of cyclooxygenase-2 is associated with an increased risk of bladder cancer. Cancer Lett. 2005;217:11-16. [PubMed] |