修回日期: 2007-04-21
接受日期: 2007-04-28
在线出版日期: 2007-06-28
目的: 研究外源性人脆性组氨酸三联体(FHIT)基因的高表达对人肝癌细胞Hep3B生长的影响.
方法: 构建一个包含FHIT基因的真核表达载体pcDNA3.1(+)/FHIT, 体外转染人肝癌细胞Hep3B, 逆转录-聚合酶链反应(RT-PCR), 蛋白印迹(Western blot)分别检测目的基因不同水平的表达, 通过细胞生长试验、流式细胞仪分析技术检测细胞转染前后的细胞增殖、细胞周期和细胞凋亡的变化.
结果: 转染pcDNA3.1(+)/FHIT后Hep3B细胞的FHIT-mRNA, FHIT蛋白表达阳性, 转染后对Hep3B细胞的生长有抑制作用, 早期细胞凋亡增加, 与对照组比较差异有显著性(72.23±0.84 vs 54.36±0.78, 53.17±0.52, P<0.05).
结论: FHIT基因通过诱导肿瘤细胞发生凋亡并导致其发生G1期阻滞, 在肿瘤基因治疗方面发挥作用.
引文著录: 许荣华, 郑武平, 孟津, 夏立平, 易继林. 外源性导入抑癌基因FHIT对肝癌细胞Hep3B生长的影响. 世界华人消化杂志 2007; 15(18): 2000-2003
Revised: April 21, 2007
Accepted: April 28, 2007
Published online: June 28, 2007
AIM: To evaluate the effects of the human fragile histidine triad gene on cell proliferation and apoptosis of the Hep3B human hepatocellular carcinoma line.
METHODS: A recombinant pcDNA3.1 (+)/FHIT including functional region of human fragile histidine triad gene (FHIT) was constructed for transfer into human hepatocellular carcinoma cells in vitro. mRNA and protein expressions of the gene in the transfected cells were detected by reverse transcriptase-polymerase chain reaction and Western blot, respectively. MTT [3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide] assay was used to assess the effects of FHIT on proliferation. Cell cycle changes and apoptosis were measured by flow cytometry.
RESULTS: Hep3B cells expressed high levels of FHIT-mRNA and FHIT protein after infection with pcDNA3.1 (+)/FHIT. The growth of Hep3B cells treated with pcDNA3.1 (+)/FHIT was significantly inhibited. pcDNA3.1 (+)/FHIT-infected Hep3B cells showed a significant increase in G0-G1 phase and FHIT-induced apoptosis compared with controls (72.23 ± 0.84 vs 54.36 ± 0.78 and 53.17 ± 0.52, P < 0.05, respectively).
CONCLUSION: Transfer of the FHIT gene inhibited the growth of human hepatocellular carcinoma cells and induced cell apoptosis.
- Citation: Xu RH, Zheng WP, Meng J, Xia LP, Yi JL. Effects of fragile histidine triad gene transduction on growth of Hep3B human hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2007; 15(18): 2000-2003
- URL: https://www.wjgnet.com/1009-3079/full/v15/i18/2000.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i18.2000
1996年Ohta et al[1]采用外显子捕获法(exon trapping)于染色体3p14.2上克隆出FHIT基因. 随后许多学者发现在绝大多数肿瘤中存在FHIT基因的异常, 认为FHIT基因是一重要的肿瘤候选抑癌基因[2-7]. 且肝癌细胞系Hep3B存在FHIT基因的染色体、mRNA和蛋白的异常[8]. 由此我们自行构建一个包含人脆性组氨酸三联体(FHIT)基因的真核表达载体pcDNA3.1(+)/FHIT, 体外转染人肝癌细胞Hep3B, 以探讨FHIT基因在肝癌细胞增殖或凋亡中的作用.
菌株E.coli DH5α和真核表达载体pcDNA3.1(+)为本室保存. PBluescript SK FHIT质粒含FHIT基因全长cDNA(由美国Duke大学Xiaofan Wang教授惠赠). Hep3B细胞株购自上海中科院细胞库. 逆转录-聚合酶链反应(RT-PCR)试剂盒购自日本TaKaRa公司, FHIT Ab购自美国Zymed公司, 细胞周期检测试剂盒购自美国Becton Dickinson公司.
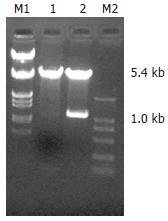
1.2.1 质粒的构建及鉴定: 酶切鉴定正确的PBluescript SK FHIT质粒交由上海生工进行DNA序列测定. 在Ep管中建立酶切反应: pcDNA3.1(或PBluescript SK FHIT)、BamHⅠ, XbaⅠ, 37℃水浴酶切2 h. 取上述酶切产物电泳, 将大小为1.0 kb的FHIT基因片段和5.4 kb线性化的pcDNA3.1用电泳凝胶回收试剂盒回收. 拟构建pcDNA3.1(+)/FHIT, 在Ep管中建立质粒重组反应体系: FHIT基因片段; 线性化的pcDNA3.1; T4连接酶, 16℃水浴12 h, 转化感受态菌DH5α, 挑取克隆进行培养和鉴定.
1.2.2 细胞培养和转染: Hep3B细胞用含100 mL/L特优级胎牛血清(Gibco公司), 加1.0 mmol/L丙酮酸钠, 0.1 mmol/L非必须氨基酸, 在37℃, 50 mL/L CO2饱和湿度下培养. 将生长旺盛的Hep3B细胞接种于6孔板中, 当细胞密度为70%左右时, 按Lipofectamine2000(脂质体转染试剂盒)说明书进行pcDNA3.1(+)/FHIT的转染, 转染后用G418(500 mg/L)进行筛选, G418(250 mg/L)维持筛选. FHIT基因、空载体转染Hep3B细胞分别命名为Hep3B-FHIT和Hep3B-C, 亲本细胞Hep3B作为未转染对照.
1.2.3 RT-PCR: 取G418筛选后的Hep3B-FHIT细胞, 用引物扩增FHIT基因外显子5-外显子9(P1: 5'-ATGTCGTTCAGA-3'; P2: 5'-CTGAAAGTACAC-3')[9], 采用TRIzol法抽提细胞总RNA, 先行反转录, 后进行PCR反应, 产物10 g/L琼脂糖凝胶电泳. PCR反应参数: 94℃预变性5 min; 94℃变性1 min、44℃退火1 min、72℃延伸45 s, 30个循环后72℃再延伸7 min.
1.2.4 Western印迹法: 取筛选后的Hep3B-FHIT细胞, 细胞裂解液处理细胞, 离心后取上清, 考马斯亮蓝法测定蛋白浓度, 120 g/L SDS-聚丙烯酰胺凝胶电泳, 将蛋白转至硝酸纤维膜上, 封闭液封闭, 与FHIT抗体结合, 后用辣根过氧化物酶结合的二抗结合, 增强化学发光法(ECL)显色后照相.
1.2.5 噻唑蓝(MTT)比色法检测转染前后细胞增殖能力: 1×104细胞(每孔200 mL)接种于96孔培养板, 每组细胞接种6孔, 设3个平行孔, 加入MTT(5 g/L)液后继续孵育4 h, 终止培养再加DMSO. 酶联免疫检测仪上测定各孔光密度值(波长为570 nm). 每隔24 h同样以上测定, 连续测定6 d, 观察3组细胞增殖能力变化.
1.2.6 流式细胞仪分析细胞周期及凋亡: 检测前以胰酶消化细胞, 用磷酸盐缓冲液(PBS)洗涤2次, 用预冷的700 mL/L乙醇固定, 4℃过夜. 以PBS洗脱乙醇, 并用PBS制备单细胞悬液, 碘丙锭(PI)染色后, 用流式细胞仪(FCM)分析细胞周期变化及凋亡率.
统计学处理 采用SPSS11.5统计软件进行t检验. 数据以mean±SD表示, P<0.05表示有显著差异.
质粒PBluescript SK FHIT送上海生工生物工程公司测序, 与GenBank的FHIT mRNA序列相符(登陆号: NM_002012). 质粒PBluescript SK FHIT经双酶切BamHⅠ和XbaⅠ后, 琼脂糖凝胶电泳可见1.0和2.7 kb的两条DNA条带(图1). 质粒pcDNA3.1(+)/FHIT经内切酶BamHⅠ和XbaⅠ后, 琼脂糖凝胶电泳可见1.0和5.4 kb的两条DNA条带(图1), 说明pcDNA3.1(+)/FHIT构建成功.
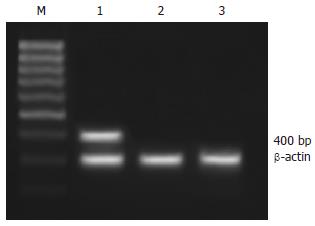
转染pcDNA3.1(+)/FHIT后, Hep3B-FHIT细胞FHIT-mRNA阳性, 为400 bp条带, 而空载体转染细胞Hep3B-C和亲本细胞Hep3B未见此条带的表达(图2).
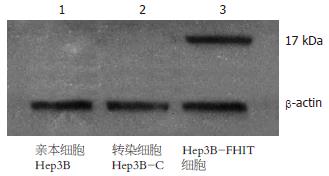
转染pcDNA3.1(+)/FHIT后, Hep3B-FHIT细胞中有17 kDa的FHIT蛋白表达, 而空载体转染细胞Hep3B-C和亲本细胞Hep3B未见FHIT蛋白表达(图3).
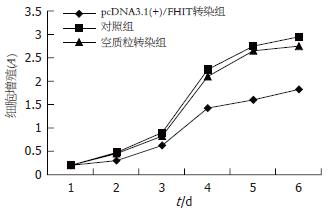
FHIT基因转染细胞Hep3B-FHIT较空载体转染细胞Hep3B-C和亲本细胞Hep3B的生长速度明显减慢, 尤其是达到对数生长期后更加明显, 差异有显著性(P<0.05)(图4).
Hep3B-FHIT细胞G2/M期及S期比例明显下降, G0/G1期比例明显增加, 凋亡细胞率也明显高于对照组和空质粒转染组(P<0.05, 表1).
目前普遍认为, FHIT是第一个将脆性位点和肿瘤联系起来的抑癌基因, 并且FHIT基因异常是肿瘤发生和发展过程中的早期事件[10]. 脆性位点发生断裂会使包含脆性位点的FHIT基因发生断裂、变异和失活而导致细胞异常增生. 与许多其他肿瘤相似, 肝癌中存在FHIT基因的高度变异或缺失. Yuan et al[8]发现64.3%(9/14)的肝癌细胞系存在FHIT基因表达下调, 其中4个出现FHIT mRNA下调的肝癌细胞系均不表达FHIT蛋白; 原位杂交发现29.4%(10/34)的肝癌组织中存在FHIT基因第5外显子的缺失, 61.5%(8/13)的肝癌细胞系中存在LOH或染色体转位; 免疫染色发现50%(5/10)的肝癌细胞系中无FHIT蛋白的表达. Gramantieri et al[10]对28例HCC患者的癌组织和非癌组织、10例正常肝组织研究发现, 异常FHIT转录为46.4%(11例发生于肝癌组织、2例发生于HCC患者的非肝癌组织), 而10例正常肝组织未发现异常转录. 最近的研究表明, 在多种因素诱导的大鼠肝癌发生和发展中也发现有明显的FHIT基因异常[11].
FHIT可能主要通过使APnA水解为ATP和AMP来参与调节体内APnA量的变化. APnA是信号转导分子, 由于发生FHIT基因变异, 肿瘤细胞失去或减弱了FHIT将APnA降解为AMP和ATP的能力, 导致细胞内APnA发生积累. 细胞内大量的APnA积累能够加强生长信号转导, 阻断抑制生长途径或凋亡通道而导致癌变. 另外FHIT蛋白能作用于mRNA帽类似物, 影响重要基因mRNA的翻译, 脱帽功能的丧失也可能引起肿瘤[9]. Siprashvil et al[12]将野生型FHIT和通过定位突变技术制成的没有Ap3A水解酶活性的突变型FHIT转染到缺少FHIT的肿瘤细胞中, 发现FHIT基因异常并不能使细胞获得生长优势, 而可能只是使细胞获得克隆扩增的选择优势, 同时发现他们在抑制成瘤性上差异无显著性. 因此, 认为FHIT蛋白与其底物结合抑制肿瘤发生可能比Ap3A水解酶的活性更重要, 有关FHIT蛋白的功能及作用机制有待进一步研究. 在本实验中, 我们向人肝癌细胞系Hep3B转染含有全长FHITcDNA的真核表达载体, 实验性干预肝癌细胞系Hep3B的基因表达, 以观察转染后肝癌细胞系Hep3B生物学性状的改变. 结果表明, 转染成功的Hep3B细胞, 其FHIT基因的mRNA、蛋白表达阳性. 而空载体转染细胞Hep3B-C和亲本细胞Hep3B未见FHIT基因的mRNA、蛋白表达. 进一步检测转染成功的Hep3B细胞的生物学性状的变化, 我们发现, 成功转染FHIT基因的肝癌细胞其体外增殖能力下降, G2/M期及S期比例明显下降, G0/G1期比例明显增加, 凋亡细胞率也明显高于对照组和空质粒转染组. 初步证实了FHIT基因有诱导肝癌细胞凋亡的作用.
通过本实验研究, 我们认为FHIT基因可能通过使细胞阻滞于G1期, 在其他凋亡诱导因子的协同作用下, 诱发肿瘤细胞发生凋亡. 本实验也证明了这一点, 为临床治疗肝癌提供了一种方法.
研究表明, FHIT基因是一重要的肿瘤候选抑癌基因. 而许多肝癌细胞系包括Hep3B存在FHIT基因的染色体、mRNA和蛋白的异常.
本文的创新之处在于将重要的肿瘤候选抑癌基因FHIT, 转染于存在FHIT基因的染色体、mRNA和蛋白异常的Hep3B肝癌细胞.
本研究自行构建一个包含人脆性组氨酸三联体(FHIT)基因的真核表达载体pcDNA3.1(+)/FHIT, 重点观察体外转染人肝癌细胞Hep3B后细胞生物学性状的变化, 有利于探讨FHIT基因在肝癌细胞增殖或凋亡.
本文通过研究外源性导入抑癌基因FHIT, 对肝癌细胞Hep3B生长的影响, 了解了肝癌的发生机制, 有一定参考意义. 文章总体思路明晰, 研究目的明确, 方案设计合理, 结果、结论较可靠.
编辑: 王晓瑜 电编:张敏
| 1. | Ohta M, Inoue H, Cotticelli MG, Kastury K, Baffa R, Palazzo J, Siprashvili Z, Mori M, McCue P, Druck T. The FHIT gene, spanning the chromosome 3p14.2 fragile site and renal carcinoma-associated t(3; 8) breakpoint, is abnormal in digestive tract cancers. Cell. 1996;84:587-597. [PubMed] |
| 2. | Sozzi G, Pastorino U, Moiraghi L, Tagliabue E, Pezzella F, Ghirelli C, Tornielli S, Sard L, Huebner K, Pierotti MA. Loss of FHIT function in lung cancer and preinvasive bronchial lesions. Cancer Res. 1998;58:5032-5037. [PubMed] |
| 3. | Campiglio M, Pekarsky Y, Menard S, Tagliabue E, Pilotti S, Croce CM. FHIT loss of function in human primary breast cancer correlates with advanced stage of the disease. Cancer Res. 1999;59:3866-3869. [PubMed] |
| 4. | Sorio C, Baron A, Orlandini S, Zamboni G, Pederzoli P, Huebner K, Scarpa A. The FHIT gene is expressed in pancreatic ductular cells and is altered in pancreatic cancers. Cancer Res. 1999;59:1308-1314. [PubMed] |
| 5. | Birrer MJ, Hendricks D, Farley J, Sundborg MJ, Bonome T, Walts MJ, Geradts J. Abnormal Fhit expression in malignant and premalignant lesions of the cervix. Cancer Res. 1999;59:5270-5274. [PubMed] |
| 6. | Thiagalingam S, Lisitsyn NA, Hamaguchi M, Wigler MH, Willson JK, Markowitz SD, Leach FS, Kinzler KW, Vogelstein B. Evaluation of the FHIT gene in colorectal cancers. Cancer Res. 1996;56:2936-2939. [PubMed] |
| 7. | Huebner K, Croce CM. Cancer and the FRA3B/FHIT fragile locus: it's a HIT. Br J Cancer. 2003;88:1501-1506. [PubMed] |
| 8. | Yuan BZ, Keck-Waggoner C, Zimonjic DB, Thorgeirsson SS, Popescu NC. Alterations of the FHIT gene in human hepatocellular carcinoma. Cancer Res. 2000;60:1049-1053. [PubMed] |
| 9. | Barnes LD, Garrison PN, Siprashvili Z, Guranowski A, Robinson AK, Ingram SW, Croce CM, Ohta M, Huebner K. Fhit, a putative tumor suppressor in humans, is a dinucleoside 5',5"'-P1,P3-triphosphate hydrolase. Biochemistry. 1996;35:11529-11535. [PubMed] |
| 10. | Gramantieri L, Chieco P, Di Tomaso M, Masi L, Piscaglia F, Brillanti S, Gaiani S, Valgimigli M, Mazziotti A, Bolondi L. Aberrant fragile histidine triad gene transcripts in primary hepatocellular carcinoma and liver cirrhosis. Clin Cancer Res. 1999;5:3468-3475. [PubMed] |
| 11. | Tsujiuchi T, Sasaki Y, Oka Y, Konishi Y, Tsutsumi M. Fhit gene alterations in hepatocarcinogenesis induced by a choline-deficient L-amino acid-defined diet in rats. Mol Carcinog. 2003;36:147-152. [PubMed] |
| 12. | Siprashvili Z, Sozzi G, Barnes LD, McCue P, Robinson AK, Eryomin V, Sard L, Tagliabue E, Greco A, Fusetti L. Replacement of Fhit in cancer cells suppresses tumorigenicity. Proc Natl Acad Sci U S A. 1997;94:13771-13776. [PubMed] |